Тема 8. Розчини 2 страница
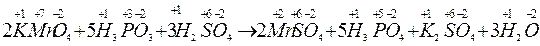
Під час складання рівнянь окисно–відновних реакцій методом електронного балансу слід дотримуватись такої послідовності дій:
– скласти схему рівняння реакції і зазначити вихідні речовини і продукти реакції;
– визначити ступені окиснення всіх елементів, виділити елементи, ступені окиснення яких змінюються;
– скласти електронні рівняння;
– підібрати найменші коефіцієнти, на які треба помножити електронні рівняння, щоб кількість електронів, що віддана, дорівнювала кількості електронів, що приєднана (електронний баланс):
– підібрані коефіцієнти поставити в молекулярному рівнянні поперед формулами відповідних сполук;
– підібрати коефіцієнти біля формул сполук, які не змінюють своїх ступенів окиснення.
Реакція горіння є типовою окисно-відновною реакцією. Кисень повітря в цій реакції виступає в якості окисника, а горюча речовина – в якості відновника.
Контакт окисника та відновника може призвести до хімічної реакції між ними. За деяких умов така реакція може відбуватися у вигляді процесу горіння або вибуху. Особливістю реакцій між сильними окисниками та відновниками є те, що процес горіння може початися за відсутності джерела запалювання, лише через тепловиділення внаслідок хімічної реакції. Такий процес назвається самозайманням. Так, контакт концентрованої азотної кислоти з багатьма органічними речовинами призводить до самозаймання. До такого ж ефекту призводить контакт твердого перманганату калію зі спиртами, альдегідами та карбоновими кислотами. Ні азотна кислота, ні перманганат калію за звичайних умов не здатні горіти (негорючі речовини), але, як можна побачити з наведених прикладів, обидві ці речовини є пожежонебезпечними.
Запитання до самоконтролю
1. Які реакції називаються окисно-відновними?
2. Який процес називається окисненням, а який відновленням?
3. Що таке окисник і відновник?
4. Що таке ступінь окиснення?
5. Які є типи окисно-відновних реакцій?
6. У чому полягає суть методу електронного балансу?
7. Яка речовина є окисником в реакціях горіння в повітрі?
Тема 11. Електрохімічні процеси. Хімічні джерела струму.
Електроліз
Рівняння Нернста:
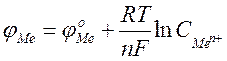 ,
,
де j0 – стандартний електродний потенціал; R – газова стала (8.314 Дж/моль´К); T – температура, К; n – заряд іона; F –число Фарадея (96500 Кл/моль); C – молярна концентрація (моль/л).
В більшості випадків відповідні розрахунки проводяться за стандартної температури (298 К). В такому випадку рівняння Нернста має вигляд:
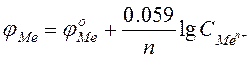 .
.
Однією з найважливіших характеристик гальванічного елемента є його електрорушійна сила (ЕРС). ЕРС дорівнює різниці потенціалів між позитивним та негативним полюсами гальванічного елемента.
Електрод, на якому відбувається процес окиснення, називається анодом (негативний полюс гальванічного елемента). Електрод, на якому відбувається процес відновлення, називається катодом (позитивний полюс гальванічного елемента). Природньо, що різниця потенціалів катода та анода є ЕРС.
ЕРС = jк – jА .
ЕРС пов’язана зі зміною енергії Гіббса і константою рівноваги реакції, що відбувається в гальванічному елементі, рівнянням:
DG = –nFE, lnK = (nF/ RT) E0.
Хімічні джерела струму – це пристрої, в яких енергія окисно-відновних реакцій перетворюється безпосередньо на електричну. Розрізняють три основних типи хімічних джерел струму: гальванічні елементи, акумулятори і паливні елементи.
В хімічних джерелах струму електрична енергія виробляється завдяки процесам, що відбуваються в електрохімічних системах. Ці процеси відбуваються самочинно.
Приклад 35.
Розрахувати ЕРС гальванічного елемента:
A(–)Zn½ZnSO4(C=0,01M)½½CuSO4(C=1,0M)½Cu(+)K
Напишіть рівняння реакції, що відбувається під час роботи гальванічного елемента.
Розв'язання.
Значення електродних потенціалів визначається за рівнянням Нернста:
j(Zn/Zn2+)=j°(Zn/Zn2+)+(0,059/2)lg0,01 = – 0,819 B.
j(Cu/Cu2+) =j°(Cu/Cu2+) + (0,059/2) lg1 = + 0,337 B.
ЕРС (Е) визначається різницею електродних потенціалів катода та анода:
E = j(K) – j(A) = 0,337 – (–0,819) = 1,156 B.
На аноді відбувається окислювальний процес: (A) Zn – 2e = Zn2+
На катоді відбувається відновний процес: (K) Cu2+ + 2e = Cu.
Сумарне рівняння реакції буде мати вигляд: Zn + Cu2+ = Zn2+ + Cu.
Якщо електричний струм пропустити через електрохімічну систему, в ній почнуть відбуватися процеси під дією електричної енергії. Ці процеси відбуваються не самочинно, а примусово: якщо зовнішнє джерело струму відключити, ці процеси припиняться. Сукупність таких процесів називають електролізом.
Електроліз – це сукупність процесів, що відбуваються на електродах при протіканні постійного електричного струму через розчин або розплав електроліту.
Анод, як і у випадку гальванічного елемента, це електрод, на якому відбувається процес окиснення. При електролізі він має позитивний знак.
Катод – електрод, на якому відбувається відновний процес, має негативний знак. Знаки катода та анода для процесів електролізу зворотні, у порівнянні зі знаками електродів в хімічних джерелах струму. При електролізі на електродах, з точки зору енергетики, проходять протилежні, у порівнянні з хімічними джерелами, процеси: в першому випадку – примусові, в другому – самочинні.
Катодні процеси. На катоді, в першу чергу, відновлюються катіони неактивних металів (тих, що в ряду стандартних електродних потенціалів стоять після водню). Катіони найбільш активних металів (від літію до алюмінію включно) не відновлюються на катоді. Метали середньої активності (після алюмінію – до водню) відновлюються на катоді разом з молекулами води:
2H2O+2e=H2+2OH–; Men++ne = Me°.
Анодні процеси. Процеси, що відбуваються на аноді, залежать як від електроліту, так і від матеріалу анода. Розрізняють розчинні (активні) аноди (Cu, Ag, Zn, Ni та інш.) і нерозчинні (інертні) (Pt, графіт). У випадку активних анодів має місце окиснення матеріалу анода:
Me – ne = Men+.
У випадку інертних анодів має місце окиснення молекул води або аніонів:
2H2O–4e=4H++O2; 2Hal––2e=Hal2,
де Hal – галоген.
На аноді найбільш ймовірним є процес, стандартний потенціал якого є найбільш негативним. У випадку інертного анода у більшості випадків окиснюються аніони безкисневих кислот (Cl–, Br–, I–, S2–). Якщо в розчині є тільки іони кисневмісних кислот ( і F–) то окиснюються молекули води.
Перший закон Фарадея:
Маса речовини, що виділяється на електроді під час електролізу, пропорційна кількості електрики, яка пройшла крізь розчин:
m = k Q ,
де Q – кількість електрики (Кл).
У випадку сталого струму( I = const ).
Q = I .t. m = k I t,
де t – час (с).
Другий закон Фарадея:
Однакові кількості електрики, що проходять крізь розчини різних електролітів, під час електролізу виділяють еквівалентні кількості речовин.
Другий закон Фарадея можна виразити рівнянням:
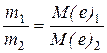 ,
,
де М(e) – молярні маси еквівалентів. Для електрохімічних процесів: М(e) = М/n, (n) – кількість електронів, необхідна для утворення 1 моль речовини на електродах.
При проходженні крізь електроліт 96500 кулонів електрики, виділяється один еквівалент будь-якої речовини. Цю кількість електрики називають “фарадеєм” і позначають літерою F.
На основі двох законів Фарадея можна записати рівняння, що дозволяють розрахувати масу або об’єм (для газів), які виділяються на електродах під час електролізу:
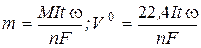 ,
,
w - вихід за струмом (якщо нема побічних процесів w =1) .
Приклад 36.
Скільки і яких речовин виділиться на електродах при електролізі розчину сульфату цинку з інертними електродами, якщо протягом 1 години пропущено струм силою 5 А? Вихід за струмом металу та водню на катоді складають по 50 %, вихід за струмом газу на аноді 100% .
Розв'язання.
1). На катоді перебігають такі реакції:
(К) Zn2+ + 2e = Zn, 2H2O + 2e = H2 + 2OH–.
На аноді вилучиться кисень
(А) 2H2O – 4e = 4H+ + O2.
Маса речовин, що утворюється при електролізі, визначається законом Фарадея: m = m(e).I.t.w / F,
m(e)(Zn)=А(Zn)/2=65,4/2=32,7г/моль; m(e)(O)=А(О)/2=16/2=8 г/моль;
m(e)(H) = А(Н)/1=1 г/моль.
m(Zn)=32.7×5×3600×0,5/96500=3,05г; m(H)=1×5×3600×0,5/96500=0,093 г.;
m(O)=8×5×3600/96500= 1,49 г.
Запитання для самоконтролю
1. Що таке стандартний електродний потенціал?
2. Як розрахувати потенціал електрода?
3. Як називають електроди в хімічних джерелах струму?
4. Що таке електроліз?
5. Чим відрізняється електроліз розчинів від електролізу розплавів?
6. Яка кількість речовини окислюється або відновлюється на електродах при проходженні 96500 Кл електрики?
7. Які метали не можна добути шляхом катодного відновленíя водних розчинів?
Тема 12 Корозія металів
Корозія – це руйнування металів внаслідок їх хімічної або електрохімічної взаємодії з навколишнім середовищем. Причиною корозії є термодинамічна нестійкість металів по відношенню до кисню і вологи повітря.
Є багато класифікацій типів корозії за різними ознаками. Найбільш поширені класифікації типів корозії за такими ознаками: за механізмом процесу, за умовами протікання, за характером корозійних пошкоджень.
За механізмом процесу розрізняють такі типи корозії: хімічний, електрохімічний, електричний, біологічний.
За умовами протікання розрізняють такі типи корозії: атмосферний, морський, грунтовий, високотемпературний.
За характером корозійних пошкоджень розрізняють такі типи корозії: суцільний, місцевий.
“Хімічною корозією” називається руйнування металу при прямій взаємодії з окисником (у більшості випадків – з киснем повітря). Хімічна корозія відбувається на поверхні металу без виникнення електричного струму в системі.
Головний фактор, що впливає на процес хімічної корозії, – властивості оксидної плівки, що утворюється на поверхні металу або сплаву. Якщо плівка, що утворилася на поверхні металу, суцільна та не проникна для молекул оксигену, то така плівка захищає метал від корозії. Суцільність плівки оцінюють за допомогою критерію Пілліга – Бедвордса.
Захисними властивостями володіють плівки на поверхні таких металів, для яких відношення молярного об'єму оксиду до об'єму металу, з якого утворився цей оксид, знаходиться в межах 1 < 2,5
1 < Vокс/n VMe < 2,5
Приклад 37.
Чи має захисні властивості оксидна плівка на поверхні барію? Густина барію та його оксиду складають 970 і 2270 кг/м3 відповідно.
Розв'язання.
1. Захисні властивості оксидної плівки визначаються за допомогою критерію Піллінга–Бедвордса. Захисними властивостями володіють плівки на поверхні таких металів, для яких відношення молярного об'єму оксиду до об'єму оксиду, з якого утворився оксид, знаходиться в межах 1–2,5.
2. 2Ва + О2 = 2ВаО
3. V(оксиду)=m(оксиду)/r(оксиду)=0,153/2270 = 6,74´10-5 м3
4. V(металу)=m(металу)/r(металу) = 0,137/970 = 1,41´10-4 м3
5. V(оксиду)/V(металу)= 6,74´10-5/1,41´10-4=0,478.
Плівка оксиду барію не володіє захисними властивостями.
При контакті металу з електропровідним середовищем (у більшості випадків – з вологою повітря) корозія відбувається за електрохімічним механізмом. Основними умовами виникнення електрохімічної корозії є:
– контакт металу з електропровідним середовищем;
– електрохімічна неоднорідність поверхні металу.
При виконанні таких умов виникають короткозамкнені гальванічні елементи (гальванопари), які можна зобразити схемою:
A (–) Me1 | Розчин | Me2 (+) K.
треба мати на увазі, що Me1 більш активний ніж Me2 .
На аноді буде відбуватися процес окиснення:
(А) Мe1 – ne = Me n+.
На катоді в залежності від умов можуть відбуватися такі процеси:
– в кислому середовищі: (K) 2H+ + 2e = H2 ,
– в нейтральному або лужному середовищі: О2 + 2Н2О + 4е = 4ОН –.
Для захисту від корозії використовуються різноманітні методи:
- нанесення захисних покриттів (фарби, лаки, інші метали);
- створення штучних захисних плівок (анодування);
- використання корозійностійких сплавів;
- зміна властивостей середовища (використання інгібіторів корозії).
Під час пожежі завдяки суттєвому нагріванню металоконструкцій, значно прискорюється газова корозія металів, яка відбувається за хімічним механізмом. А підвищення температури впливає не тільки на корозію металу, а й на його механічні характеристики. Тому треба розрізняти поняття жаростійкість та жароміцність.
Жаростійкість – це здатність металу чинити опір корозії за високих температур. Жароміцність – це здатність металу підтримувати свої механічні властивості за високих температур. В більшості випадків під час пожежі відбувається руйнування металевих конструкцій завдяки погіршенню їх механічних властивостей, а не корозії металу.
Після гасіння пожежі металеві конструкції, які знаходилися під впливом високих температур, піддаються прискореній корозії, завдяки руйнуванню поверхневих захисних покриттів, попаданню вологи у важкодоступні місця. За наявності вологи процес корозії металів значно прискорюється, завдяки тому, що корозія починає відбуватися за електрохімічним механізмом. Особливо процес корозії прискорюється, якщо при гасінні були використані різні хімічні засоби пожежогасіння: порошки, піни, фреони. В такому випадку у воду потрапляють різні речовини, які можуть виступати в якості активаторів корозії. Активаторами електрохімічної корозії можуть виступати іони Cl–, Br– , I– , SO42– . Ці іони входять до складу вогнегасних порошків і хімічних пін.. Особливо підвищується швидкість корозії, якщо до води потрапляють кислоти. Хлороводнева кислота, наприклад, утворюється при горінні деяких платмас та термічного розкладання фреонів.
Приклад 38.
Як відбувається корозія заліза, покритого міддю а) у вологому середовищі; б) в кислому середовищі, якщо це покриття пошкоджено?
Розв'язання.
При контакті двох металів, що знаходяться в електропровідному розчині, виникають гальванопари:
а) у вологому повітрі: А(–)Fe½H2O, O2½Cu(+)K;
б) у кислому середовищі: А(–)Fe½H2O, H+½Cu(+)K.
Більш активний метал - залізо буде в обох випадках окислюватися:
(А) Fe – 2e ® Fe2+
Менш активний метал — мідь буде грати роль катода, на якому проходитимуть такі процеси:
а) (К) O2 + H2O + 4e = 4 OH–, б) (К) 2H+ + 2e = H2.
Таким чином, можна зробити висновок, що менш активний метал – мідь не захищає більш активний метал – залізо у разі пошкодження мідного покриття.
Запитання для самоконтролю
1. Що таке корозія і окиснення? Яка між ними різниця?
2. Які існують основні типи корозії за механізмом процесу?
3. Сформулювати умови суцільності оксидних плівок на повеорхні металів.
4. Який тип корозії наявний під час пожежі?
5. Які умови протікання корозії за електрохімічним механізмом?
6. За якими правилами записуються гальванопари, що утвориюються при контакті металу з електропровідним середовищем?
7. Який з двох металів гальванопари буде анодом, а який – катодом?
8. Які методи захисту від корозії відомі вам?
9. Сформулюйте правила за якими підбираються метали для протекторного захисту?
Розділ 5. Хімічні властивості неорганічних сполук.
Тема 13. Хімія металів.
Класифікація та номенклатура неорганічних сполук
Речовини за складом поділяються на прості та складні. Серед простих речовин розрізняють метали та неметали. Складні речовини поділяються на органічні та неорганічні. До органічних сполук відносять сполуки карбону, крім оксидів карбону, карбонатної (вугільної) кислоти, солей карбонатної кислоти та сполук карбону з металами (карбідів). До неорганічних сполук відносять сполуки всіх інших елементів. Вони поділяються на такі основні класи: оксиди, основи, кислоти та солі.
Оксидами називаються речовини, що складаються з двох елементів, одним з яких є оксиген зі ступенем окиснення –2. Назва оксиду складається зі слова «оксид» та назви елемента. Після назви елемента, який має змінну ступінь окиснення, вказується його ступінь окиснення. Наприклад, NO – оксид нітрогену(ІІ), N2O- оксид нітрогену(І). Оксиди поділяються на солетворні та несолетворні. Оксиди, які не утворюють солей, називаются, несолетворними (NO, N2O, CO). Солетворні оксиди поділяються на основні, кислотнітаамфотерні.
Основні оксиди – це оксиди, яким відповідають їх гідрати – основи. До основних оксидів відносяться оксиди лужних, лужноземельних, а також інших металів у нижчих ступенях окиснення. Вони реагують з кислотними оксидами, кислотами та амфотерними основами і оксидами з утворенням солей:
CaO + CO2 = CaCO3; K2O + 2HCl = 2KCl + H2O;
Na2O + Al2O3 = 2NaAlO2.
Оксиди лужних і лужно-земельних металів утворюють з водою основи (луги):
K2O + H2O = 2KOH; CaO + H2O = Ca(OH)2.
Кислотні оксиди – це оксиди, яким відповідають їх гідрати – кислоти. Більшість кислотних оксидів взаємодіють з водою з утворенням кислот:
SO3 + H2O = H2SO4; 2NO2 + H2O = HNO2 + HNO3.
З лугами кислотні оксиди утворють сіль і воду:
SiO2 + 2KOH = K2SiO3 + H2O.
З основними та амфотерними оксидами кислотні оксиди утворюють солі:
P2O5 + 3CaO = Ca3 (PO4)2; P2O5 + Al2O3 = 2AlPO4.
Амфотерними називаються оксиди, які, залежно від умов, виявляють властивості основних або кислотних оксидів. До амфотерних належать оксиди деяких металів головних підгруп (Be, Al), а також оксиди багатьох металів побічних підгруп періодичної системи елементів у проміжних ступенях окиснення ( MnO2, Fe2O3, ZnO ).
Якщо в сполуках з іншими елементами оксиген має ступінь окиснення –1, то такі сполуки називаються пероксидами, а якщо –1/2, то – супероксидами. Найбільш відомий пероксид – пероксид гідрогену Н2O2.
Основами називають сполуки, які складаються з атома металу та гідроксигруп ОН–.Носієм основних властивостей є гідроксигрупа. Основи також називають гідроксидами. Назви гідроксидів складаються зі слова «гідроксид» і назви елемента з указанням ступені окиснення елемента (якщо елемент може мати різні ступені окиснення). Наприклад, Cu(OH)2 – гідроксид купруму (ІІ), Fe(OH)3 – гідроксид феруму (ІІІ). Основи реагують зі своєю хімічною протилежністю – кислотами – з утворенням солі та води. Такі реакції називаються реакціями нейтралізації:
КОН + HCl = KCl + H2O.
Основи також реагують з кислотними та амфотерними оксидами:
Ca(OH)2 + CO2 = СаСО3 + Н2О, 2КОН + Сr2O3 = 2KCrO2 + H2O.
Сильні основи (луги) реагують з амфотерними гідроксидами:
NaOH + Al(OH)3 = Na[Al(OH)4].
Кислотами називаються сполуки, до складу яких входять атоми водню, здатні заміщуватися атомами металів. Носієм кислотних властивостей є іон водню Н+. Хімічною протилежністю кислот є основи, з якими вони реагують, утворюючи сіль і воду:
2НCl + Cu(OH)2 = CuCl2 + 2H2O.
Кислоти взаємодіють з основними та амфотерними оксидами:
2HNO3 + CaO = Ca(NO3)2 + H2O, ZnO + 2HCl+ = ZnCl2 + H2O.
Характерною особливістю кислот є здатність їх реагувати з металами:
Fe +2HBr = FeBr2 + H2,, Cu + 4HNO3(конц) = Cu(NO3)2 +2NO2 + 2H2O.
Нижче наведені формули і систематичні назви деяких кислот та їх солей (кислотних залишків).
Інколи використовують тривіальні (неноменклатурні) назви кислот. Наприклад, H2SO4 – сірчана кислота, НNО3 – азотна кислота, НС1 – соляна кислота.
Таблиця 1
| Формула | Назва кислоти | Назва солі | Формула | Назва кислоти | Назва солі |
| H2SO4 | сульфатна | сульфат | Н2SО3 | сульфітна | сульфіт |
| НNО3 | нітратна | нітрат | НNО2 | нітритна | нітрит |
| Н3РО4 | ортофосфатна | ортофосфат | НРО3 | метафосфатна | метафосфат |
| Н3РО3 | фосфітна | фосфіт | Н2SіО3 | метасилікатна | метасилікат |
| Н4SіО4 | ортосилікатна | ортосилікат | Н2СО3 | карбонатна | карбонат |
| СН3СООН | ацетатна | ацетат | НF | фторидна | фторид |
| НСl | хлоридна | хлорид | НВr | бромідна | бромід |
| НІ | іодідна | іодід | Н2S | сульфідна | сульфід |
Проміжними за властивостями між кислотами та основами є амфотерні гідроксиди. Їх властивості залежать від умов, тобто від природи другого компонента, який бере участь у кислотно-основній взаємодії:
Al(OH)3 + 3HCl = AlCl3 + 3H2O , Al(OH)3 + KOH = K[Al(OH)4].
Солі – це продукти повного або часткового заміщення водню кислоти металом, або продукти обміну гідроксигрупи гідроксидів металів на кислотні залишки кислот. Солі бувають середні, кислі та основні. Кислі солі мають у складі атоми гідрогену, а основні – гідроксигрупи (КНСО3,, Аl(OH)2Cl). Солі утворюються за реакцією кислот і основ. В залежності від співвідношення реагентів можуть, утворюватися такі різновиди солей:
3H2SO4 + 2Al(OH)3 = Al2(SO4)3 + 6H2O,
H2SO4 + Al(OH)3 = Al(OH)SO4 + 2H2O,
3H2SO4 + Al(OH)3 = Al(HSO4)3 + 3H2O,
під час реакцій утворюються сульфат алюмінію, сульфат гідроксиалюмінію та гідрогенсульфат алюмінію відповідно.
Назви солей складаються з назви кислотного залишку (табл. 1) та назви металу з указанням ступені окиснення (якщо метал має змінні ступені окиснення). Наприклад, Al2(SO4)3 – сульфат алюмінію, Сr2(SO4)3 – сульфат хрому (ІІІ). У назвах кислих солей до назви аніона додають числівник (крім випадку одиниці), що відповідає числу атомів Гідрогену в молекулі, і слово “гідроген”. Наприклад, КНСО3 – гідрогенкарбонат калію, КН2РО4– дигідрогенфосфат калію. Аналогічно складаються назви основних солей. Наприклад, Bi(OН)2 NО3 – нітрат дигідроксобісмуту (ІІІ).
Крім основних чотирьох класів неорганічних сполук, відомо ще декілька класів сполук, які будуть розглянуті далі.
Приклад 39.
Дати назву таким сполукам: K3PO4, K2HPO4, Al(OH)2Cl, SO2, PCl3, Al(OH)3,. До якого класу сполук відносяться ці речовини.
Розв'язання.
K3PO4, – (орто)фосфат калію – сіль, K2HPO4 – гідрогенфосфат калію – кисла сіль, Al(OH)2Cl – дигідроксид хлорид алюмінію – основна сіль, SO2 – оксид сульфуру (IV) – оксид, PCl3 – хлорид фосфору (III), Al(OH)3 – гідроксид алюмінію – основа.
Запитання до самоконтролю
1. Які речовини називаються простими, а які складними?
2. Які речовини відносятся до органічних, а які до неорганічних?
3. Перерахуйте основні класи неорганічних сполук?
4. Які типи оксидів вам відомі?
5. Що таке пероксиди і супероксиди?
6. Які типи солей вам відомі?
7. Як уворюються назви солей, основ і оксидів?
8. Назвить максимально можливу кількість кислот і запишить іх формули.
Загальна характеристика металів
Більшість хімічних елементів є металами. Межа між металами та неметалами проходить в періодичній системі по елементах: Be-Al-Ge-Sb-Po. S і р – елементи, які знаходяться ліворуч від діагоналі, є металами, праворуч від діагоналі – неметалами. Всі d i f – елементи відносяться до металів. Деякі елементи за властивостями займають проміжне положення між двома групами елементів. Тому поділ елементів на метали та неметали деякою мірою є умовним.
Дата добавления: 2015-03-07; просмотров: 1124;
