Тема 8. Розчини 1 страница
Розчинами називаються гомогенні термодинамічно стійкі системи змінного складу з двох і більшого числа компонентів.
Способи вираження складу розчинів.
Масова частка — це відношення маси розчиненої (речовини (m1) до маси розчину (Smi) :
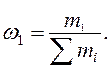
Масову частку виражають у частках одиниці або у відсотках (0,5 або 50 %) і позначають літерою w - омега.
Мольна частка (N1) – це відношення кількості розчиненої речовини (n1)до суми кількостей всіх речовин у розчині (Sni).
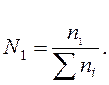
Молярна концентрація (С) — це відношення кількості розчиненої речовини (n1) до об'єму розчину (V). Молярність виражають у молях на літр (скорочено М).
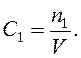
Молярна концентрація еквівалента (Секв ) — це відношення кількості молей еквівалента розчиненої речовини (nекв) до об'єму розчину.
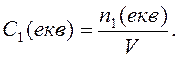
Моляльність (Сm) – число молей розчиненої речовини (n1 ), що міститься в 1000 г розчинника.
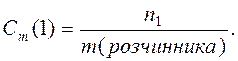
Приклад 21.
Визначте масову долю нітратної кислоти в розчині, 1 л якого містить 224 г HNO3, густина розчину 1,12 г/мл.
Розв'язання.
Маса розчину: m = r V = 1,12 г/мл 1000 мл = 1120 г.
Масова доля розчиненої речовини буде: 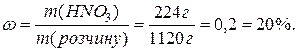
Приклад 22.
Визначити молярну концентрацію фосфатної кислоти в розчині з масовою часткою її 47,7%, густина розчину дорівнює 1.315 г/мл.
Розв'язання.
В 100 г розчину знаходяться 47,7 г Н3РО4 і 53,3 г Н2О.
Об’єм розчину дорівнює: V = m/r = 100г / 1,315г/мл = 76 мл.
Молярна концентрація буде:
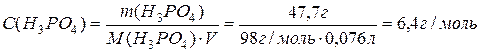
Речовини, які розкладаються в розчині на іони, називаються електролітами. Речовини, які не розкладаються на іони, називаються неелектролітами. Процес розпаду речовин на іони називається електролітичною дисоціацією. Позитивно заряджені іони називаються катіонами, негативно заряджені – аніонами.
Кількісною характеристикою повноти перебігу електролітичної дисоціації є ступінь дисоціації a, яка дорівнює відношенню числа молекул електроліту, що розщепились у розчині на іони, до загального числа молекул у розчині. Ступінь дисоціації виражається дробовим числом і змінюється від 0 до 1 (0 ... 100 %). За величиною ступеня дисоціації електроліти поділяють на сильні та слабкі. Сильними є електроліти, ступінь дисоціації яких у 0,1 М водному розчині перевищує 30%, слабкими — ступінь дисоціації яких у 0,1 М водному розчині менший за 3%. До сильних електролітів належать майже всі солі, луги, деякі кислоти (НСl, НClo4 НNО3, Н2SО4 тощо), до слабких — більшість основ, амфотерні гідроксиди, деякі кислоти (H2S, Н3ВО3, HCN, Н2SiО3 , H2CO3, НNО2, Н2SО3 тощо).
Більш зручною характеристикою сили електроліту є константа дисоціації. Для електроліту КА, який дисоціює згідно з рівнянням:
КА = К+ + А–,
константа дисоціації запишеться:
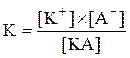 .
.
Константа і ступінь дисоціації пов’язані рівнянням Освальда:
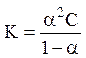 ,
,
де С – загальна концентрація електроліту.
Константа дисоціації залежить від природи електроліту, температури, розчинника, але не залежить від концентрації електроліту.
Приклад 23.
Розрахуйте концентрацію іонів в розчині сульфату натрію, концентрація якого складає 1 моль/л.
Розв'язання.
Оскількі ця сіль є сильним електролітом, то вона дисоціює повністю:
Na2SO4 = 2Na+ + SO42–.
З рівняння дисоціації маємо:
[Na+] = 2 C(Na2SO4) = 2 1= 2 моль/л. [SO42–] = C(Na2SO4) = 1моль/л.
Приклад 24.
Концентрація ціанід–іонів в 1 М розчині синильної (ціанідної) кислоти дорівнює 2 10–5 моль/л. Визначте ступінь і константу дисоціації кислоти.
Розв'язання.
Рівняння дисоціації має вигляд: HCN = H+ + CN–.
Ступінь дисоціації визначається за формулою: a = Сіонів/Сзагальне = 2 10–5/ 1 = 2 10–5.
Згідно з рівніння Освальда:
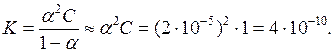
Закон Рауля:
відносне зниження тиску насиченої пари розчинника над розчином дорівнює мольній частці розчиненої речовини.
(р0 – р1) / р0 = N2,
Другий варіант формулювання закону Рауля:
тиск насиченої пари над розчином дорівнює добутку його тиску над чистим розчинником на мольну частку розчинника.
р1 = р0 ∙ N1 ,
де N1 – мольна частка розчинника; N2 – мольна частка розчиненої речовини;
р0 – тиск пари над розчинником; р1 – тиск пари над розчином.
Температура замерзання та температура кипіння розчину залежать від його складу.
підвищення температури кипіння DТкип і зниження температури замерзання DТзам розчину прямо пропорційні моляльності розчину (Ст):
DТкип =Е ∙ Сm, DТзам = K ∙ Сm.
Е і K — відповідно ебуліоскопічна і кріоскопічна сталі розчинника.
Закон осмотичного тиску Вант-Гоффа
осмотичний тиск розчину (Росм) прямо пропорційний його молярной концентрації (с) та температурі (Т).
Росм =1000 ∙ c ∙ R ∙ T,
де R — універсальна газова стала (8,314 Дж/(моль • К)).
Відмічені закони справедливі для електролітів в дещо зміненому вигляді
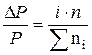 ,
,
DТкип = і ∙ Е∙ Сm,
DТзам = і ∙ К∙ Сm ,
Росм = i ∙C ∙R ∙T.
де i – ізотонічний коефіцієнт.
Ізотонічний коефіцієнт можна розрахувати, якщо відома ступінь дисоціації (a) і кількість часток на які розпадається електроліт (n):
i = 1 + a (n-1).
Приклад 25.
Визначити температуру замерзання 20% водного розчину гліцерину (CH2OH–CHOH–CH2OH), якщо кріоскопічна стала води 1,86.
Розв'язання.
Згідно з законом Рауля:
DTзам = ККР ´ m1´ 1000/(M ´ m2)
де ККР - кріоскопічна стала;
m1 і М - маса розчиненої речовини та її молярна маса;
m2 - маса розчинника.
Розглянемо 100 г розчину. Тоді m1 = 20 г; m2= 80 г;
М=12´3+8´1+16´3=92 г/моль.
DTзам = 1,86 ´ 20 ´ 100 / (92 ´ 80 ) = 0,5 К.
Tзам = 0°С – DТзам = – 0,5 °С.
Між молекулами та іонами в розчинах можуть відбуватись реакції. Такі реакції називають іонообмінними.
Реакції обміну в розчинах електролітів практично протікають у бік утворення осаду, газів і слабких електролітів. При складанні іонних рівнянь треба керуватися тим, що сильні електроліти, які практично повністю дисоційовані, пишуться у вигляді іонів, а речовини малодисоційовані, малорозчинені і газоподібні зображуються в молекулярній формі.
Наприклад:
2AgNO3 + CaCl 2 = 2AgCl¯ + Ca(NO3)2 (молекулярне рівняння),
2Ag+ + 2NO3– + Ca 2+ + 2 Cl – = 2AgCl ¯ + Ca2+ + 2 NO3–,
2Ag++ 2 Cl –= 2AgCl ¯ (скорочене іонне рівняння),
2HCl + Na2S = H2S + 2 NaCl,
2H+ + 2Cl– + 2 Na+ + S2– = H2S + 2Na+ + 2Cl–,
2H+ + S2– = H2S,
HCl + KOH = KCl + H2O,
H+ + Cl– +K+ + OH-– = K+ +Cl– + H2O,
H+ + OH-– = H2O (скорочене іонне рівняння).
Деякі іонообмінні реакції використовуються в пожежній справі. Наприклад, в хімічно–пінних вогнегасниках використовується реакція:
2NaHCO3 + H2SO4 = Na2SO4 + 2H2O + 2CO2
Гідроліз.
Вода є слабким електролітом, що дисоціює за рівнянням:
Н2О = Н+ + ОН–.
Іонним добутком (Кв) води називається добуток рівноважних концентрацій іонів Н+ і ОН–, який є постійною величиною, що дорівнює 10-14.
Кв = [Н+ ] × [ОН– ] = 10-14.
Для характеристики реакції середовища доцільно користуватися водневим показником
рН = –lg [H+].
В нейтральному середовищі рН = 7, в кислому рН < 7, в лужному середовищі рН > 7.
Приклад 26.
Розрахуйте рН 0,1 М розчину КОН.
Розв'язання.
Гідроксид калію є сильним електролітом, тому концентрація іонів ОН– дорівнює 0,1 моль/л.
Запишем вираз для іонного добутку Кі = [H+] [OH–] = 10–14. Звідси:
[H+] = Кі / [OH–] = 10–14 / 0,1 = 10–13.
рН = – lg [H+] = – lg 10–13 = 13.
Приклад 27.
Розрахуйте рН 0,1 М розчину CH3COOH , якщо відомо, що константа дисоціації CH3COOH дорівнює 1,7 10–5..
Розв'язання.
Ацетатна (оцтова) кислота є слабким електролітом. Для розрахунків концентрацій іонів використуємо рівняння Освальда:
К = a2С, 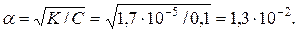
Концентрація іонів гідрогену буде:
[H+] = a C = 1,3 10-2 0,1 = 1,3 10-3.
рН = – lg [H+] = – lg 1,3 10–3 = 2.89.
Гідролізом солей називається обмінна реакція взаємодії іонів розчиненої солі з водою, в результаті якої утворюються малодисоційовані сполуки та змінюється рН середовища.
Більшість солей є сильними електролітами, вони дисоціюють на катіони металів та аніони кислотних залишків. Якщо катіону (Ме+) відповідає слабка основа, він зв’язує іони ОН–:
Ме+ + Н2О = МеОН + Н+.
Якщо аніону (А–) відповідає слабка кислота, він зв’язує іони Н+:
А– + Н2О = НА + ОН–.
В першому випадку з’являються іони Н+, що обумовлює підкислення розчину, а в другому випадку – іони ОН–, що обумовлює появу лужного середовища.
Приклад 28.
Скласти молекулярні та іонні рівняння гідролізу ціаніду калію. Який характер буде мати розчин?
Розв’язання.
Ціанід калію – сіль, що утворена слабкою кислотою (НСN) і сильною основою (КОН), гідроліз буде відбуватися по аніону.
Рівняння в молекулярному вигляді:
KCN + H2O = HCN + KOH.
Рівняння в іонному вигляді:
CN– + H2O = HCN + OH–.
В звязку з утворенням іонів OH– середовище буде лужним.
Добуток концентрацій іонів, на які дисоціює електроліт в насиченому розчині речовини за сталих температури й тиску, є сталою величиною. Цю величину називають добутком розчинності (ДР).
Добуток розчинності солі КnAm становитиме:
ДР(КnAm) = [K m+]n ´ [An-]m
За допомогою величин ДР можна сформулювати правила випадіння осаду: якщо добуток концентрацій іонів більший, ніж значення ДР солі, то осад випадає, якщо менший – не випадає.
Приклад 29.
Випаде, чи ні осад при змішуванні 200 мл 0,001 М розчину AgNO3 i 100 мл 2 10-5 М розчину HCl. (ДРAgCl = 1,7 10-10)
Розв'язання.
Випадіння осаду можливе при виконанні нерівності:
[Ag +] ´ [Cl-] > ДР(AgCl)
Після змішування концентрації іонів змінються завдяки розведенню:

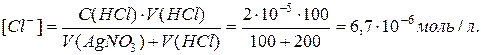
[Ag +] ´ [Cl-] = 4,5 10-9 > ДР(AgCl).
Тобто осад AgCl випаде.
Запитання для самоконтролю
1. Що таке розчини?
2. Що таке розчинність?
3. Що таке молярна концентрація, моляльність і мольна частка?
4. Як залежить тиск насиченої пари над розчином від його концентрації?
5. Як розрахувати температуру замерзання та температуру кипіння розчину?
6. Що таке осмотичний тиск?
7. Що таке електроліти та неелектроліти?
8. Що таке константа та ступінь дисоціації?
9. Які властивості води дозволяють використовувати її в пожежогасінні?
10. Що таке водневий показник середовища?
11. Чому дорівнює йонний добуток води?
12. В яких випадках можуть перебігати іонообмінні реакції?
13. Що таке гідроліз солей?
Тема 9. Колоїдні системи
Колоїдні системи – це системи в яких одна або декілька речовин знаходяться в високодисперсному стані. Основною колоїдно–хімічною характеристикою є дисперсність. Залежно від розмірів часточок дисперсної фази розрізняють: істинні розчини; колоїдні розчини; грубодисперсні системи.
Колоїдні системи характеризуються розміром часточок дисперсної фази в межах від 1 до 100 нм. З погляду термодинаміки більшість колоїдних систем не рівноважні (термодинамічно нестійкі), але з точки зору хімічної кінетики багато таких систем кінетично стійкі. Особливістю колоїдних розчинів є їх стійкість у часі, яка зумовлена двома основними причинами: наявністю електричного заряду у колоїдних частинок і сольватної оболонки з молекул розчинника.
Утворення колоїдної системи може відбуватися двома шляхами: сполученням (агрегацією) окремих молекул, атомів або іонів; диспергуванням часточок розчиненої речовини до досягнення ними розміру колоїдних.
Колоїдні системи мають велике практичне значення в пожежній охороні. Так, широке застосування мають такі типові колоїдні засоби пожежогасіння як піни, аерозолі, суспензії та емульсії.
Аерозолями називають системи, в яких дисперсійним середовищем є газ. Аерозолі поділяють на такі класи: тумани ( системи рідина/газ); пил – диспергаційні аерозолі (тверда речовина/газ); дим – конденсаційні аерозолі (тверда речовина/газ). Пили можуть знаходитися в осаджуваному і завислому станах. Осаджений пил називається аерогелем, завислий аерозавіссю. Аерозолі речовин, що спроможні горіти, – вибухо- та пожежонебезпечні. Аерозолі широко використовуються в пожежній справі. Так, для гасіння пожеж широко застосовуються порошкові вогнегасні суміші (ПВС). ПВС – це дрібнодисперсні порошки деяких речовин, що гальмують процес горіння (карбонати та гідрокарбонати лужних металів, фосфати амонію, сульфат калію та інші). Дисперсність таких порошків досягає 105 м-1. Основний вогнегасний ефект ПВС – гетерогенна рекомбінація радикалів, що утворюються під час горіння. В деяких випадках можливо інгібірування реакцій горіння парою, що утворюється під час сублімації часток вогнегасного порошку. Встановлено, що охолоджуючий і розбавляючий ефект для ПВС не мають суттєвого впливу на припинення горіння. Для деяких вогнегасних порошків (фосфатів амонію) одним з суттєвих ефектів вогнегасіння є утворення на поверхні матеріалу, що горить, плівки, яка припиняє надходження повітря до поверхні матеріалу та вихід продуктів термодеструкції з матеріалу.
В останні роки для гасіння пожеж почали використовувати аерозольутворюючі суміші – АУС. АУС – це суміші окисника, пального та вогнегасного порошку. Після запалення цієї суміші відбувається інтенсивна реакція горіння, при якій утворюється велика кількість газів (СО2, N2, Н2О), котрі, виходячи крізь сопло, розпилюють вогнегасний порошок. При цьому утворюється хмара аерозольного порошку, який гальмує процес горіння.
Піною називається комірково–плівочна система, окремі бульбочки (комірки) якої пов'язані одна з одною у загальному каркасі розділяючими плівками. Бульбочки піни можуть мати великі розміри (декілька сантиметрів), але їх відносять до колоїдних систем. Для утворення стійкої піни необхідна наявність в системі стабілізатора (піноутворювача). В якості піноутворювачів застосовують поверхневоактивні речовини. За способом утворення піни поділяють на хімічні та повітряно– механічні. Хімічна піна утворюється під час утворення газу за допомогою якоїсь хімічної реакції (газоутворюючий процес). Вперше піну для гасіння пожеж запропоновано російським вченим Лораном (в 1904 році). В якості газоутворюючої реакції була запропонована така:
6NaHCO3 + Al2(SO4)3 = 3Na2SO4 + 2Al(OH)3 + 6CO2
В якості першого піноутворювача був запропонований екстракт солодкового кореня. Спочатку використовували окремі піноутворюючі порошки (кислотний – Al2(SO4)3, лужний – NaHCO3 + ПАР). Пізніше були зопропоновані об'єднані піногенеруючі порошки (суха суміш NaHCO3 + ПАР + Al2(SO4)3). В якості піноутворювачів використовуються речовини білкового походження (продукти переробки крові тварин та речовин рослинного походження), штучні ПАР (аніонактивні, катіонактивні, неіонні), фторовані піноутворювачі.
Однією з важливіших характеристик піни є її кратність – відношення об'єму піни до об'єму рідини, з якої вона утворилась. Сьогодні одержано піни з кратністю до декількох тисяч. Важливою характеристикою піни є її стійкість, яка визначається часом існування піни. Найбільш стійкі піни існують від десятків хвилин до годин. Для підвищення стійкості пін до них додають водорозчинні полімери.
Емульсією називається дисперсна система, що складається з двох або більше рідких дисперсних фаз. Умови утворення емульсії – взаємна нерозчинність двох рідин, що утворюють емульсію. Прикладами емульсій є молоко (емульсія жиру у воді), вершкове масло (емульсія води в жирі), креми, мазі. Для утворення стійкої емульсії обов'язковою умовою є наявність емульгаторів. В якості емульгаторів в більшості випадків застосовують ПАР. Ефективними емульгаторами є мила. В пожежній справі емульсії поки що не знайшли широкого застосування. Але запропоновано вживання деяких інгібіторів горіння (фреонів) у вигляді емульсії у воді. Такий засіб пожежогасіння об'єднує переваги води й ефективних інгібіторів горіння.
Суспензії – це грубодисперсні системи, в яких дисперсна фаза – тверда речовина, а дисперсійне середовище рідина. Суспензії використовуються в пожежній справі. Одним з обов'язкових компонентів таких суспензій є активна сіль. Це сіль, яка має вогнегасні властивості (карбонати, гідрокарбонати, фосфати лужних металів або амонію). Суспензії мають підвищену в’язкість порівняно із звичайною водою, тому деякі суспензії використовують при гасінні твердих поверхонь. Такі засоби пожежогасіння повільніше стікають з вертикальних поверхонь, тим самим підвищується ефективність застосування води.
Приклад 30.
Що таке пил? Які фактори впливають на пожежонебезпечність пилу? Чому дорівнює ступінь дисперсності пилу, якщо він складається з часток розміром 0,0002 см?
Розв'язання.
Пил - це дисперсна система, яка утворена з газоподібного середовища та твердої дисперсної фази. Пили відносять до аерозолів, в котрих дисперсійним середовищем є повітря. Пили можуть утворюватися при механічному здрібненні твердих речовин, а також методами кристалізації та сублімації. Пили можуть знаходитиcь в осаджуваному і завислому станах. Осаджений пил називається аерогелем, завислий - аерозависсю. Горіння аерозависей проходить подібно до горіння газоповітряних сумішей, тобто звичайно у вигляді вибуху.
Суттєвий вплив на властивості пилу чинить ступінь дисперсності – це величина зворотня до середнього розміру частки пилу (n=1/a). Чим більша ступінь дисперсності, тим пил є пожежо– та вибухонебезпечнішим. На горіння пилів також впливає хімічна активність речовини, з якої утворений пил, його адсорбційна здатність, схильність до електризації.
n = 1/a = 1/0.0002 = 5000 (см–1)
Приклад 31.
Записати схему гідрозоля, що утворюється при змішуванні розчину AgNO3 з надлишком розчину KCl.
Розв'язання.
При змішуванні розчинів утворюється осад AgCl в умовах надлишку іонів Cl–AgNO3 + KCl = AgCl¯ + КNO3.
Схему міцели, що утвориться, зображують так:
{ m [AgCl] n Cl– 9 (n-x) K+ }x- x K+.
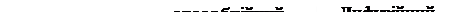


де m – кількість молекул AgCl в ядрі частки, n – кількість надлишкових іонів Cl –, що адсорбовані на поверхні ядра, (n-x) – кількість протиіонів в колоїдній частці, x – кількість іонів в дифузійному шарі.
Приклад 32.
Що таке піни, як вони утворюються і де використовуються в пожежній справі?
Розв'язання.
Піною називається комірково–плівочна система, окремі бульбочки (комірки) якої зв'язані одна з одною у загальному каркасі розділяючими плівками. Для утворення стійкої піни необхідна наявність в системі стабілізатора (піноутворювача). В якості піноутворювачів застосовують поверхневоактивні речовини. Поверхнево активні речовини знижують поверхневий натяг і зміцнюють розділяючі плівки. Низькомолекулярні ПАР (спирти, кислоти, мила, феноли) утворюють піни з низькою структурно–механічною міцністю. Високомолекулярні ПАР здатні утворювати піни з високою структурно–механічною міцністю.
За способом утворення піни поділяють на хімічні та повітряно– механічні. Хімічна піна утворюється під час утворення газу за допомогою якоїсь хімічної реакції (газоутворюючий процес).
Піни широко застосовуються в якості засобу пожежогасіння. Вони мають більш високу ізолюючу дію порівняно з іншими засобами пожежогасіння. Особливо ефективні піни при гасінні нафтопродуктів.
Запитання для самоконтролю
1. Чим відрізняються поняття розчин і колоїдний розчин?
2. Що таке адсорбція?
3. Що таке кінетична і термодинамічна стійкість колоїдних систем?
4. Які речовини називаються поверхневоактивними?
5. Яка причина кінетичної стійкості колоїдних систем?
6. В яких випадках аерозолі та пили складають пожежну небезпеку?
7. В яких вогнегасних засобах використовуються дрібні порошки?
8. Чому піни набули великого значення у пожежогасінні? В яких випадках з цією метою застосовують піни?
Розділ 4. Основи електрохімії
Тема 10. Окисно–відновні процеси
Окисно-відновними реакціями називаються реакції, що протікають із зміною ступеня окиснення елементів, які входять до складу реагуючих речовин.
Cтупінь окиснення – це умовний заряд атома в молекулі, розрахований виходячи з припущення, що молекула складається з іонів.
Правило для розрахунків ступеня окиснення – алгебраїчна сума ступенів окиснення атомів в молекулі дорівнює нулю.Для розрахунків ступенів окиснення якогось атома в молекулі треба знати всі ступені окиснення елементів, крім одного. Для практичних розрахунків треба знати ступені окиснення елементів, які мають (в більшості випадків) сталі ступені окиснення:
–1 F
–2 O (крім пероксидів, в яких ступінь окинення дорівнює –1)
+1 лужні метали, гідроген (крім гідридів, в яких ступінь окиснення гідрогену дорівнює –1)
+2 лужноземельні метали.
Треба мати на увазі, що ступені окиснення простих речовин прийняті рівними 0.
Приклад 33.
Розрахувати ступінь окиснення хрому в сполуці K2Cr2O7.
Розв'язання.
Ступені окиснення К та О дорівнюють відповідно +1 та –2. Враховуючи, що алгебраїчна сума ступенів окиснення атомів в молекулі дорівнює нулю, складемо рівняння: 2×(+1) + 2×х + 7×(–2) = 0; х = +6.
Окиснення – це процес віддачі електронів часткою, а відновлення – приєднання електронів. Частки, які віддають електрони, є відновниками, в процесі реакції вони окислюються ( ступінь окиснення їх підвищується). Частки, які приєднують електрони, є окисниками, під час реакції вони відновлюються ( ступінь окиснення знижується).
За механізмом перебігу розрізняють: міжмолекулярні, внутрішньомолекулярні та реакції диспропорціонування.
Міжмолекулярні - це реакції, в яких окисник і відновник є різними речовинами.
У внутрішньомолекулярних реакціях зміна ступеню окиснення атомів відбувається в одній молекулі.
У реакціях диспропорціонування окисником і відновником є атоми того самого елемента.
Метод електронного балансу.
За цим методом складають електронні рівняння, в яких вказуються ступені окиснення, а також число відданих та прийнятих електронів. Кількість відданих електронів має дорівнювати кількості приєднаних електронів.
Приклад 34.
Встановити коефіцієнти в рівнянні:
KMnO4 + H3PO3 + H2SO4 ® MnSO4 + H3PO4 + K2SO4 + H2O
Розв'зання.
По-перше,треба визначити ступені окиснення елементів:
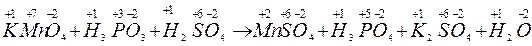
Ступінь окиснення змінюється у атомів Mn i P. Ці зміни можна виразити електронними рівняннями:
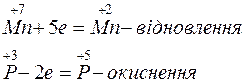
Кількість відданих електронів повинна дорівнювати кількості прийнятих електронів. Для цього першу реакцію треба помножити на 2, другу - на 5 ( +10 е та –10 е ). Вносимо ці коефіцієнти в рівняння реакції. Коефіцієнти перед речовинами, атоми яких не змінюють ступінь окиснення, знаходимо шляхом підбору:
Дата добавления: 2015-03-07; просмотров: 2164;
