Тема 2. Будова атома
Згідно з сучасними поглядами, атоми - частинки діаметром близько кількох ангстрем: n ´ 10-10 м (1 А = 1´ 10-10 м; 1 нм = 1´ 10-9 м)
Маса атомів коливається від n ´ 10-27 до n ´ 10-25 кг.
Атоми складаються з ядра і електронів, що рухаються на деяких відстанях від ядра. Діаметр ядра ~ 10-15 - 10-14 м. Тобто ядро у 10-10/10-15 = 105 разів менше, ніж атом.
Ядро атома складається із протонів і нейтронів (загальна назва - нуклони).
Протон (р)- це елементарна частинка з масою mр = 1,672 ´ 10-27 кг, або 1,0073 а.о.м., і позитивним зарядом q = 1,602 ´ 10-19 Кл (який приймають за одну відносну одиницю заряду + 1).
Нейтрон (n)- незаряджена частинка з масою mn = 1,674 ´ 10-27 кг, тобто 1,0087 а.о.м.
Сума числа протонів (Z) і числа нейтронів (N) називається нуклонним числом (масовим числом).
Найважливішою часткою в хімії є електрон (е). За допомогою валентних електронів утворюються хімічні зв’язки. А суттю хімічних реакцій є руйнування одних та утворення інших хімічних зв’язків. Електрон це частинка з масою покою 9,110 × 10 –31 кг (що складає 1/1836 маси протона) і негативним зарядом, абсолютне значення якого дорівнює 1,602 × 10 –19 Кл. Електрон має двоїсту природу – властивості частки та хвилі. Електрон в атомі спрощено уявляють як хмару з певною густиною негативного електричного заряду в певному об’ємі простору навколо ядра (електронна орбіталь).
Електрони в атомі характеризуються чотирма квантовими числами.
Головне квантове число (n)-характеризує енергію електрона на енергетичному рівні і пріймає значення: n = 1,2, 3,.... .
Орбітальне квантове число (l) - визначає форму орбіталі, пріймає значення: l = 0,1,2,... (n-1) і енергію електрона на енергетичному підрівні.
Орбіталі можуть мати форму кулі (s-орбіталі, l=0), гантелі (р-орбіталі, l=1) (див. рисунок 1), або більш складної форми (d-, f- l=2 та 3 відповідно).
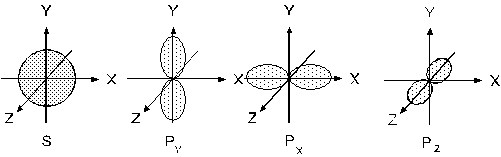
Рис.1. Форми s і р – електронних орбіталей.
Магнітне квантове число (m) - визначає орієнтацію орбіталі в просторі: m = – l,–( l –1),....–1,0,1,....( l –1), l.
Спінове квантове число - (s) - характеризує власний магнітний момент електрона: s = +1/2; –1/2.
Для визначення електронних конфігурацій атомів слід використовувати такі правила.
Принцип Паулі: в атомі не може бути двох електронів з однаковими значеннями всіх чотирьох квантових чисел.
Правило Гунда сумарний спін електронів не повністю заповненого підрівня має бути максимальним.
Правило Клєчковського: електрони заповнюють енергетичні підрівні в порядку зростання енергії, яка характеризується сумою (n+l), якщо ця сума однакова, спочатку заповнюється підрівень з меншим n.
Послідовність заповнення електронами підрівнів:1s,2s,2p,3s,3p,4s, 3d,4p,5s,4d,5p,6s,4f,5d,6p,7s,5f,6d,7p.
Електронна конфігурація атома визначає хімічні властивості елементів.
Для з’ясування кількості неспарених електронів використовують електронно-графічні формули, які показують розміщення електронів на атомних орбіталях, що зображуються за допомогою комірок. Наприклад, електронно-графічна формула атому Оксигену:
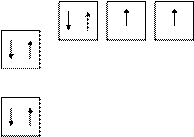 |
2p
2s
1s
Рис.2. Електроно-графічна схема атома Оксигену.
Приклад 6.
Складіть електронну формулу елемента з порядковим номером 41. Скільки неспарених електронів має атом цього елемента?
Розв'язання.
Nb 1s22s22p63s23p64s23d104p65s24d3.
Усі підрівні, крім 4d, заповнені повністю, тому неспарені електрони можуть бути тільки на 4d підрівні. Розміщення електронів в межах підрівня здійснюється згідно з правилом Гунда, тобто всього в атомі Nb 3 неспарених електрони (рис.3)
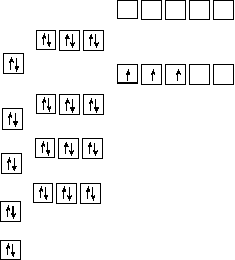
s p d
Рис.3. Електроно-графічна формула атома Ніобія.
Приклад 7.
Закінчити рівняння ядерного перетворення: 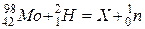 . Ізотоп якого елемента утворюється при цьому, скількі протонів та нейтронів міститься в його ядрі?
. Ізотоп якого елемента утворюється при цьому, скількі протонів та нейтронів міститься в його ядрі?
Розвязання.
Під час ядерних перетворень виконуються закони збереження заряду і маси. Заряди атомів приведені в лівому нижньому куті від символу елемента, а нуклонні (масові) числа – у верхньому лівому куті.
Нуклонне число невідомого елемента дорівнює: 98 +2 – 1= 99, а його заряд: 42 + 1 – 0 = 43.
Заряд ядра визначає елемент. Елемент з порядковим номером 43 – це Технецій:
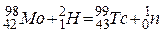
Кількість протонів дорівнює заряду ядра – 43, кількість нейтронів – різниці між нуклонним числом і зарядом ядра: 99 – 43 = 56.
Запитання для самоконтролю
1. В чому суть корпускулярно-хвильової природи електрона?
2. З яких часток складається атом?
3. Які розміри мають ядра атомів та самі атоми?
4. Які елементарні частки ви знаєте?
5. Що таке ізотопи?
6. Які види радіоактивності ви знаєте?
7. За допомогою яких квантових чисел описують поведінку електронів?
8. Як складаються електронні формули?
9. Сформулюйте принцип Паулі.
10. Сформулюйте правило Гунда.
Тема 3. Періодичний закон
Сучасне формулювання періодичного закону: властивості простих речовин, а також форми та властивості сполук хімічних елементів перебувають в періодичній залежності від заряду ядра атома елемента.
Періодична система – це графічне відображення періодичного закону.
Періодична система – віддзеркалює електронну будову атома. Періодична система складається з семи періодів і восьми груп. Період – це горизонтальний ряд, що починається лужним металом (крім першого) і закінчується інертним елементом. Кожен період відповідає заповненню енергетичного рівня. Новий період відповідає початку заповнення нового електронного рівня. Група – це вертикальний стовпчик, що містить елементи, властивості яких подібні. Кожна група складається з двох підгруп: головної та побічної.
Для кількісного порівняння властивостей елементів використовують такі поняття: енергія іонізації, спорідненість до електрона, електронегативність.
Енергія іонізації – мінімальна енергія, що потрібна для відриву електрона від атома. Вона є кількісною характеристикою металічних властивостей елемента. Типові метали мають низкі енергії іонізації (легко віддають електрон). В періоді зліва на право, а в групі знизу до гори енергія іонізації збільшується (зменшуються металічні властивості).
Спорідненість до електрона – енергія, що виділяється або поглинається під час приєднання електрона до атома. Вона є кількісною характеристикою неметалічних властивостей елемента (неметали мають великі спорідненісті до електрона). В періоді зліва вправо, а в групі знизу догори спорідненість до електрона збільшується (збільшуються неметалічні властивості).
Електронегативність – визначається сумою енергії іонізації та спорідненості до електрона. Чим більша електронегативність атома, тим сильніше він притягує спільну електронну пару. Неметали мають велику електронегативність, метали – малу. В періоді зліва вправо, а в групі знизу догори електронегативність збільшується (збільшуються неметалічні властивості). Так найбільш електронегативним елементом є Флуор.
Приклад 8.
Який з кожної пари елементів виявляє більші неметалічні властивості? (C - N; O - S; Cl - Ar ).
Розв'язання.
Неметалічні властивості в періодичній системі зростають у періодах зліва - вправо, в групах знизу - догори. Тому азот і кисень в перших парах елементів мають більші неметалічні властивості. В третьому випадку хлор виявляє більші неметалічні властивості, тому що аргон - інертний (благородний) газ, який не здатний до приймання електрона.
Запитання для самоконтролю
1. Чому виникла необхідність в уточненні формулювання періодичного закону Д.І. Менделєєва?
2. Яку будову має періодична система елементів Д.І. Менделєєва?
3. Як пояснити залежність властивостей хімічних елементів від їх положення в періодичній системі?
4. Що таке енергія іонізації, спорідненість до електрона, електронегативність елементів? Як вони змінюються в групах і періодах періодичної системи елементів Д.І. Менделєєва?
5. Який зв’язок існує між будовою періодичної системи та будовою атома?
6. Який зв’язок існує між періодичним законом і періодичною системою?
Тема 4. Хімічний зв'язок
Хімічний зв'язок - взаємодія двох або кількох атомів, внаслідок якої утворюється хімічно стійка дво- або богатоатомна система (молекула чи кристал).
Природа хімічного зв’язку полягає в притягуванні позитивно заряджених ядер до негативно зарядженої області перекривання електроних орбіталей, що приводить до загального зниження енергії системи.
Основні типи хімічного зв’язку: ковалентний, йонний, металічний, водневий.
Ковалентний зв'язок утворюється за допомогою спільних електронних пар. Механізми утворення: електронно-обмінний (звичайний) та донорно-акцепторний. За електронно-обмінним механізмом спільна електронна пара утворюється при перекриванні одноелектронних атомних орбіталей, що містять по одному електрону з антипаралельними спінами (рис.4).

Рис.4. Утворення ковалентного зв’язку під час перекривання s і p–орбіталей.
За донорно – акцепторним механізмом спільна електронна пара утворюється при перекриванні електронної орбіталі, що містить неподільну електрону пару з вільною (вакантною) орбіталлю іншого атома.
При утворенні ковалентного зв’язку можуть приймати участь електрони різних орбіталей (s, p, d, f), що мають різноманітну форму та орієнтацію в просторі. В багатьох сполуках при перекриванні орбіталей різної форми утворюються рівноцінні зв’язки. Для пояснення цього явища запроваджено поняття «гібридизація». Гібридизація – це процес змішування та вирівнювання орбіталей за формою та енергією. Основні типи гібридизації – sp, sp2 та sp3. Схеми їх утворення приведені на рис. 5–7.

Рис.5. sp- гібридизація
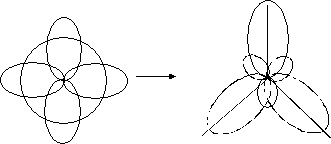
Рис.6. sp2- гібридизація.
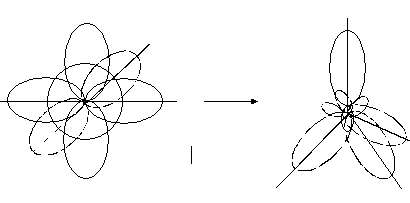
Рис.7. sp3- гібридизація.
Основні характериcтики ковалентного зв'язку: напрямленість, кратність, насиченість, здатність до поляризації, довжина та енергія.
Напрямленість обумовлена тим, що атомні орбіталі мають свою форму та орієнтацію у просторі, а їх взаємодія відбувається в напрямку максимального перекривання. В залежності від напрямку перекривання розрізняють s і p зв'язки. s - зв'язок утворюється, коли атомні орбіталі перекриваються вздовж осі, що з'єднує ядра атомів (Рис.8):
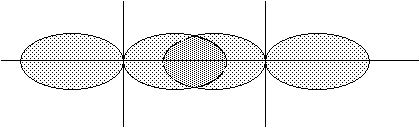
Рис. 8. Схема утворення s - зв'язку.
p - зв'язок утворюється, коли області перекривання розташовані по різні сторони від осі, що з'єднує ядра атомів (рис.9).
Насиченість ковалентного зв'язку обумовлена тим, що кожний атом має визначену кількість атомних орбіталей, які можуть приймати участь в утворенні хімічного зв'язку.

Рис.9. Схема утворення p - зв'язку.
Полярність зв'язку виникає, коли центри позитивного і негативного зарядів в молекулі не співпадають. При цьому виникає диполь. Полярний зв'язок утворюється тоді, коли молекулу утворюють різні атоми. В випадку однакових атомів утворюється ковалентний неполярний зв'язок
Енергія зв'язку це енергія, яка потрібна для розриву цього зв'язку.
Кратність зв'язку визначається кількістью хімічних зв'язків, що з'єднують два атома. Бувають ординарний, подвійний та потрійний зв'язки. В хімії широко застосовується поняття – валентність. Валентність атома – це його здатність утворювати певне число хімічних зв'язків з іншими атомами.
Йонний зв'язок - утворюється за рахунок електростатичного тяжіння йонів. Його можна розглядати як граничний випадок ковалентного полярного зв'язку, який утворюється в разі великої різниці в електронегативностях атомів, що утворюють зв’язок. Типовими йонними сполуками є галогеніди та оксиди лужних металів. Всі йонні сполуки у твердому стані є кристалічними речовинами – у вузлах кристалічних решіток (граток) знаходяться позитивно і негативно заряджені йони (рис.10):
Решітка NaCl Решітка СsCl
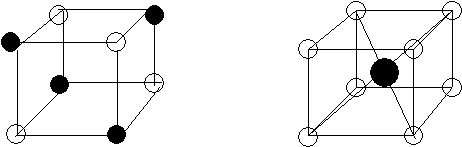
|
Рис. 10. Кристалічні решітки NaCl i CsCl.
Металічний зв'язок - утворюється за допомогою електронів, спільних для всіх позитивно заряджених йонів, що утворюють кристалічну гратку. Валентні електрони в металах є усуспільненими і належать всьому кристалу, тобто утворюють електронний газ. При накладанні електричного поля ці електрони дуже легко пересуваються. Це пояснює високу електропровідність більшості металів.
Міжмолекулярні зв’язки - це зв’язки між електронейтральними молекулами, які мають електричну природу. Енергія міжмолекулярної взаємодії значно менша ніж енергія звичайного хімічного зв’язку. Одним з різновидів міжмолекулярного зв’язку є водневий зв’язок. Водневий зв’язок виникає між молекулами, до складу яких входять атоми водню та іншого елемента з високою електронегативністю (F, O, Cl, N). Найбільш сильний водневий зв'язок виникає між молекулами НF. Графічно він позначається ( ¼ ). Наприклад: H–F ¼ H–F.
Приклад 9.
Визначити тип хімічного зв'язку в таких сполуках: (O2, H2O, NaCl, CaO, NO2, HF, N2,, P2O5, H2). Для простих речовин визначити кратність зв'язку.
Розв'язання.
(O2) — ковалентний неполярний (подвійний зв'язок.); (H2O) — ковалентний полярний + водневий ; (NaCl) – йонний; (CaO) – йонний , (NO2) – ковалентний полярний; (HF) — ковалентний полярний + водневий; (N2) — ковалентний неполярний (потрійний зв'язок); (P2O5) — ковалентний полярний.; (H2)— ковалентний неполярний (ординарний зв'язок).
Приклад 10.
Який тип гібридизації атомних орбіталей атома Карбону в молекулі Н2С=СН2?
Розв'язання.
В молекулі Н2С=СН2 кожен атом Карбону утворює три s–зв’язки (один з іншим актомом Карбону, два інших – з двома атомами гідрогену) та один p–зв’язок (з атомом Карбону). Тому тип гібридизації атомних орбіталей Карбону sp2.
Запитання для самоконтролю
1. Які є найважливіші типи хімічного зв'язку?
2. В якому випадку утворюється йонíий зв'язок?
3. Що таке валентність і ступінь окиснення?
4. Які основні характеристики й властивості ковалентного зв'язку?
5. Чим визначається полярність ковалентного зв'язку?
6. Для чого введено поняття гібридизації орбіталей?
7. Чим відрізняються аморфні і кристалічні речовини?
8. Що таке кристалічні гратки?
9. Наведить приклади багатоцентрового хімічного зв'язку?
РОЗДІЛ 2. ЗАГАЛЬНІ ЗАКОНОМІРНОСТІ ХІМІЧНИХ ПРОЦЕСІВ
Тема 5. Основи хімічної термодинаміки
Хімічна термодинаміка – один з найважливіших розділів хімічної науки. Вона вивчає енергетичні зміни, які супроводжують хімічні процеси. Знання хімічної термодинаміки дозволяє з'ясувати можливість самочинного протікання процесу, а також визначити теплоту процесу та роботу, яку виконує система. Для зручності розглядання процесу Всесвіт поділяють на систему та навколишнє середовище. Термодинамічною системою називають частину світу, яка відокремлена від навколишнього середовища дійсними або умовними межами і в якій розглядається перебіг якогось процесу. Розрізняють такі системи:
– ізольовані (нема обміну енергією та речовиною);
– замкнені (нема обміну речовиною, є обмін енергією);
– відкриті ( є обмін речовиною та енергією).
У хімічній термодинаміці користуються термодинамічними функціями (характеристиками), які дають змогу охарактеризувати стан системи і зміни, що відбуваються в ній. Серед останніх важливе значення для хіміків мають внутрішня енергія U, ентальпія Н, ентропія S, енергія ГіббсаG тощо.
Важливим первинним поняттям хімічної термодинаміки є внутрішня енергія (U).Під внутрішньою енергією системи U слід розуміти загальний її запас, тобто енергію поступального й обертального руху молекул, енергію внутрішньомолекулярних коливань атомів і атомних груп, енергію руху електронів в атомах, внутрішньоядерну енергію, тобто усі види енергії, крім кінетичної і потенціальної енергії системи вцілому. Формами передачі енергії є теплота (Q) і робота (A). Під величиною А розуміють роботу, що протидіє всім силам, які діють на систему (зовнішній тиск, електричне і магнітне поля, тощо).
Хімічні процеси відбуваються з виділенням або поглинанням теплоти. Реакції, що відбуваються з виділенням теплоти, називають екзотермічними, а реакції, під час перебігу яких теплота поглинається,— ендотермічними. Один з фундаментальних законів природи – закон збереження енергії (перший закон термодинаміки):
Енергія не зникає і не утворюється з нічого, вона переходить з однієї форми в іншу в еквівалентних кількостях
Для ізольованої системи перший закон термодинаміки можна конкретизувати:
внутрішня енергія ізольованої системи – стала. (U = const, DU = 0)
Для замкненої системи така конкретизація буде:
теплота, що дістається системі, йде на зміну внутрішньої енергії та виконання роботи.
Математичний запис цього положення має вигляд.:
Q = DU+A,
де DU = Uкін – Uпочат.
В більшості випадків в якості роботи процесу ми будемо розглядати роботу розширення або стиснення, яка дорівнює: А = р DV. В такому випадку рівняння запишеться: Q = DU+ р DV
При V =const, DV = 0, р DV = 0,
QV = DU.
Тепловий ефект за сталим об’ємом дорівнює зміні внутрішньої енергії.
При р =const;Q = DU + р DV = DU + D (р V) =D (U + р V).
Позначимо U + р V = Нта назвемо цю нову функцію– ентальпія.
QР = D Н.
Тепловий ефект за сталим тиском дорівнює зміні ентальпії.
Теплові ефекти хімічних процесів вивчає термохімія. Теплові ефекти, визначені за температури 25 °С (298,15 К) і тиску 101 кПа (1 атм), називають стандартними.
Кількість теплоти, що виділяється або поглинається під час утворення одного моля хімічної сполуки з простих речовин, називається теплотою (ентальпією) утворення
Перший закон термохімії: теплота розкладання даної сполуки чисельно дорівнює теплоті її утворення, але має протилежний знак.
Закон Гесса (другий закон термохімії):
тепловий ефект реакції залежить тільки від початкового та кінцевого станів вихідних речовин та продуктів реакції і не залежить від проміжних стадій процесу.
Перший наслідок з закону Гесса:
стандартний тепловий ефект реакції дорівнює сумі стандартних теплот утворення продуктів реакції з відніманням суми стандартних теплот утворення вихідних речовин.
DHr° =(SnDHf°)прод – (SnDHf°)почат,
де DHr° – тепловий ефект реакції(індекс r позначає реакцію – reaction);
DHf° – теплота утворення(індекс f позначає утворення – formation);
n – стехіометричний коефіцієнт.
Другий наслідок з закону Гесса:
стандартний тепловий ефект реакції дорівнює сумі стандартних теплот згоряння вихідних речовин з відніманням суми стандартних теплот згоряння продуктів реакції.
DHr° =(SnDHcomb°)почат– (SnDHcomb°)прод,
де DHcomb° – теплоти згоряння(combustion).
У випадку необхідності визначення DU розрахунок проводять за формулою:
DU = DH – рDV,
де р = 101,3 кПа, DV = Vкін – Vпоч
В пожежній справі розрізняють вищу та нижчу теплоти згоряння. Вищою теплотою згоряння називають кількість тепла, що вилучається при повному згорянні 1 кг, або 1 м3 (для газів), горючої речовини за умови, що утворюється рідка вода. Нижчою теплотою згоряння називають кількість тепла, що вилучається при повному згорянні 1 кг, або 1 м3 (для газів), горючої речовини за умови, що утворюється водяна пара.
Дослід показує, що речовини, теплоти згоряння яких не перевищують 2000 кДж/кг, не здатні до горіння.
Приклад 11.
Розрахувати вищу та нижчу теплоти згоряння метану.
Розв'язання.
Для розрахунку вищої теплоти згоряння Qв запишемо рівняння реакції
CH4 + 2O2 = CO2 + 2H2O(Р)
Розрахунки проводимо згідно з наслідком з закону Гесса:
DrH°(в) = DfH°(CO2) + 2DfH°(H2O(P)) – DfH°(CH4) –2DfH°(O2) =
= –393.5+2´(–285.8)–(–74.8)–0 = –890.3 кДж.
Розрахунок виконано для 1 моля метану (22.4 л) . Зробимо перерахунок на 1 кубічний метр (1000 л).
Qв = –(–890.3´1000/22.4) = 39745 кДж
Для розрахунку Qн зробимо аналогічні розрахунки, тільки замість рідкої води візьмемо відповідне значення для водяної пари:
DrH°(н) = D fH°(CO2) + 2DfH°(H2O(г)) – DfH°(CH4) –2DfH°(O2) = –393.5+
+2´(–241.8) – (–74.8) –0 = –802.3 кДж.
Qн = –(–802.3 ´ 1000/22.4) = 35804 кДж.
Другий закон (постулат) термодинаміки:
неможливий самочинний перехід тепла від більш холодного тіла до більш теплого
В хімічній термодинаміці для врахування теплового руху молекул впроваджується нова термодинамічна функція S – ентропія.Ентропія є мірою невпорядкованості системи. Формально ентропія впроваджується за формулою:
dS = dQ/T
де dQ – нескінченно маленька порція теплоти, Т – температура.
Розрахунок DS аналогічний обчисленню DH за законом Гесса. Однак, слід мати на увазі, що для простих тіл S ¹ 0 (на відміну від DH°f).
DSr° = (SnS°)прод – (SnS°)почат
де S°–абсолютні стандартні ентропії речовин, n – стехіометричний коефіцієнт.
В ізольованій системі фактор енергії штучно відділено (DU = 0), тому напрямок процесу визначається лише ентропією.
В ізольованій системі самочинно можуть відбуватися тільки процеси зі збільшенням ентропії. Тобто умовою можливості протікання процесу в ізольованій системі є : DS ³ 0
Іншими словами, в ізольованій системі процеси відбуваються в бік збільшення безладу.
В замкненій системі напрямок процесу визначається двома факторами: енергетичним (DU або DH) і ентропійним (DS). Для врахування обох факторів введено нову термодинамічну функцію – енергію Гіббса (G):
G = Н – Т S
де Н – ентальпія, Т – температура, S – ентропія.
В замкненій системі самочинно можуть відбуватись процеси. для яких енергія Гіббса зменшується: DG < 0 (при р і Т = const).
Розрахунок DG аналогічний до обчислення DH і DS:
D G r° =(SnDG f°)прод – (SnDGf°)почат
де DG f°–стандартні енергії Гіббса утворення речовин.
Приклад 12.
Визначити, чи можливе самочинне розкладàння нітрату амонію згідно з реакціями:
а) NH4NO3 = NH3 + HNO3 б) 4 NH4NO3 = 3N2 + 2NO2 + 8H2O
Розв'язання.
Можливість або неможливість самочинного перебігу хімічної реакції визначається знаком величини зміни енергії Гіббса. Якщо DG°r < 0, реакція принципово можлива, якщо DG°r > 0 - неможлива.
а) DrG°(а) = DfG°(NH3) + DfG°(HNO3) – DfG°(NH4NO3) = –16,7 – 79,9 ––
(–183,9) = 87,3 кДж.
б) DrG°(б) = 3DfG°(N2) + 2DfG°(NO2) + 8DfG°(H2O(г)) – 4DfG°(NH4NO3) =
= 3 ´ 0 +2 ´ 52,3 + 8 ´ (–228,6) – 4 ´ (–183,9) = –1068,6 кДж.
Відповідь: можливий самочинний перебіг реакції (б).
За допомогою енергій Гіббса можна зробити оцінку пожежонебезпечності речовин. Якщо DG° реакції речовини з киснем суттєво менша ніж нуль, то така речовина здатна до горіння.
Крім розрахунків за попередньою формулою, зміну енергії Гіббса можна розраховувати (при сталих Р і Т) за формулою:
D G =DH – ТD S
Перебігу процесів сприяють умови DH < 0, ТDS > 0
Запитання для самоконтролю
1. Які питання розглядає хімічна термодинаміка?
2. Які є форми передачі енергії?
3. Що таке внутрішня енергія та ентальпія?
4. Які умови прийняті за стандартні?
5. Які є види теплових ефектів?
6. Сформулюйте наслідок з закону Гесса, за допомогою якого разраховують теплові ефекти хімічних реакцій.
7. Що таке теплота утворення та теплота згоряння?
8. За допомогою яких термодинамічних функцій можна визначити можливість перебігу хімічної реакції? В яких випадках використовується кожна з них?
Тема 6. Хімічна кінетика
Розділ хімії, що вивчає швидкість перебігу різних хімічних реакцій, називається хімічною кінетикою. Одним з основних понять хімічної кінетики – є швидкість хімічної реакції.
Швидкість гомогенної реакції визначається зміною кількості будь-якої з вихідних речовин або кінцевих продуктів реакції за одиницю часу, віднесену до одиниці об'єму
v = (1/V) dn/dt
де V – об'єм, n – кількість речовини, t – час.
Враховуючи, що n/V = c, для гомогенних реакцій можна записати так:
v = dс/dt
Швидкість гомогенної реакції визначається зміною концентрації будь-якої з вихідних речовин або кінцевих продуктів реакції за одиницю часу
Швидкість хімічної реакції залежить від природи реагуючих речовин, їх концентрації, температури, а також від наявності каталізатора тощо.
Закон дії мас:
швидкість хімічної реакції за сталої температури прямо пропорційна добутку концентрацій реагуючих речовин у ступенях, що дорівнюють їхнім стехіометричним коефіцієнтам.
Для реакції:
аА + вВ = продукти,
(де а і в стехіометричні коефіцієнти),
швидкість реакції описується кінетичним рівнянням:
v = k caA cbB ,
де, k—коефіцієнт пропорційності, що називається константою швидкості реакції. Константа швидкості реакції не залежить від концентрацій реагуючих речовин, але залежить від природи речовин, наявності каталізатора і температури. Константа швидкості відповідає швидкості реакції при концентрацій реагуючих речовин, що дорівнюють 1 моль/л. (Якщо С=1, то v = k)
Закон дії мас справедливий для простіших реакцій. Для складних (багатостадійних) реакцій покажчики ступеня не дорівнюють стехіометричним коефіцієнтам, їх треба визначати експериментально. В такому випадку визначені покажчики ступеня називають порядком реакції.
Приклад 13.
Як зміниться швидкість реакції 2H2 + O2 = 2H2O, якщо тиск в системі збільшити у два рази?
Розв'язання.
Для газів концентрація речовин прямо пропорційна до тиску. Згідно з законом діючих мас V = k ´ С(H2) 2 ´ С(O2).
Позначимо початкові концентрації водню - a; кисню - b.
V1 = k ´ а2 ´ b.
Після збільшення тиску в два рази концентрація водню буде - 2а; кисню - 2b.
V2 = k ´ (2а)2 ´ (2b) = 8kа2b. V2/V1 = 8kа2b/kа2b = 8,
тобто швидкість зросте у 8 разів.
ПравилоВант-Гоффа:
при підвищенні температури системи на кожні 10 градусів швидкість більшості реакцій зростає в 2—4 рази.
VT+10/VT = g = 2–4;
якщо температура змінюється не на 10 К, то користуються рівнянням:
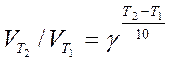 .
.
де g – температурний коефіцієнт швидкості хімічної реакції.
Правило Вант-Гоффа є наближеним правилом, використання його обмежене помірними температурами.
Приклад 14.
Обчислити, у скільки разів збільшиться швидкість реакції, що перебігає у газовій фазі, при підвищенні температури від 20 до 60 градусів за Цельсієм, якщо температурний коефіцієнт швидкості реакції дорівнює 3.
Розв'язання.
Згідно з правилом Вант-Гоффа: V(T2)/V(T1) = g DT/10 = 340/10 = 81.
Більш точно залежність швидкості реакції від температури описується емпіричним рівнянням Арреніуса:
k = A ´ e–E(акт)/(RT),
де k– константа швидкості реакції, А – константа для кожної реакції, е – основа натурального логарифма, Еакт – енергія активації, R – газова стала, Т – температура.
Енергія активації – це надлишкова енергія в порівнянні з середньою, яку повинні мати реагуючі частинки, щоб їхні зіткнення спричинили хімічні взаємодії:
Еакт = Е* – Есер.
Енергія активації залежить від природи реагуючих речовин та присутності каталізатора.
Приклад 15.
Як зросте швидкість реакції при підвищенні температури з 400 до 450К, якщо відомо, що енергія активації цієї реакції дорівнює 300 кДж/моль?
Розв'язання.
Запишемо рівняння Арреніуса для двох температур.
k400 = A ´ e–E(акт)/(R ×400), k450 = A ´ e–E(акт)/(R ×450),
При однакових концентраціях відношення швидкостей реакцій буде дорівнювати відношенню констант швидкості:
V450/V400 = k450 / k400 = e–E(акт)/R (1/ 450 – 1/400)
Після логарифмування будемо мати:
ln(k450 / k400) =(–300000/8.314 ) × (1/450–1/400) =10,02
k450 / k400 = 22471
Речовини, які прискорюють швидкість реакції, але не витрачаються в результаті її перебігу, називаються каталізаторами (позитивними каталізаторами). Речовини, які сповільнюють швидкість реакції, називаються інгібіторами (негативними каталізаторами).
Формально вплив каталізатора на швидкість реакції визначається рівнянням Арреніуса. Але, на відміну від використання цього рівняння в попередньому прикладі, температура буде сталою, а змінюється енергія активації.
Приклад 16.
Введення каталізатора при Т=300 К підвищило швидкість реакції в 100 разів. Як каталізатор змінив енергію активації?
Розв'язання.
Запишемо рівняння Арреніуса для випадку відсутності каталізатора (1) та його наявності (2)
k 1= A ´ e–E1/(RT); k 2= A ´ e–E2/(RT);
k 2/ k 1 = e E1–E2/(RT);
ln(k2 / k1)= ( E1–E2)/(RT);
(E1–E2) = RT ln(k2 / k1) = 8,314 × 300 ln(100) =11482Дж/моль = 11,482 кДж/моль.
В пожежній справі широко використовуються інгібітори горіння. Найбільш поширеними інгібіторами горіння, які діють як гомогенні інгібітори, є галогенпохідні вуглеводнів. Розкладаючись в полум'ї на радикали, вони блокують найбільш реакційно здатні частки в полум'ї і, таким чином, гальмують процес горіння. В якості гетерогенних інгібіторів горіння застосовують дрібні порошки деяких солей: карбонат та гідрокарбонат натрію, фосфати лужних металів.
Ланцюговими називаються реакції, які включають велику кількість стадій, що відбуваються послідовно. Здійснення цих реакцій зумовлене наявністю вільних радикалів, які перетворюють неактивні молекули на активні. (Вільні радикали – це частки, які мають неспаровані електрони; більшість вільних радикалів дуже реакційно здатні і не можуть накопичуватися в значних кількостях).
Згідно з теорією Зельдовича, для виникнення процесу горіння потрібно, щоб у деякому об'ємі швидкість тепловиділення перевищувала швидкість тепловіддачі.
Запитання для самоконтролю
1. Що таке швидкість хімічної реакції?
2. Від яких факторів залежить швидкість реакції?
3. Як впливають на швидкість хімічних реакцій температура, концентрація реагуючих речовин, каталізатор?
4. Що таке константа швидкості?
5. Що таке енергія активації?
6. Сформулюйте закон діючих мас для швидкості хімічної реакції.
7. Що таке температурний коефіцієнт швидкості хімічної реакції?
8. Який механізм хімічної реакції називають ланцюговим?
9. За яким механізмом відбуваються процеси горіння?
10. Що таке інгібітори горіння? Як вони використовуються в пожежній справі?
Тема 7. Хімічна рівновага
Стан системи реагуючих речовин (оборотної реакції), за яким швидкості прямої та зворотної реакцій стають однаковими, називається хімічною рівновагою.
В стані хімічної рівноваги кількості вихідних речовин і продуктів реакції не змінюються, оскільки реакція відбувається в обох напрямках з однаковимишвидкостями. Ось чому стан хімічної рівноваги має рухомий, динамічний характер.
З точки зору хімічної термодинаміки в стані хімічної рівноваги енергія Гіббса системи має найменше значення.
Кількісною характеристикою хімічної рівноваги є її константа. Для реакції:
aА + вВ = dD = fF
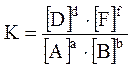 ,
,
де [ ] позначають рівноважну концентрацію.
Для будь-якої реакції константу рівноваги можна записати:
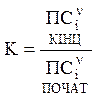
де 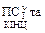
 - добуток концентрацій кінцевих та початкових речовин в ступенях, що дорівнюють стехіометричним коефіцієнтам.
- добуток концентрацій кінцевих та початкових речовин в ступенях, що дорівнюють стехіометричним коефіцієнтам.
Константа хімічної рівноваги визначає глибину перебігу процесу в момент досягнення стану рівноваги. За допомогою константи рівноваги можна обчислювати рівноважні концентрації речовин, що беруть участь в реакції.
Приклад17.
Вихідні концентрації хлору та водню в реакції синтезу хлороводню складали 1 моль/л. Визначити рівноважну концентрацію хлороводню після досягнення стану рівноваги. Константа рівноваги для цієї реакції дорівнює 4.
Розв'язання.
Запишемо рівняння реакції: H2 + Cl2 = 2HCl.
Нехай до моменту встановлення рівноваги концентрація хлору зменшилась на Х моль/л, тоді концентрація водню теж зменшиться на Х моль/л (за рівнянням реакції хлор та водень реагують у співвідношенні 1:1) . Концентрація хлороводню буде складати 2Х ( з рівняння реакції бачимо, що з 1 моль Cl2 утворюється 2 моль хлороводню)
Запишемо рівноважні концентрації всіх речовин, що беруть участь в реакції:
H2 – (1–Х)
Cl2 – (1–Х)
HCl – (2Х)
Підставимо ці концентрації у вираз для константи рівноваги.
 , звідси х = 0,5, 1–х = 0,5, 2х = 1.
, звідси х = 0,5, 1–х = 0,5, 2х = 1.
Відповідь: концентрації водню та хлору будуть 0.5 моль/л, а концентрація хлороводню буде 1 моль/л.
Приклад 18.
В посудині об'ємом 0,5 л змішали 0.5 моля водню та 1.0 моль вуглекислого газу. Обчислити константу рівноваги реакції:
CO2 + H2 = CO + H2O(г) ,
якщо відомо, що до моменту встановлення рівноваги прореагувало 50% водню.
Розв'язання.
До моменту встановлення рівноваги прореагувало (0.5´50)/100=0,25 моль водню. Згідно з рівнянням реакції, прореагувало вуглекислого газу 0,25 моль і утворилось води та оксиду вуглецю (ІІ) по 0,25 моль. Рівноважні кількості (CO2, H2, CO, H2O) складуть 0.75; 0,25; 0,25; 0,25 моль. Концентрації цих речовин відповідно складуть: ( С=n/V): 1,5; 0,5; 0,5; 0,5 моль/л.

Термодинаміка дає універсальне співвідношення між стандартною зміною енергії Гіббса і величиною константи хімічної рівноваги:
DG0 = –RTlnK.
Приклад 19.
За допомогою таблиць стандартних термодинамічних величин визначити константу рівноваги реакції синтезу аміаку.
Розв'язання.
1. Запишемо рівняння реакції: N2 + 3H2 = 2 NH3
2. За допомогою таблиць стандартних термодинамічних величин розрахуємо зміну енергії Гіббса для цієї реакції:
DG0х.р.= 2 DG0f(NH3) – DG0f(N2) – 3DG0f(H2) = 2 (–16,7) = –33,4 кДж/моль
3. Розрахуємо константу рівноваги.
DG0 = –RTlnK, lnK = – DG0/RT = 33,4·103/(8.314×298) =13,4; К = е13,4 =
= 6.6 ×105.
Принцип Ле–Шательє (принцип рухомої (динамічної)) рівноваги:
якщо на систему, що перебуває у стані рівноваги, подіяти ззовні, то в системі відбуватимуться зміни, що послаблюють або знищують цю дію.
Вплив концентрації на стан рівноваги.
Згідно з принципом Ле–Шательє, введення в систему, що перебуває в стані рівноваги, додаткової кількості будь-якої з реагуючих речовин викликає зміщення рівноваги у тому напрямку, в якому її концентрація зменшується
Вплив тиску на стан рівноваги.
Згідно з принципом ле Шательє, підвищення тиску зумовлює зміщення хімічної рівноваги в напрямку процесу, який супроводжується зменшенням об'єму, а зниження тиску — викликає зміщення рівноваги у протилежний бік.
Вплив температури на стан рівноваги.
Згідно з принципом Ле–Шательє, під час нагрівання системи, що перебуває в стані рівноваги, остання зміщується в бік того з двох протилежноспрямованих процесів, який супроводжується поглинанням теплоти.
Рівновага в гетерогенних системах
Для гетерогенних реакцій у вираз константи рівноваги, аналогічно до виразу закону дії мас, входять концентрації тільки тих речовин, які перебувають у газовій або рідкій фазі. Тому для реакції
СО2(г)+ С(тв) = 2СО(г)
вираз константи хімічної рівноваги запишеться так:
К= [со]2 /[со2].
Концентрація вуглецю (тверда речовина) не входить до виразу константи хімічної рівноваги тому, що це стала величина.
Приклад 20.
Для хімічної реакції:
Ca(к) + 2 H2O(г) = Ca(OH)2 (к)+ H2(г); DH0r = 147,8 кДж,
записати вираз для константи рівноваги і вказати як треба змінити параметри системи, щоб змістити рівновагу в бік утворення продуктів реакції.
Розв’язання.
Наведена система гетерогенна, тому до виразу закону діючих мас не входить концентрація твердофазних компонентів:
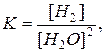
Щоб змістити рівновагу в бік утворення кінцевих речовин за принципом Ле-Шательє, необхідно збільшити температуру, тому що пряма реакція проходить з поглинанням тепла; тиск збільшити, тому що за прямою реакцією тиск зменшується внаслідок зменшення числа молей газоподібних речовин. Концентрацію водяної пари збільшити, бо за прямою реакцією вона зменшується, концентрацію водню зменшити, тому що вона зростає при протіканні прямої реакції.
Фазова рівновага
Фазою називається сукупність всіх однорідних частин системи, що мають однаковий склад і однакові властивості та відділені від інших частин системи поверхнею поділу.
Гетерогенні рівноваги – для процесів переходу речовин з однієї фази в іншу, що не супроводжуються зміною хімічного складу речовин, називаються фазовими рівновагами.
Речовини можуть існувати в трьох агрегатних станах: газоподібному, рідкому та твердому. Кожний агрегатний стан однієї речовини складає окрему фазу. Між різними агрегатними станами однієї речовини через деякий час може встановитися рівновага.
Запитання для самоконтролю
1. Що таке хімічна рівновага?
2. Запишіть закон діючих мас для реакції синтезу аміаку.
3. Які основні принципи зміщення хімічної рівноваги?
4. Як розраховують константу хімічної рівноваги за допомогою термодинамічних даних?
5. Які особливості запису константи рівноваги для гетерогенних реакцій?
6. Що таке фазова рівновага?
РОЗДІЛ 3. РОЗЧИНИ ТА КОЛОЇДНІ СИСТЕМИ
Дата добавления: 2015-03-07; просмотров: 1553;
