Тема 8. Розчини 3 страница
З точки зору хімії, метали - це елементи, здатні легко віддавати свої валентні електрони. Кількісно здатність елементів до віддання електронів виражається енергією іонізації. Метали, на відміну від неметалів, не можуть приєднувати електрони. Також металічні властивості можна кількісно характеризувати електронегативністю. Метали мають невеликі електронегативності (менше 2.0), неметали – великі (більше 2,0).
В періодичній системі металічні властивості збільшуються в групах зверху донизу, в періодах – з кінця до початку. З усіх елементів найбільшою мірою металічні властивості проявляє францій.
Для металів характерні деякі загальні фізичні властивості: високі тепло – та електропровідність (найкращі провідники Ag, Au), здатність до пластичної деформації(висока ковкість). Усі метали, за вийнятком меркурію, тверді речовини. Загальні фізичні властивості металів зумовлені тим, що в металах здійснюється металічний зв’язок. У металах невелика кількість електронів одночасно з’єднує велику кількість ядер, а самі електрони можуть вільно переміщуватись у металах, отже, у металах має місце сильно делокалізований хімічний зв'язок.
За густиною метали поділяють на легкі (густина менше ніж 5000 кг/м3) і важкі (густина більше ніж 5000 кг/м3).
За іншими ознаками розрізняють такі метали:
– чорні (Fe, Mn, Cr)
– кольорові (усі крім чорних);
– рідкі (Li, Rb, Cs, Be, Mo, W, Zr, Hf, Nb, Ta…);
– рідкоземельні (Se, Y, La…);
– розсіяні (Ga, In, Ta, Ge…);
– благородні (Au, Ag, Pt, Pd, Ro, Ir);
– радіоактивні (Tc, Pr, Po, Fr, Ra, Ac).
Методи одержання металів
Більшість металів знаходяться в природі у вигляді сполук з іншими елементами. Одержання металів складає задачу металургії. Для вилучення металу з природних мінералів його треба відновити. В залежності від умов, в яких проводять процес відновлення, розрізняють пірометалургійний і гідрометалургійний методи.
Пірометалургія – це процес добування металів відновленням їхніх сполук за високих температур. Гідрометалургія – це процес добування металів відновленням їхніх сполук у водних розчинах. В якості відновників в пірометалургійних процесах використовуються: кокс (С), оксид карбону (ІІ), водень, активні метали (Аl, Mg,лужні метали). Процес одержання металів за допомогою активних металів називають металотермією (найбільш розповсюджена алюмінотермія). Приклади пірометалургійних процесів:
NiO + C = Ni + CO; Fe3O4 + 4 CO = 3Fe + 4 CO2;
MO3 + 3 H2 = Mo + 3 H2O; Mn2O3 + 2 Al = 2 Mn + Al2O3.
Деякі метали одержують електролізом розчинів чи розплавів. У випадку застосування електролізу розплавів говорять про піроелектрометалургійні процеси.
Приклади гідрометалургійних процесів:
CuSO4 + Fe = FeSO4 + Cu; Pb(NO3)2 + Zn = Zn(NO3)2 + Pb.
Під час електрометалургійних процесів відновлення відбувається на катоді:
(К) Cu2+ + 2е = Cu0.
Лужні та лужно-земельні метали
До лужних металів відносять: Li, Na, K, Rb, Cs, Fr. До лужно-земельних Ca, Sr, Ba, Ra (Be i Mg не відносять до лужноземельних металів). Ступені окиснення для лужних +1, для лужноземельних +2.
Ці метали є активними металами. Активність лужних металів перевищує активність лужно-земельних (стоять лівіше в періодичній системі). Найбільш активні з лужних металів – цезій та францій (радіоактивний).
Лужні та лужноземельні метали реагують з більшістю неметалів. Під час реакції з киснем або киснем повітря утворюються оксиди, пероксиди або супероксиди цих металів:
4Li+O2=2Li2O(оксид); 2Na+O2=Na2O2(пероксид);
К+О2 =КО2 (супероксид).
Пероксиди та супероксиди лужних металів використовуються в засобах індивідуального захисту органів дихання. Вони поглинають вуглекислий газ і воду і виділяють кисень за реакціями:
Na2O2 + CO2 = Na2CO3 + 0,5O2; 2NaO2 + CO2 = Na2CO3 + 1,5O2.
Na2O2 + Н2О = 2NaOН + 0,5O2; 2NaO2 + Н2О = 2NaOН + 1,5O2.
При контакті з повітрям рубідій та цезій самозаймаються в компактному стані, інші у вигляді порошків. Волога сприяє самозайманню, отже, у вологому повітрі горіння виникає легше і скоріше, ніж у сухому.
Літій за звичайних умов реагує з азотом з утворенням нітриду літію:
6Li + N2 = 2Li3 N
Під час нагрівання з воднем лужні та лужно-земельні метали утворюють гідриди:
2 Na + H2 = 2 NaH; Ca + H2 = CaH2.
В гідридах гідроген має ступінь окиснення –1. Гідриди пожежонебезпечні речовини, вони, як і самі лужні та лужноземельні метали, бурхливо реагують з водою:
CaH2 +2Н2О = Са(ОН)2 + 2Н2
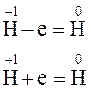
Водень, що виділяється під час реакції, займається. В разі взаємодії великої кількості гідриду та води може статися вибух.
Особливу увагу фахівцям з пожежної безпеки треба привернути до того факту, що лужні та лужноземельні метали інтенсивно реагують з водою. При цьому, в залежності від активності металу, водень може: виділятися відносно спокійно (Li, лужно-земельні метали), займатися (Na, K), або вибухати (Rb, Cs).
2Na + 2Н2О = 2NaОН + Н2.
Звідси випливає правило: при гасінні приміщень, в яких знаходяться лужні та лужно-земельні метали, не можна використовувати воду.
Ще більш інтенсивно, ніж з водою, лужні та лужно-земельні метали реагують з кислотами:
2К + 2НСl = 2KCl + H2.
Лужні та лужно-земельні метали відновлюють менш активні метали з їх оксидів:
ТіО2 + 4 Na = Ті + 2Na2О.
Гідроксиди лужних та лужноземельних металів – є сильними основами, їх називають “лугами”.
Зі сполук лужних та лужноземельних металів найчастіше використовуються такі: хлорид натрію (NaСl) – кухонна сіль, гідрогенкарбонат натрію (стара назва натрій бікарбонат) – NaHCO3 – питна сода, Na2CO3 – кальцинована сода, NaОН – каустична сода, К2CO3 – поташ. Сполуки калію (сульфат, хлорид, нітрат) широко застосовуються як калійні добрива. Нітрати та перхлорати цих металів використовуються як окисники у твердих ракетних паливах та сумішевих вибухових речовинах.
Сполуки кальцію широко застосовуються в будівництві: СаСО3 – крейда, вапняк, мармур; СаО – вапно; СаSO4 · 0,5Н2О – гіпс. Будівельний гіпс є повітряною в’яжучою речовиною, яку одержують за допомогою термообробки гіпсового каменю при 110-180оС:
СаSO4 · 2Н2О ® СаSO4 · 0,5Н2О + 1,5Н2О.
При змішуванні будівельного гіпсу з достатньою кількістю води утворюється пластичне тісто, яке починає швидко густіти і твердіти, завдяки реакції, зворотної до процесу гідратації.
СаSO4 · 0,5Н2О + 1,5Н2О ® СаSO4 · 2Н2О.
Сполуки лужних та лужноземельних металів використовуються в пожежній справі. NaHCO3 – є основою вогнегасного порошку ПСБ–3; Na2CO3 – входить до складу вогнегасного порошку ПС; суміш NaCl i KCl – основні компоненти порошку ПГС–М; NaHCO3 є також одним з компонентів газоутворюючої суміші в хімічно-пінних вогнегасниках. В таких вогнегасниках відбуваються такі реакції:
NaHCO3 + H2SO4 ® NaHSO4 + H2O + CO2,
6NaHCO3 + Al2(SO4)3 ® 3Na2SO4 + 2Al(OH)3 + 6CO2.
В пожежній справі також використовуються деякі луги як адсорбенти вуглекислого газу в протигазах (хімічні поглиначі вапняні). В них відбуваються реакції:
Са(ОН)2 + СО2 =СаСО3¯ + Н2О, 2NaOH + CO2 = Na2CO3 + H2O.
Легкі конструкційні метали (Be, Mg, Al, Ti )
До легких конструкційних металів відносять метали, густина яких менша ніж 5000 кг/м3. Найбільш важливими з них є : Be, Mg, Al, Ti. Магній та багато його сплавів є корозійно нестійкими. Алюміній та особливо титан і берилій є дуже корозійно стійкими металами. Ці метали мають такі ступені окиснення: Mg і Be – +2; Al – +3; Ti –+2,+3,+4. Виходячи з положення металів в ряду активності, можна зробити висновок, що всі легкі конструкційні метали досить активні (йдуть після лужних та лужноземельних металів). Але завдяки наявності у цих металів (крім магнію) міцної захисної плівки на поверхні, вони по відношенню до кисню, води, кислот та лугів ведуть себе не досить активно. З киснем повітря легко реагує магнієвий або алюмінієвий порошок і стружка:
Mg + O2 = 2 MgO.
З водою реагує тільки магній, під час кипіння води:
Mg + 2H2O = Mg(OH)2 + H2.
Берилій та алюміній – типові амфотерні метали, вони реагують з розчинами кислот (у випадку відсутності пасивування) та лугів:
Ве + 2ОН– + 2Н2О = [Ве(ОН)4]2– + Н2, 2Аl + 6H+ = 2Al3+ +3H2.
Магній та алюміній відновлюють багато металів з їх оксидів:
2Аl + Fe2O3 = Al2O3 + 2Fe.
Тому ці метали використовуються в металотермії.
Широко використовується в якості адсорбенту алюмогель, який одержують шляхом обережного нагрівання Al(OH)3:
2Al(OH)3 = Al2O3 +3Н2О.
В пожежній справі застосовується сульфат алюмінію як кислотний компонент газогенеруючого складу:
6NaHCO3 + Al2(SO4)3 ® 3Na2SO4 +2Al(OH)3¯ + 6CO2.
2Al(OH)3 і Mg(OH)2 використовуються в якості наповнювачів пластичних мас, які знижують їх пожежну небезпечність.
Важкі конструкційні метали. Хімічні властивості заліза.
До важких конструкційних металів відносять такі, густина яких перевищує 5000 кг/м3. Це: залізо, манган, хром, мідь, цинк, нікол, станумі деякі інші.
Найбільш практично важливим з них є залізо(елемент ферум) – перший метал за рівнем виробництва. Сплави заліза з карбоном називають чавунами, якщо вміст карбону перевищує 2,14%, і сталямипри меншому вмісті карбону. В своїх сполуках ферум проявляє ступені окиснення +2 і +3.Згідно з положенням в ряду активності ферум є металом середньої активності.
Залізо реагує з деякими неметалами при нагріванні:
2Fe + 3Cl2 = 2FeCl3, 4Fe + 3O2 = 2Fe2O3.
Дрібні порошки заліза можуть займатися при контакті з повітрям (пірофорне залізо).
Реакція з кислотами відбувається з помірною швидкістю:
Fe + 2HCl = FeCl2 + H2, Fe + 4HNO3 = Fe(NO3)3 + NO + 2H2O,
але в концентрованих нітратній та сульфатній кислотах залізо пасивується. Сполуки двовалентного феруму легко окислюються киснем повітря до сполук зі ступінню окислення +3:
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 ¯.
Мідь (елемент купрум) відносять до відносно малоактивних металів, вона в ряду активності знаходиться після гідрогену. Тому мідь не окислюється іонами водню, але легко реагує з азотною та концентрованою сірчаною кислотою. Сплави міді (бронзи, латуні) досить корозійностійкі. Найбільш поширені сполуки купруму, в яких її ступінь окиснення дорівнює +2. Однією з найбільш поширених сполук купруму є мідний купорос (CuSO4×5Н2О). Гідроксид купруму (ІІ), на відміну від більшості інших гідроксидів, легко розкладається під час невеликого нагрівання:
Cu(OH)2 = CuO + Н2О.
Особливістю мангану є його можливість перебувати у багатьох ступенях окиснення: +2, +3, +4, +6, +7. У ступенях окиснення +4, +6, +7 манган проявляє властивості сильного окисника (MnO2, KMnO4, K2MnO4). Оксиди та гідроксиди мангану (+2) і (+3) проявляють основні властивості, відповідні сполуки Mn(+4) – амфотерні, а сполуки Mn (+6, +7) – кислотні властивості.
Нікол – згідно з положенням в ряду активності, метал середньої активності, але, завдяки здатності пасивуватися, нікол в багатьох випадках є дуже стійким до корозій матеріалом. Основна ступінь окиснення ніколю є +2.
Хром, подібно до марганцю, може знаходитися у багатьох ступенях окиснення: +2, +3, +6. Сполуки хрому (+6) – сильні окисники. Найчастіше з них в якості окисника використовується біхромат калію (К2Сr2O7). Сплави заліза з ніколем і хромом дуже корозійностійкі, вони є основою нержавіючих сталей.
Загальні властивості металів.
Основною загальною властивістю металів є легкість до віддання електронів або, іншими словами, метали мають відновлювальні властивості.
Метали реагують з неметалами: активні за звичайних умов, неактивні за підвищеної температури. Благородні метали не реагують з більшістю неметалів.
З водою реагують лужні та лужно-земельні метали (магній при нагріванні з водою).
З кислотами:
а) іони водню окислюють метали, що стоять в ряду активностей до водню;
б) з азотною і концентрованою сірчаною кислотою реагує більшість металів, що знаходяться в ряду активності до срібла включно;
в) деякі метали (Al, Fe, Ti) пасивуються в концентрованих сульфатній та нітратній кислотах.
З розчинами або розплавами лугів реагують типові амфотерні метали (Zn, Al, Be).
З розчинами солей реагують такі метали, активність яких більша, ніж активність металу, що входить до складу солі.
З оксидами металів (під час нагрівання) реагують такі метали, активність яких значно перевищує активність металу, що входить до складу оксиду.
Горіння металів
На здатність металу до горіння впливають властивості як самих металів, так і властивості їх оксидів. Особливо великий вплив мають такі фактори: активність металу, захисні властивості оксидної плівки, що утворюється на поверхні металу, температура плавлення та кипіння металу та оксиду металу. За характером горіння розрізняють леткі та нелеткі метали.
Горіння летких металів (Li, Na, K, Mg, Ca). Леткі метали – це метали, які під час горіння нагріваються вище температури кипіння, тобто метали з низькими температурами кипіння. У більшості випадків температура плавлення оксидів таких металів вища, ніж температура кипіння оксиду. В такому випадку на поверхні рідкого металу знаходиться тверда оксидна плівка. Пари металу проходять крізь оксидну плівку і в повітрі реагують з киснем. Зона горіння встановлюється поблизу поверхні металу. Більша частина тепла передається металу, і він починає кипіти. Кипіння викликає руйнування твердої оксидної плівки. Інтенсивність горіння збільшується. Поступово температура горіння збільшується і починає випаровуватися оксид, що знаходиться на поверхні металу. Це, в свою чергу, призводить до ще більшого зростання інтенсивності горіння. Пари оксиду, що виходять з зони горіння, – конденсуються та утворюють маленькі частки – дим. Утворення щільного білого диму є ознакою горіння летких металів.
Горіння нелетких металів (Ti, Be). Нелеткі метали – це такі метали, температура кипіння яких перевищує температуру плавлення оксидів, що утворюються на поверхні металу. При горінні таких металів їх оксиди знаходяться на поверхні металу в рідкому стані. Тиск пари над такими металами невеликий. Тому великі частки таких металів не горять. Але нелеткі метали горять у порошкоподібному стані, у вигляді тонкої стружки або аерозолю. Вони горять без утворення щільного білого диму.
Деякі метали можуть самозайматися за звичайних умов. В компактному стані самозаймаються рубідій і цезій. У подрібненому стані можуть займатися не тількі ативні метали (лужні та лужно-земельні), але і метали середьої активності (цинкова, магнієва, алюмінієва та залізна пудра). Метали, здатні самозайматися при контакті з киснем повітря за звичайних умов, називають пірофорними.
Приклад 40.
Який об'єм газу (н.у.) вилучиться при реакції 10 г міді з надлишком концентрованого розчину азотної кислоти?
Розв'язання.
1. При реакції концентрованої азотної кислоти з неактивними металами вилучається оксид азоту (ІV):
Cu + 4 HNO3 = Cu(NO3)2 + 2NO2 + 2H2O.
З рівняння реакції видно, що при реакції 1 молю міді вилучається 2 моля, або 2´22.4=44.8 л диоксиду азоту.
2. Визначимо кількість міді: n=m/A=10/63.5=0,16 моль.
3. Визначимо об'єм диоксиду азоту: V=0,16´44.8=7.1 л.
Приклад 41.
Записати рівняння реакцій за допомогою яких можна здійснити такі перетворення:
Na®Na2O®NaOH®NaBr®NaNO3.
Для кожної речовини дати назву, вказати до якого класу неорганічних речовин відноситься кожна сполука. Для окисно-відновних реакцій написати електроні рівняння, для іонообмінних – іонні рівняння.
Розв'язання.
1. 4Na + O2®2Na2O,
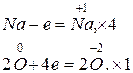
2. Na2O + H2O ® 2NaOH,
3. NaOH + HBr ® NaBr + H2O,
в іоному вигляді: Na++ OH– + H+ +Br – ® Na+ +Br – + H2O
в скороченому іоному вигляді: H+ + OH– ® H2O.
4. NaBr + AgNO3 ® NaNO3 + AgBr¯,
в іоному вигляді: Na++ Br – + Ag+ + NO3– ® Na+ + NO3– + AgBr¯,
в скороченому іоному вигляді: Ag+ + Br –® AgBr¯.
Назви і класи сполук: Na – натрій, проста речовина – метал; Na2O – оксид натрію, клас – оксиди; NaOH – гідроксид натрію, клас – основи; NaBr – бромід натрію, клас – сіль; NaNO3 – нітрат натрію, клас – сіль.
Запитання для самоконтролю
1. Як змінюються металічні властивості в групах і періодах періодичної системи елементів?
2. Який елемент проявляє найбільші металічні властивості?
3. Які метали відносяться до лужних, лужноземельних, легких і важких конструкційних?
4. Які сполуки називаються гідридами?
5. Які метали відносяться до амфотерних?
6. Які існують методи добування металів?
7. Які метали найбільш поширені у земній корі?
8. Сформулюйте правила, які визначають можливість реакції металів з водою, кислотами та лугами?
9. Для гасіння яких металів не можна використовувати воду? Чому?
10. Які фактори впливають на горіння металів?
Тема 14. Хімія неметалів
1. Загальна характеристика неметалів
З точки зору хімії, неметали – це елементи, які мають велику здатність доприєднання електронів. Неметали мають велику спорідненість до електрону. Неметалічні властивості також можна характеризувати величиною електронегативності: неметали мають велику електронегативність. Флуор вважається елементом з найбільшими неметалічними властивостями. До неметалів також відносять інертні (благородні гази), не зважаючи на те, що вони практично не можуть приєднувати електрони.
В періодичній системі неметалів значно менше, ніж металів. Вважається, що в періодичній системі тільки 22 елементи, які відносять до неметалів.Неметалічні властивості в групах періодичної системи збільшуються знизу догори, а в періодах – з початку до кінця періоду.
Загальні хімічні властивості неметалів.
Типові неметали легко взаємодіють з металами:
2Mg+O2=2MgO; 2К+Cl2=2КCl.
Різні неметали можуть реагувати і між собою:
S+O2=SO2,, Н2+ Cl2=2НCl, N2+3H2=2NH3.
Більшість неметалів не реагують з водою, а лише розчиняються в ній. Інтенсивно реагує з водою фтор:
2F2 + 2H2O = 4 HF + O2.
Нітратна та деякі інші кислоти, які мають великі окислювальні властивості, можуть окислювати деякі неметали:
S + 2HNO3 = H2SO4 +2 NO.
Деякі неметали можуть реагувати з розчинами лугів:
Si + 2KOH + H2O = K2SiO3 + 2H2 Cl2 + 2KOH = KCl + KClO + H2О.
Хімічні властивості Оксигену.
Оксиген – найпоширеніший елемент у хімічному складі земної кори, його вміст становить 47 мас.%. Кисень – проста речовина, утворена Оксигеном, міститься в атмосферному повітрі (21 об.%), але більша частина знаходиться у зв’язаному стані. Оксиген входить до складу води, силікатів, алюмосилікатів, сполук тваринного і рослинного походження. Крім О2 в повітрі (в основному на висотах 20-30 км) в невеликих кількостях міститься алотропна модифікація Оксигену – О3 (озон), який має велике значення, оскільки затримує короткохвильове випромінювання Сонця, яке є дуже небезпечним для всіх живих організмів.
Основною ступінню окиснення оксигену є –2. В пероксидах він має ступіньокиснення –1 (Н2О2, Na2O2), в супероксидах –0,5, а в сполуці зі флуором +2 і +1 (OF2 , O2F2).
Оксиген – типовий активний неметал. За реакційною здатністю він поступається тільки галогенам. Взаємодія багатьох речовин з киснем має характер горіння. При цьому кисень виступає в якості окисника. Для дихання людей та тварин потрібний кисень. При суттєвому зменшенні вмісту кисню в повітрі дихання стає неможливим. Зменшення концентрації кисню в повітрі до 12-14% припиняє процес горіння більшості речовин. На цьому явищі побудовано і один з методів гасіння – метод флегматизації. В якості флегматизаторів використовують негорючі гази: CO2, N2, Ar, пари води.
З більшістю простих речовин кисень реагує безпосередньо за звичайних умов або при нагріванні. З киснем практично не реагують інертні (благородні) гази, благородні метали, галогени та азот.
Більшість металів та неметалів сполучається з киснем:
4Fe + 3 O2 = 2 Fe2O3; 4 P + 5 O2 = 2 P2O5; S + O2 = SO2.
При горінні складних речовин у кисні або повітрі при достатній кількості кисню утворюються, в більшості випадків, вищі оксиди (у випадку Сульфуру – SO2,). За наявності в речовині нітрогену утворюється N2 (NO може утворюватися в невеликих кількостях при температурі вище 1550°С). За наявності в молекулі хлору утворюється НС1, а якщо в цій речовині немає гідрогену, утворюється Сl2.
У випадку недостатньої кількості кисню по відношенню до кількості горючої речовини можуть утворюватися продукти неповного згоряння (С, СО, нижчі оксиди).
Деякі речовини при контакті з киснем повітря самозаймаються. Самозаймання – початок горіння у результаті самоініційованих екзотермічних процесів, які виникають без впливу джерела запалювання. Речовини, які здатні самозайматися при контакті з повітрям і мають температуру самонагрівання нижчу за 500С, називають “пірофорними”. До цієї групи речовин можна віднести: прості речовини, які мають високу хімічну активність (рубідій, цезій, цинкову, магнієву та алюмінієву пудру; білий фосфор), деякі металоорганічні та елементоорганічні сполуки (С2Н5Na, (С2Н5)3Al, Р2Н4, SiН4), пірофорне сірчисте залізо, деякі масла та жири. Деякі з перелічених речовин займаються дуже швидко після контакту з повітрям, інші – через тривалий проміжок часу (масла та жири).
При змішуванні деяких оксигенвмісних сполук з відновниками може відбуватися самозаймання сумішей. Такі реакції характерні для деяких вищих оксидів (Mn2O7, Cl2O7, CrO3) і пероксидів (H2O2, Na2O2).
В пожежній справі кисень використовується як компонент газу для дихання в ізолюючих протигазах.
Приклад 42.
В замкненій посудині змішали 8 г водню і 128 г кисню. Суміш вибухнула. Скільки води утвориться?
Розв'язання.
1. Визначимо кількість водню і кисню в суміші:
n(водню)=m/M=8/2=4 моль; n(кисню)=m/M=128/32=4 моль.
2. Згідно з рівнянням реакції, 2H2 + O2 = 2H2O, водень з киснем реагують у співвідношенні 2:1, тобто кисень знаходиться в надлишку. Тому розрахунки ведемо за воднем.
3. З двох молей водню утвориться 2 моля води, а з 4 відповідно 4 моля.
Відповідь: утвориться 4 моля води.
Хімічні властивості гідрогену, хімічні властивості води
Гідроген належить до досить розповсюджених елементів. У хімічному складі земної кори масова частка Гідрогену становить близько 1%. В атмосфері вміст Гідрогену дуже малий (10–5 мас.%). На Землі основна кількість Гідрогену перебуває у зв’язаному стані. Гідроген входить до складу води, тварин і рослин, нафти, природного газу, багатьох мінералів.
У промисловості водень добувають з природного газу за високих температур:
СН4 + Н2О = СО + 3Н2; 2 СН4 + О2 = 2 СО + 4Н2.
У хімічних лабораторіях водень добувають в апаратах Кіппа, діючи за реакціями:
Zn + 2HCl = ZnCl2 + Н2; Al + 2NaOH +2 Н2О = Na2[Al(OH)4] + Н2.
Основні ступені окиснення Гідрогену +1 і –1. За властивостями він частково подібний до лужних металів, але більш подібний до галогенів, тому в в періодичній системі елементів він займає двоїсте положення (розміщується в І і VІІ групах). За звичайних умов активність водню невелика. При нагріванні він реагує з багатьма неметалами:
2Н2 + О2 = 2Н2О; Н2 + Cl2 = 2HCl.
З азотом водень реагує при високому тиску і температурі та наявності каталізатора:
Дата добавления: 2015-03-07; просмотров: 1668;
