Приклад 50.
Здійснити перетворення і дати назви всім продуктам:
С2Н6 ® С2Н5С1 ® С2Н5ОН
Розв'язання.
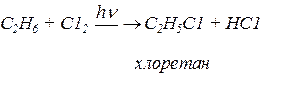
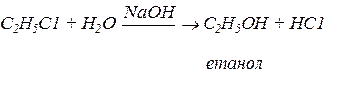
Застосування галогенпохідних у пожежній справі
Деякі галогенпохідні вуглеводнів є ефективними інгібіторами горіння. Вже за наявності у повітрі декількох процентів (або частки процента) фреонів (хладонів) припиняється процес горіння більшості речовин в газовій фазі. Але такі речовини у своїй більшості руйнують озоновий шар атмосфери і тому заборонені до використання. До галогенпохідних вуглеводнів, які не руйнують озонового шару відносяться різні фтор- й перфторвуглеводні: трифторметан СНF3, пентафторетан C2HF5, гексафторпропан С3Н2F6, перфторбутан С4F10, перфторгексан С6F14, гептафторпропан С3НF7. Ці фторвуглеводні забезпечують безпечне гасіння пожеж, але за своєю ефективністю значно поступаються фреонам, які використовувалися раніше.
На основі синтезу з кремнієм отримують силіконову рідину, яка утворює плівку на поверхні осередку горіння:
2СН3Cl + Si ® (CH3)2 SiCl2
Диметилдихлорсілан
Чотирихлористий вуглець застосовується як сполука для гасіння пожеж (СCl4), тому що він майже не горить. Хлороформ (СНCl3) застосовують для отримання фреонів та хладонів:
CHCl3 + HgO + 2HF ® CHClF3 + HgCl2 + H2O.
фреон –22
Хлороформ речовина небезпечна, тому що за наявності кисню та світла розпадається з утворенням отруйного фосгену СОCl2:
hn
CHCl3 + 0,5О2 ® COCl2 + HCl.
Запитання для самоконтролю
1. Яка формула відображає склад алканів, алкенів, алкинів?
2. Які атоми карбону називаються первинними, вторинними, третинними та четвертинними?
3. Які функціональні закінчення прийняті для алканів, алкенів і алкінів?
4. Які продукти утворюються під час горіння вуглеводнів?
5. Які реакції характерні: а) для насичених вуглеводнів; б) ненасичених вуглеводнів?
6. Сформулюйте правило Марковнікова.
7. Що позначають префікси: орто-, мета- і пара-?
8. Що таке ароматичні вуглеводні? Які вони мають особливості в будові та властивостях?
9. За допомогою яких реакцій можна подовжити вуглеводневий ланцюг?
10. Як галогенпохідні вуглеводнів можна перетворити на спирти?
11. Які природні джерела вуглеводнів вам відомі?
12. Яке застосування в пожежогасінні мають галогенпохідні вуглеводнів?
Тема 17. Кисневмісні органічні сполуки
Загальна характеристика кисневмісних сполук
Оксигенвмісні сполуки – це похідні вуглеводнів, у молекулах яких один або декілька атомів гідрогену заміщені на функційні групи, до складу яких входить один або декілька атомів оксигену, окрім функційної групи – NO2.
До оксигенвмісних сполук відносяться:
Спирти – похідні вуглеводнів, у молекулах яких один або кілька атомів гідрогену заміщені на відповідну кількість гідроксильних груп –ОН.
Прості ефіри (етери) – це сполуки, у молекулах яких два вуглеводневих радикали сполучені між собою атомом оксигену. Загальна формула етерів:
R – O – R1
|

Феноли – органічні сполуки, які містять гідроксильну групу, безпосередньо сполучену з атомом карбону бензольного ядра:
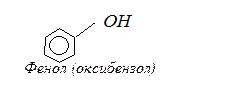
|
 |  |
Молекули альдегідів описуються загальною формулою
у якій R – атом воднюабо вуглеводневий радикал.
О

Загальна формула кетонів R1 – C – R2 . В кетонах атом карбону карбонільної групи сполучений з двома вуглеводними радикалами, які можуть бути однаковими або різними.
Фізичні та хімічні властивості спиртів та фенолів
За систематичною номенклатурою назви спиртів утворюють, додаючи до назви відповідного вуглеводню суфікс – ол. Якщо молекула містить декілька гідроксильних груп, то до назви додають суфікси – діол, – триол ... Нумерацію вуглецевого радикалу починають з атома карбону, який найближче розташований до гідроксильної групи, а місце розміщення гідроксилу позначають локантом, наприклад:
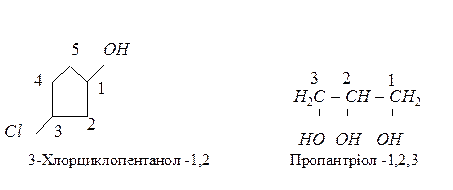
Найпростіша ароматична сполука, що містить гідроксил має тривіальну назвау фенол.
Насичені одноатомні спирти нерозгалуженої будови, які містять від 1 до 11 вуглецевих атомів, за нормальних умов – рідини. Вищі спирти, починаючи з С12, – тверді речовини. Фенол також є твердою речовиною, яка має специфічний запах. Температури кипіння спиртів є значно вищими, ніж температури кипіння вуглеводнів або галогенпохідних, що мають таку ж саму кількість вуглецевих атомів. Це пояснюється асоциацією молекул спирту, внаслідок утворення міжмолекулярних водневих зв’язків.
Здатність спиртів відщеплювати протон від гідроксильної групи виявляє кислотні властивості спиртів, а здатність приєднувати протон до неподіленої електронної пари О – атома виявляє тим самим основні властивості, тобто спирти мають амфотернівластивості.
Спирти реагують з лужними металами з утворенням солей – алкоголятів:
2 R – OH + 2 Na ® 2 R – ONa + H2.
Алкоголяти легко розкладаються водою:
H3C – CH2 – ONa + Н2О ® CH3 – CH2 – CH2OH + NaOH.
Кислотні властивості гліколів (двоатомних спиртів) більші за кислотні властивості одноатомних спиртів через те, що, внаслідок негативного індукційного ефекту (-І) одна гідроксильна група відтягує від іншої електронну густину, тому й гліколі взаємодіють не тільки з лужними металами, але й з лугами з утворенням солей – гліколятів.
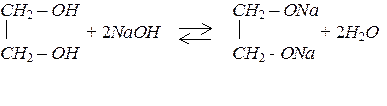
Кислотні властивості гліцерину виражені ще сильніше, ніж в одно– та двохатомних спиртів.
За наявності водовіднімаючих засобів спирти реагують з галогеноводнями з утворенням галогенідів:
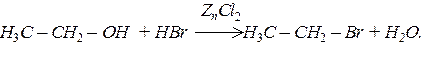
Спирти реагують з мінеральними та органічними кислотами. Продуктами такої взаємодії є відповідні естери:
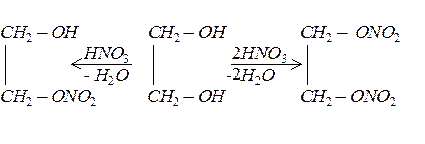
Багатоатомні спирти утворюють з кислотами повні або неповні естери. Наприклад, гліцерин взаємодіє з вищими карбоновими кислотами з утворенням тригліцеридів (жирів). Склад та будову жирів можна позначити загальною формулою:
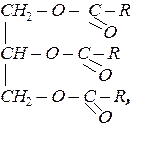
де R – радикали вищих насичених і ненасичених монокарбоновихкислот, наприклад, стеаринової, олеїнової (масло оливи), ліноленової (льняна олія). У природних жирах залишки кислот мають, головним чином, нерозгалужений вуглецевий ланцюг та парну кількість вуглецевих атомів. Гліцериди ненасичених високомолекулярних кислот за певних умов здатні до самозаймання. Згідно з пероксидною теорією А.Н.Баха, такі речовини окислюються киснем повітря за місцем подвійного зв’язку з утворенням пероксидів. Така реакція супроводжується виділенням тепла. Пероксиди, що утворилися, здатні до подальших перетворень, в тому числі до полімеризації. Такі реакції супроводжуються виділенням тепла. До основних умов самозаймання жирів відносяться: великій вміст подвійних зв’язків в залишках карбонових кислот, наявність великий поверхні окислення і малої поверхні тепловіддачі, доступ повітря, температура навколишнього середовища не менше 10 0С, певна щільність промасленого матеріалу.
Кількість подвійних зв’язків можна визначити за допомогою йодометричного методу. Цей метод засновано на здатності галогенів приєднуватися за місцем подвійного зв’язку. За кількістю йоду, що прореагував, можна судити про ступінь ненасиченості сполуки. Критерієм такої оцінки може служити йодне число (Іч), яке показує, скільки грамів йоду приєднується в певних умовах до 100 грамів масла. Якщо Іч< 50 – масло не схильне до самозаймання, а якщо Іч > 50 – схильне.
При дії водовіднімаючих засобів, в залежності від умов, спирти можуть утворювати прості ефіри (етери) або ненасичені сполуки:
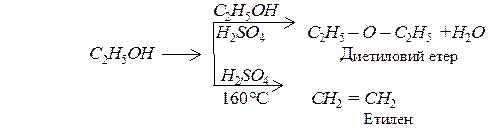
Одноатомні спирти окиснюються за кімнатної температури такими окисниками як KMnO4 та хромова суміш. Первинні спирти окислюються до альдегідів:
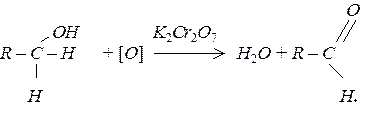
Вторинні спирти при окисленні перетворюються на кетони:
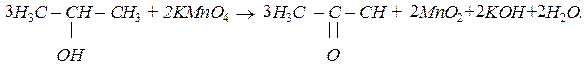
Спирти мають більшу, порівняно з насиченими вуглеводнями, схильність до самозаймання при контакті з сильними окисниками. Полум’я при горінні нижчих спиртів світиться слабко, кіптява не утворюється.
Приклад 51.
Яку кількість етилацетату можна добути з 23 г етанолу і 12 г оцтової кислоти?
Розв'язання.
1. Етилацетат можна добути за реакцією:
CH3–C=O + C2H5OH ® CH3–C=O + H2O.
½ ½
OH O–C2H5
2. Для визначення, яка з реагуючих речовин в надлишку, розрахуємо кількість реагентів:
n(етанолу)=m/M=23/46=0.5 моль ; n(кислоти)=m/M=12/60=0.2 моль.
Етанол знаходиться в надлишку. Розрахунки робимо за оцтовою кислотою.
3. З рівняння реакції бачимо, що з 1 моля кислоти утворюється 1 моль ефіру. Кислоти маємо 0,2 моль, тобто ефіру утвориться теж 0,2 моль.
m(ефіру)=п(ефіру)´М(ефіру)=0,2´88=17,6 г.
Приклад 52.
В чому полягає особливість окиснення третинних спиртів?
Розв'язання.
Первинні та вторинні спирти окиснюються без руйнування вулецевого ланцюга, при цьому утворюються відповідно альдегіди та кетони. Третинні спирти окиснюються значно важче з руйнуванням вулецевого ланцюга і утворенням суміші кислоти і кетону:
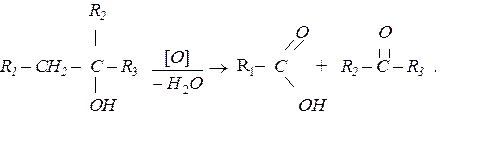
Феноли мають більш виражені кислотні властивості, ніж дво- та трьохатомні спирти.
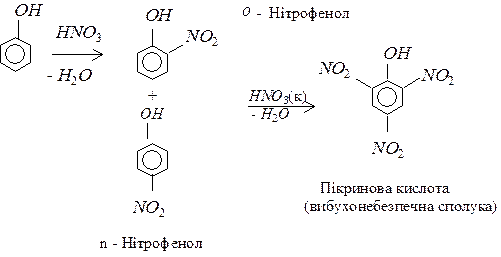
Для фенолів також характерні реакції електрофільного (Se) заміщення по бензеновому кільцю, наприклад, нітрування:
Властивості альдегідів і кетонів
Альдегіди і кетони – це клас органічних сполук, молекули яких містять карбонільну групу >С=О (оксогрупу). Альдегіди мають функціональну групу:

 О
О
 – С
– С
Н
В молекулах альдегідів атом карбону карбонільної групи сполучений з атомом гідрогену і вуглеводневим радикалом.
В кетонах атом карбону карбонільної групи сполучений з двома вуглеводневими радикалами, які можуть бути однаковими або різними. Загальна формула кетонів:
R1– С – R2

О
За систематичною номенклатурою назви альдегідів утворюються з назв відповідних вуглеводнів, додаючи до них суфікс – аль. Головний ланцюг в молекулі альдегіду вибирають так, щоб в нього обов’язково входив атом карбону карбонільної групи, наприклад:
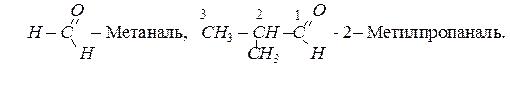
Назву кетонів за систематичною номенклатурою також утворюють з назви відповідного вуглеводню, додаючи до неї суфікс –он. У назві зазначають також номер атома вуглецю, сполученого з карбонільним атомом кисню, наприклад:
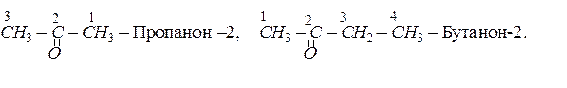
Ізомерія альдегідів пов’язана з розгалуженням карбонового ланцюга радикала і в гомологічному ряду цих сполук починається з четвертого члена ряду:
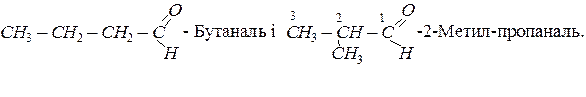
Ізомерія кетонів залежить як від будови алкільних груп-радикалів, так і від положення карбонільної групи в молекулі кетону. Кетон, для якого починається ізомерія, має в своєму складі п’ять атомів вуглецю. Серед ізомерів цього кетону:
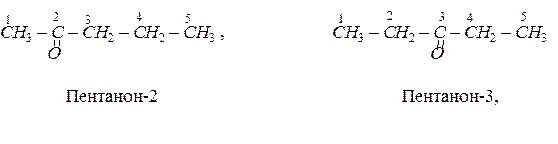
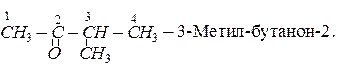
Метаналь – газ, наступні гомологи альдегідів – рідини, вищі альдегіди – тверді речовини.
Ацетон і нижчі кетони – рідини, вищі кетони – тверді сполуки. Альдегіди і кетони киплять при значно нижчій температурі, ніж спирти з такою ж кількістю атомів. Це свідчить про те, що альдегіди і кетони, на відміну від спиртів, не є сильно асоційованими речовинами.
Альдегіди і кетони з невеликою молекулярною масою – дуже леткі речовини, добре розчиняються у воді і мають специфічний запах. Існує декілька методів синтезу акльдегідів і кетонів.
Дегідрування спиртів
При пропусканні пари спирту над нагрітим каталізатором, наприклад, міддю, від спиртів відщеплюється водень, з первинних спиртів при цьому утворюються альдегіди, з вторинних – кетони.
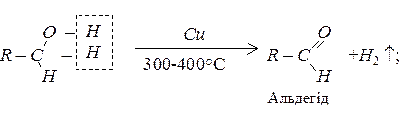
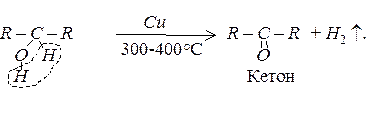
Окиснення спиртів
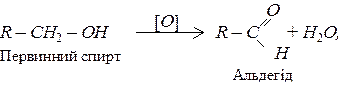
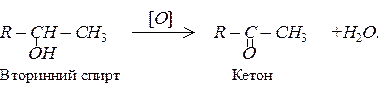
Гідратацією ацетиленових вуглеводнів (за реакцією Кучерова)
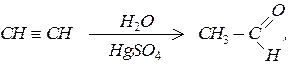
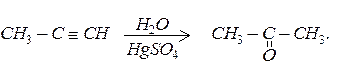
Альдегіди і кетони вступають у численні реакції приєднання до карбонільної групи, в реакції заміщення атомів гідрогену біля a - атомів карбону, в реакції конденсації і полімеризації.
За наявності нікелевих або платинових каталізаторів альдегіди і кетони приєднують водень і відновлюються до спиртів: альдегіди – до первинних спиртів, кетони – до вторинних спиртів:
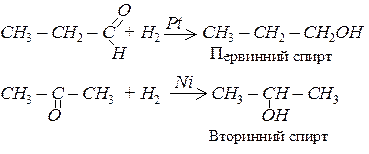
Альдегіди легко окислюються і перетворюються на відповідні карбонові кислоти. У процесі реакції зберігається кількість атомів карбону і структура ланцюга, а альдегідна група перетворюється на карбоксильну:
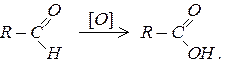
Окислення кетонів відбувається в жорстких умовах при тривалому нагріванні з утворенням суміші кислот.
Реакції горіння альдегідів і кетонів відбуваються до утворення диоксиду вуглецю (II) і води.
Приклад 53.
Яка маса і якої кислоти утвориться при окисненні 10 г етаналю?
Розв’язання.
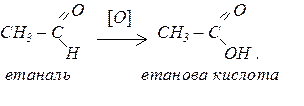
Розрахуємо кількість молей етаналю:
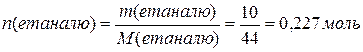
Кількість етанової кислоти така ж сама як і кількість етаналю (n(етанової кислоти) = п(етаналю)). Розрахуєм масу кислоти:
m (етанової кислоти) = n (етанової кислоти) × M(етанової кислоти) =
= 0,227 × 60 = 13,62 г.
Вуглеводи. Особливості горіння целюлози
Органічні речовини, які відносять до класу вуглеводів, широко розповсюджені в живій природі. Представниками вуглеводів є виноградний цукор (глюкоза), фруктовий цукор (фруктоза), буряковий і тростинний цукор (сахароза), крохмаль, целюлоза та ряд інших.У результаті процесу фотосинтезу рослинами щорічно на нашій планеті синтезується велика маса вуглеводів, яка оцінюється вмістом карбону, що становить 4×1010 т. Близько 80% сухої речовини рослин припадає на вуглеводи. В зерні, картоплі, овочах, плодах вуглеводи є резервною поживною речовиною.
Поряд з білками, нуклеїновими кислотами і ліпідами вуглеводи є необхідною складовою частиною організму людини і тварин, де вони виконують важливі біологічні функції.
Вуглеводи поділяють на дві великі групи: прості вуглеводи або моносахариди (монози) і складні вуглеводи або полісахариди (поліози).
Хімічний склад моносахаридів описується загальною формулою СnH2nOn. Молекули моносахаридів містять від 4 до 10 атомів вуглецю, проте найбільше значення мають моносахариди з 5 і 6 атомами вуглецю, тобто пентози С5H10O5 і гексози С6H12O6, а з гексоз – глюкоза (виноградний цукор) і фруктоза (фруктовий цукор). Структурна формула глюкози виведена на основі її хімічних властивостей і має вигляд:
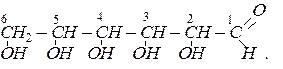
Аналогічно була встановлена хімічна формула фруктози. Вона має будову п’ятиатомного кетоно-спирту:
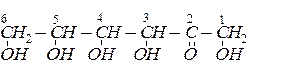
Дисахаридами називають складні сахариди, молекули яких під час гідролізу утворюють дві молекули моносахаридів. Хімічний склад дисахаридів, молекули яких складаються із залишків гексоз, можна подати загальною формулою:
С12Н22 О11:
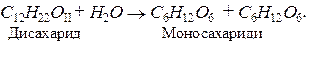
Найбільш поширеним вуглеводом є целюлоза. Целюлоза (від лат. Cellula – клітина) або клітковина, є головною складовою частиною оболонок клітки рослин. Волокна бавовника (очищена вата) і фільтрувальний папір – це зразки майже чистої целюлози. Середня молекулярна маса целюлози різного походження становить від 100 000 до 1 000 000 і більше. Молекули целюлози містять від 600 до 6000 залишків глюкози:
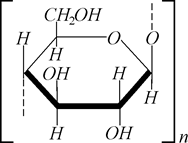 .
.
Целюлоза є складовою частиною стінок клітин рослин. Вона надає тканинам рослин механічної міцності, еластичності і утворює немовби їхній скелет. У рослинах целюлоза утворюється в результаті складних біохімічних перетворень, які починаються з фотосинтезу найпростіших вуглеводнів. Тому в природі целюлоза зустрічається не в чистому вигляді. Нитки бавовника містять 92-95% целюлози, у різних видах деревини вміст целюлози коливається від 40 до 60%.Чиста целюлоза має вигляд білої аморфної на вигляд речовини без запаху і смаку.
Фотосинтез – це процес синтезу в зелених частинах рослин вуглеводів, а також білків і жирів з вуглекислого газу і води за рахунок енергії сонячного світла і з участю зеленого пігменту рослин – хлорофілу.
Утворення вуглеводів з СО2 і води в процесі фотосинтезу можна зобразити загальною схемою:
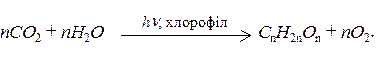
Основною складовою частиною деревини є целюлоза. Завдяки широкому застосуванню деревини як будівельного матеріалу, велике значення має її здатність до горіння. Під дією зовнішнього тепла в деревині відбувається піроліз. При 200-280 0С целюлоза внаслідок дегідратації перетворюється на вугілля і суміш газів, що не здатні до горіння (СО + СО2 + Н2О). При 280-340 0С целюлоза перетворюється на смолу, яка виділяє велику кількість пальних газів (СН4 + СО). Для основних порід деревини температура займання деревини складає 250-2600С. Після запалення верхній шар деревини нагрівається до 290-3000С, забезпечуючи великий вихід газоподібних пальних продуктів піролізу і велику висоту полум’я. Верхній шар продовжує нагріватися до 500-7000С і внаслідок процесів розкладання перетворюється на деревне вугілля. Це деревне вугілля екранує поверхню від виходу пальних газів, але саме не займається через нестачу кисню (який повністю витрачається в зоні полум’я). Займання шару деревини настає, коли факел полум’я зменшується і до поверхні починає доходити кисень повітря. Коли вся деревина перетвориться на деревне вугілля, далі горить тільки саме вугілля.
Приклад 54.
Що таке бродіння сахарів? Чим воно викликається?
Розв’язання.
Бродінням спиртів називають розщеплення молекул сахарів з виділенням вуглекислоти. Бродіння відбувається під впливом ферментів (ензимів). Ферменти – це біологічні каталізатори, які виробляються організмами.
Відомо багато типив бродіння. Найбільш відомим є спиртове бродіння. Процес бродіння – багатостадійний складний процес, кінцевими продуктами якого є етанол і вуглекислий газ:
С6Н12С6 ® 2 С2Н5ОН + 2 СО2.
Крім спиртового бродіння відомо багато інших типів бродіння: лимонокисле, олійнокисле, ацетонобутанолове.
Властивості карбонових кислот та їх похідних
Карбонові кислоти – це похідні вуглеводнів, що містять одну або декілька карбоксильних груп, сполучених з алкільною або арільною групою.
За систематичною номенклатурою назви аліфатичних карбонових кислот утворюються від назв відповідних алканів додаванням закінчення –овакислота. Нумерацію вуглеводних атомів починають з вуглецю карбоксильної групи, наприклад:
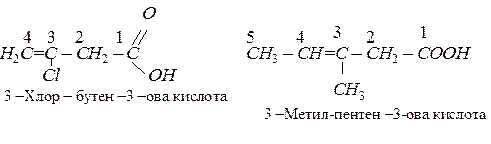
Значна кількість карбонових кислот зберігає тривіальні назви, наприклад: С1 – мурашина (Н – СООН), С2 – оцтова (СН3 – СООН), С4 – масляна (СН3 – СН2 - СН2 –СООН),С12 – лауринова (С12Н23СООН), С16 – пальмітинова (С16Н33СООН), С18 – стеаринова (С18Н37СООН).
Міжмолекулярні водневі зв’язки, що виникають між молекулами карбонових кислот, є настільки міцними, що навіть у газоподібному стані значна кількість цих молекул існує у вигляді димерів. Через це карбонові кислоти менш леткі, ніж відповідні спирти, і це зумовлює їх високу температуру кипіння.
Більшість реакцій карбонових кислот зв’язана з перетворенням карбоксильної групи. Відбувається атака нуклеофільних реагентів по вуглецевому атому карбонільної групи з наступним розривом зв’язку С – О, що приводить до утворення естерів, галогенангідридів або до процесу відновлення.
Окрім того, відбуваються реакції, які супроводжуються розривом О – Н зв’язку (кислотна дисоціація):
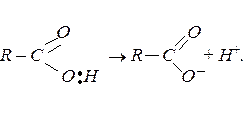
Карбонові кислоти виявляють більші кислотні властивості, ніж спирти. Вони взаємодіють з активними металами, лугами та солями вугільної кислоти із солеутворенням:
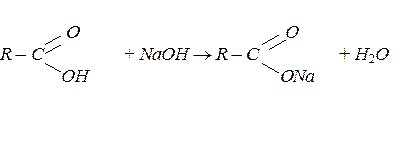
2 Н3С – СООН +Mg ® (Н3С – СООН)2 Mg + H2.
Солі карбонових кислот мають іонну будову й нелеткі. Солі вищих карбонових кислот, таких як пальмітинова, стеаринова, мають поверхнево-активні властивості. Їх називають милами.
С16Н33СООН + NaOH ® С16Н33COONa + H2O
Пальмітинова Мило (ПАР)
кислота
С18Н37СООН + NaOH ® С18Н37СООNa + H2O
Стеаринова ПАР
Кислота
Карбонові кислоти здатні горіти, але, порівняно з вуглеводнями, спиртами, альдегідами та кетонами, мають більш низьку теплоту згоряння.
Естери карбонових кислот добувають при взаємодії карбонових кислот зі спиртами – реакція естерифікації. Ця реакція оборотна й по досягненні рівноваги в реакційній суміші містяться як реагенти, так і продукти:
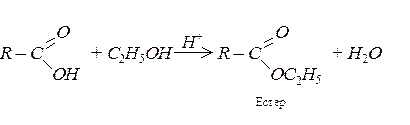
Естери можна гідролізувати в кислому або лужному середовищі. Лужний гідроліз ще називають “омиленням естерів”, і він має дуже широке практичне застосування: добування солей вищих карбонових кислот (мил), гліцерину та інших спиртів:
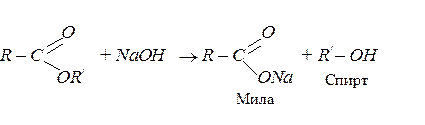
Приклад 55.
Які продукти утворюються під час хлорування карбонових кислот?
Розв’язання.
Під час хлорування карбонових кислот утворюються хлорпохідні карбонових кислот. Галогенування йде по вуглеводневому радикалу:
Н3С – СООН +Cl2 ® СH2Cl – СООН + HCl.
Запитанння для самоконтролю.
1. Які функціональні групи відповідають: а) спиртам, б) кетонам, в) карбоновим кислотам?
2. Размістити феноли, одноатомні, багатоатомні спирти та карбонові кислоти в порядку зростання кислотних властивостей.
3. Що таке прості та складні ефіри? Як називаються реакції їх одержання?
4. Що таке омилення ефірів?
5. Що таке жири? Які жири здатні до самозаймання?
6. Яка різниця між реакціями окиснення альдегідів і кетонів?
7. Яка різниця між реакціями окиснення первинних та вторинних спиртів?
8. Яку загальну формулу мають вуглеводи? Які функціональні групи вони можуть містить?
9. Як відбувається реакція горіння целюлози?
10. Що таке фотосинтез?
11. Що таке мила? Де вони застосовуються?
Тема 18. Азотовмісні та елементорганічні сполуки
Нітросполуки. Їх властивості та застосування
Нітросполуки - це сполуки, що містять у своєму складі, одну або кілька нітрогруп NO2. Нітроалкани поділяють на:
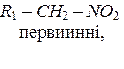
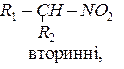
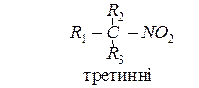
Назву нітросполук за систематичною номенклатурою утворюють з назви відповідного насиченого вуглеводню, додаючи до неї префікс нітро-. Місцеположення нітрогрупи в молекулі зазначають цифрою. Наприклад:
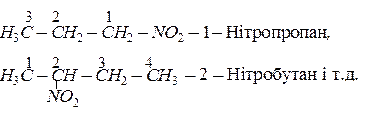
Нітросполуки аліфатичного ряду добувають нітруванням алканів:

Характерною реакцією нітросполук є їх здатність до відновлення. Відновлення нітросполук здійснюють атомарним воднем, добуваючи при цьому первинні аміни:
R – NO2 + 6 [H] ® R – NH2 + 2H2O.
Аміни. Фізичні та хімічні властивості аліфатичних амінів.
Це сполуки, що містять у своєму складі одну або декілька аміногруп.
Класифікація амінів
За кількістю аміногруп розрізняють:

По кількості заміщених атомив гідрогену в молекулі амоніаку розрізняють первинні, вторинні і третинні аміни:
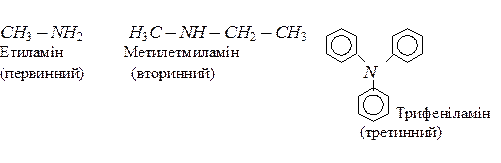
За систематичною номенклатурою назву аміну утворюють з назви відповідного вуглеводню додаванням префікса аміно-. За раціональною номенклатурою назви амінів утворюють додаванням суфікса – амін до назв радикалів; до того ж радикали перелічують за їх ускладненням. Для багатьох амінів використовують тривіальні назви.
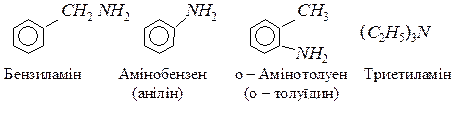
У молекулах аліфатичних амінів атоми азоту перебувають в стані sp2– гібридизації. У тривалентному стані атом азоту має неподілену електронну пару, за рахунок якої він утворює донорно-акцепторний зв’язок з протоном, який має вакантну S – орбіталь:
R – NH2 + H+®R – NH3+.
Саме з наявністю неподіленої електронної пари на атомі азоту й пов’язані основні властивості амінів. У водних розчинах аміни приєднують протон води з утворенням гідроксидів амонійних сполук:
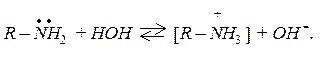
Реакція з бромною водою є якісною на анілін, при цьому утворюється осад 2,4,6 – триброманіліну.
Амінокислоти як мономери білків
Амінокислоти – це карбонові кислоти, молекули яких містять одну або декілька аміногруп. Амінокислоти – це мономери білків, які ковалентно сполучені між собою пептидними зв’язками між карбоксильною групою однієї кислоти та a - аміногрупою іншої:
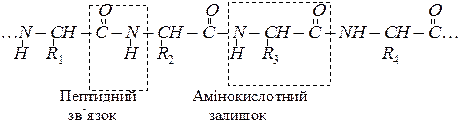
Залежно від довжини утвореного ланцюга, всі поліпептиди умовно можна розділити на пептиди (які містять від 2 до 10 амінокислот), поліпептиди (від 10 до 40 амінокислот) і білки (більше 40 амінокислот). Середня молекулярна маса білків від 4 – 5 тисяч до кількох мільйонів.
Це дуже важливий клас біологічно активних сполук. Білки наявні у вигляді головних компонентів у будь-якій формі живої матерії – мікроорганізмах, тваринах або рослинах. Структура білків надзвичайно різноманітна – існує багато мільярдів хімічно індивідуальних білків. Білки є важливою складовою їжі людини та корму тварин. Людина потребує близько 70 г білка на добу.
Отже, білки – це високомолекулярні природні полімери, що побудовані із залишків амінокислот, які сполучені між собою амідними (пептидними) зв’язками. Кожному білку притаманна властива йому амінокислотна послідовність і вони мають складну просторову структуру, що визначає їх фізико-хімічні та біологічні властивості.
Елементний склад білків (у % від сухої маси):
| Карбон – 51-55 | Гідроген – 6-7 |
| Оксиген – 21-23 | Сульфур – 0,3-2,5 |
| Нітроген – 15-18 | Зола – 0-0,5 |
Приклад 56.
Записати рвіняння реакцій за допомогою яких можна здійснити такі перетворення:
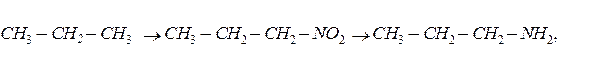 Для кожної органічної речовини дати назву.
Для кожної органічної речовини дати назву.
Розв’язання.
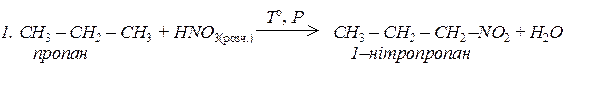
2.СН3 – СН2 – СН2 – NO2 + 6 [H] ® СН3 – СН2 – СН2 – NH2 + 2H2O,
1 – нітропропан 1 – амінопропан
Елементоорганічні сполуки та їх пожежонебезпечність
Метали з органічними сполуками утворюють металоорганічні сполуки з сильно полярними зв’язками. Вони нелеткі й нерозчинні в органічних розчинниках.
Більшість елементорганічних сполук можна одержати в результаті реакцій елементів з галогеноалканами:
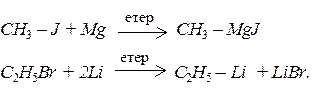
Таким чином реагує з галогенпохідними велика кількість елементів. Цей засіб найчастіше застосовується для отримання магнійорганічних сполук (реактивів Гриньяра) й літійалканів.
Металоорганічні сполуки відрізняються дуже великою реакційною здатністю, деякі з них на повітрі самозаймаються.
Для металоорганічних сполук характерні реакції зі сполуками, які мають активний гідроген:
СН3MgJ + HA ® CH4 + J – Mg – A.
Наприклад:
СН3MgJ + H2O ® CH4 + Mg(OH)J
СН3MgJ + H2N – R ® CH4 + R – NH – MgJ .
Диоксид вуглецю легко приєднує металоорганічні сполуки з утворенням карбонових кислот:
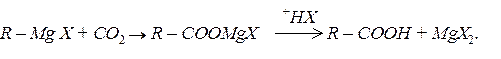
За невеликим винятком, металоорганічні сполуки токсичні для людей та тварин. Токсичність залежить від природи елемента й будови сполуки. Найбільш токсичні сполуки арсену, стибію, меркурію.
Найбільш активні, з хімічної точки зору, елементоорганічні сполуки натрію, літію, калію. Вони розкладаються без плавлення при нагріванні, на повітрі самозаймаються .
Розглянувши хімічні властивості елементоорганічних сполук, можна зробити висновок, що ці сполуки не можна гасити водою, а також диоксидом карбону.
Запитання для самоконтролю.
1. Які функціональні групи відповідають: а) нітросполукам, б) амінам?
2. Що таке реакція нітрування?
3. Який кінцевий продукт відновлення нітросполук?
4. Чому аміни проявляють основні властивості?
5. Що таке білки? Яке вони мають значення?
6. Які нітрогенвмісні сполуки вибухонебезпечні?
7. Які сполуки назвають елементоорганічними?
8. У чому складність гасіння елементоорганічних сполук?
Тема 19. Полімерні матеріали.
Характерною особливістю багатьох ненасичених сполук є їх здатність вступати в реакцію полімеризації і утворювати полімери.
Полімеризацією ненасичених сполук називають хімічну реакцію утворення полімеру (високомолекулярної сполуки) за рахунок з’єднання між собою великої кількості молекул ненасичених сполук (мономерів) ковалентними зв’язками, які виникають внаслідок розриву кратних зв’язків (p - зв’язків) у молекулах мономерів.
Полімеризація, наприклад, однозаміщених похідних етилену може бути зображена загальною схемою:
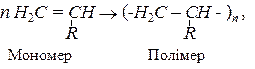
де n – ступінь полімеризації, який може мати значення до кількох сотень тисяч одиниць. При значенні n = 2,3,4… 10 сполуки називають олігомерами (від грец. “олігос” – небагато). Полімери знаходяться в генетичному (спорідненому) зв’язку з вихідними мономерами. Замісники – атоми водню, хлору (Cl) або – CH3, -CN, - С6Н5, Н2С = СН – та інш.
У хімії полімерів широко використовують також сумісну полімеризацію кількох різних мономерів, яку називають співполімеризацією.
Полімери, добуті методом полімеризації, називають переважно за назвою мономерів, до якої додають префікс полі.
Каучук має велике народногосподарське значення. З нього виготовляють гуму, а гумова промисловість виготовляє понад 70 тис. назв різноманітних виробів. Розрізняють два види каучуків: натуральний і синтетичний.
Натуральний (природний) каучук має будову:

Липкий натуральний каучук при нагріванні з сіркою перетворюється на нелипкий еластичний продукт, який отримав назву вулканізованого каучуку, а процес взаємодії каучуку з сіркою назвали вулканізацією. В процесі вулканізації сірка приєднується за місцем подвійних зв’язків каучуку і утворює поперечні (місткові) зв’язки між полімерними ланцюгами. Відбувається “зшивання” лінійних макромолекул каучуку в більші, сітчасті (тримірні) полімерні молекули.
Поперечні зв’язки, які утворює при цьому сірка, надають такому каучуку еластичності, міцності і усувають липкість. Вулканізований каучук (гума) може розтягуватися до 900%.
Синтетичні каучуки (СК).
Перше в світі велике промислове виробництво СК було організовано в СРСР у 1930 р. на основі методу, розробленого С.В. Лебедєвим. Як вихідний дієн був використаний дивініл (бутадієн-1,3). Будова такого полімеру має вигляд:
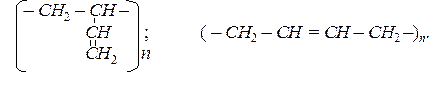
Реакції поліконденсації також дають можливість отримати високомолекулярні сполуки. Під час таких реакцій відбувається сполучення молекул мономерів з одночасним відщепленням легких молекул (Н2О, NH3, CH3OH та інш.).
Прикладом реакції поліконденсації є реакція між терефталевою кислотою і етиленгліколем:
n HOOC – C6H4 – COOH + n HO – CH2 – CH2 – OH ®
Терефталева кислота Етиленгліколь
® 2nH2O+HOO –C6H4–CO – (–O– CH2 –CH2–O–CO –C6H4CO –)n-1OCH2 –CH2OH
Кінцева група Кінцева група
Під час цієї реакції утворюється поліетилентерефталат з якого виробляють волокно “лавсан” а також різноманітний посуд.
Реакція поліконденсації лежить в основі утворення фенол-формальдегідних смол.
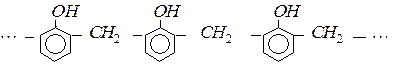
Фенолформальдегідні смоли використовують для виготовлення пресовочних порошків, шаруватих пластиків, лаків, клеїв, пінопластів.
Особливості горіння полімерів
Особливістю процесів горіння полімерів є те, що великі за розміром молекули полімерів не можуть переходити в газовий стан. Горіння їх, як і горіння більшості твердих речовин, відбувається в газоподібному стані. Тому для того, щоб полімер зайнявся, потрібно його підігріти до температури, коли починається його термічна деструкція. Продукти розкладання полімерів переходять в газоподібний стан, змішуються з повітрям та горять. Температура займання більшості пластмас вища ніж 200°С.
У продуктах горіння пластмас можуть міститись токсичні речовини. Вони можуть складатися з оксидів азоту (NO, NO2), хлороводню (НCl), чадного газу (СО) та синильної кислоти (HCN). Горіння більшості полімерів лімітується процесами масотеплопередачі і визначається умовами дифузії горючих продуктів розкладу і кисню повітря та їх змішування. Тому горіння полімерів має дифузійний характер.
Приклад 57.
Яку кількість бутадієнового каучуку можна добути з 5 кг етанолу за методом Лебедєва?
Розв'язання.
1. За методом Лебедєва з етанолу отримують бутадієн:
2CH3CH2OH ® CH2=CH–CH=CH2 + 2H2O +H2,
а з бутадієну - каучук:
n CH2=CH–CH=CH2 ® (–CH2–CH=CH–CH2–)n.
З рівняння бачимо, що з 2 молів спирту утворюється 1 моль бутадієну, а маса каучуку дорівнює масі бутадієну.
2. n(C2H5OH) = m(C2H5OH)/M(C2H5OH) =5000/46 = 108,7 моль;
n(C4H6) = n(C2H5OH)/2= 108,7/2 = 54,35 моль.
3. m(каучуку)=m(C4H6)= n(C4H6)´M(C4H6) = 54,35 ´ 54 = =2934,8г.
Запитання для самоконтролю.
1. Що таке: а) полімери, б) мономери, в) олігомери?
2. У чому різниця між реакціями полімеризації та поліконденсації?
3. Що таке елементарна ланка полімера?
4. Які вам відомі стадії реакцій полімеризації?
5. Що таке: а) гума, б) каучук, в) ебоніт?
6. Який процес називається вулканізацією?
7. У чому особливості реакцій горіння полімерів?
8. Що таке термодеструкція полімерів?
РОЗДІЛ 6. Тема 20. ХІМІЯ ТА ОХОРОНА НАВКОЛИШНЬОГО
Дата добавления: 2015-03-07; просмотров: 2042;
