Методи добування
Синтез Вьолера:
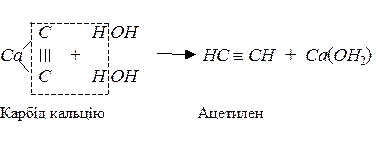
Оксидаційний піроліз метану – промисловий метод:
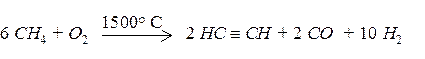
Алкіни – термодинамічно нестійкі сполуки, які за деяких умов можуть самочинно вибухати. Так, ацетилен при тиску вище, ніж 196 кПа без контакту з повітрям здатний до вибуху (під впливом місцевого розігріву або удару):
С2Н2 = 2С + Н2.
При контакті з бромом, хлором і фтором ацетилен самозаймається. При горінні ацетилену та його гомологів утворюється кіптява, а полум’я сильно світиться.
Приклад 47.
Запропонуйте спосіб отримання бутин-2 з н-бутана.
Розв’язання.
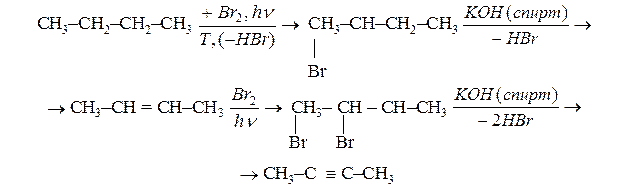
Ароматичні вуглеводні
Термін “ароматичні сполуки” виник ще на початку розвитку органічної хімії, коли органічні речовини поділяли на аліфатичні (жирні) й ароматичні (що мають запах). До ароматичних сполук відносять бензен та інші сполуки, що подібні до нього за хімічними властивостями. Такі хімічні властивості мають назву ароматичнихі вони відмінні від властивостей аліфатичних вуглеводнів.
Довжини всіх С – С зв’язків молекули бензену є однаковими й дорівнюють 0,14 нм (довжина С=С зв’язку дорівнює 0,134 нм, довжина С – С зв’язку – 0,154 нм), тобто вони мають середнє значення між довжинами одинарного й подвійного зв’язків. Атоми карбону в молекулі бензену знаходяться в стані sp2 – гібридизації. Шість атомів карбону сполучені між собою s - зв’язками й замкнені у цикл. Довжини всіх С – Н s - зв’язків однакові й дорівнюють 0,108 нм. Усі шість атомів карбону і шість атомів гідрогену розміщені в одній площині. Крім того, в молекулі бензену кожен С – атом має вільну р – орбіталь, яка може брати участь у створенні p- зв’язків (рис.12).
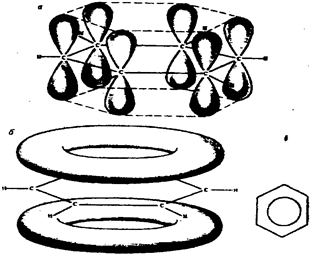
Рис.12. Схема утворення зв’язків в молекулі бензену
Ці р – електрони в бензені не поєднуються в пари, а є делокалізованими, тобто створюють спільну p – електронну хмару, що рівномірно розподілена по всій молекулі (б), оскільки формулу бензену правильніше зображувати у вигляді рівнобічного шестикутника з вписаною в ньому циклічною p –орбіталлю, що символізує секстет p – електронів (в). На відміну від етиленових сполук, кожному С – С - зв’язку відповідає електронна густина лише одного р – електрона. Такий зв’язок має назву ароматичного. Але часто використовують й формули Кекуле у вигляді рівнобічного шестикутника з трьома кон’югованими подвійними зв’язками:

Бензен – це перший член гомологічного ряду ароматичних вуглеводнів. Ароматичні вуглеводні називають за систематичною номенклатурою як заміщені бензену. Для замісників бензену нумерацію починають від “найстаршого” замісника. За пріоритетністю замісники для ароматичних сполук розміщуються в ряд:
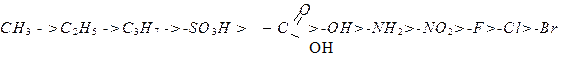
Інша система позначення замісників, яку також визнає ІUРАС, заснована на використанні префіксів орто- (1,2-), мета- (1,3) і пара- (1,4), які позначають атоми карбону бензенового ядра відносно С – атома, який має пріоритетний замісник.

Префікси записують часто у скороченому вигляді, буквами: о-, м -, n-, наприклад:
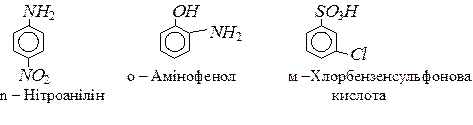
Деякі історичні назви ароматичних вуглеводнів затверджено номенклатурою ІUРАС, наприклад:

Хімічні властивості ароматичних сполук
Бензен може вступати у реакції: заміщення, приєднання, у реакції, що супроводжуються розривом бензольного кільця.
Реакції електрофільного заміщення
Для бензену та його похідних найбільш характерними є реакції електрофільного заміщення в ароматичному ядрі.
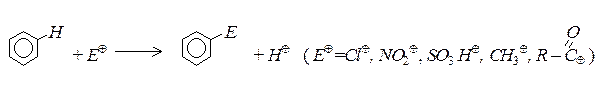
1. Алкілювання (реакція Фріделя-Крафтса)
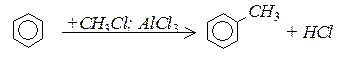
2. Нітрування. Бензен та його гомологи нітрують “нітруючою сумішшю” – сумішшю концентрованих азотної та сірчаної кислот:
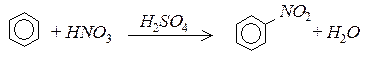
3. Галогенування. За наявністю каталізаторів (Fe3+,Al3+,Sb3+) галогени заміщують атом водню в бензеновому ядрі:
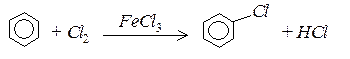
Реакції приєднання
Щоб здійснити реакцію приєднання, спочатку треба подолати енергетичний бар’єр кон’югованої системи p - електронів. Тому ці реакції відбуваються з багатими на енергію реагентами-частинками з неспареними електронами або вільними радикалами.
Бензен та його похідні гідруються над нікелевими або платиновими каталізаторами до відповідних циклогексанів:
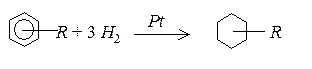
Хлор і бром приєднуються до бензену при УФ – опромінюванні за відсутності каталізаторів:
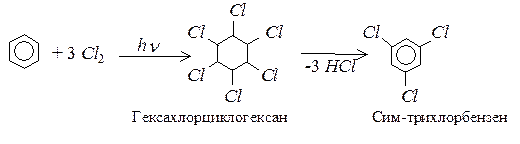
Реакції оксидації
За звичайних умов бензен стійкий до дії окисників. Бензен не знебарвлює водний розчин перманганату калію навіть при нагріванні.
Гомологи бензену, на відміну від бензену, легко окислюються до карбонових кислот, причому, незалежно від довжини бічного вуглецевого ланцюга, карбоксильна група кислоти, що утворюється, завжди сполучена з бензеновим ядром:

Ароматичні сполуки мають більші температури самозаймання, ніж насичені і ненасичені вуглеводні. Внаслідок великого вмісту карбону, бензол та його гомологи горять сильно кіптявим яскравим полум’ям.
Приклад 48.
Ароматична нітросполука має склад: С–37% ; Н–2,2%; N–18,5%; О–42,3%. Встановити простішу формулу цієї сполуки.
Розв'язання.
1. 100 г речовини будуть вміщувати таку кількість молей атомів кожного елементу:
n(C)=m(C)/A(C)=37,0/12=3,08; n(H)=m(H)/A(H)=2,2/1=2,2;
n(N)=m(N)/A(N)=18,5/14=1,32; n(O)=m(O)/A(O)=42,3/16=2,64.
2. Розрахуємо співвідношення кількості молей атомів усіх елементів:
n(C) : n(H) : n(N) : n(O) = 3,08 : 2,20 : 1,32 : 2,64
Це співвідношення буде відповідати простішій формулі речовини, якщо воно буде виражене найменшими цілими числами.
n(C) : n(H) : n(N) : n(O) = 7 : 5 : 3 : 6,
тобто простіша формула речовини C7H5N3O6.
Приклад 49.
Запропонувати методи введення в бензенове кільце таких замісників: –Br, –NO2, –CH3.
Розв'язання.
Для отримання моногалогенпохідних бензену, треба використовувати в якості каталізаторів “кислоти Льюіса” (AlCl3, AlBr3, FeCl3):
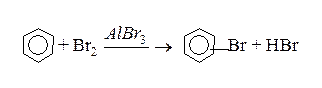
Нітрогрупа в бензенове кільце вводиться при дії “нітруючої суміші” (нітратна + концентрована сульфатна кислоти):
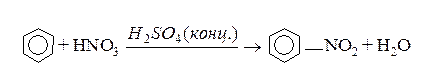
Для введення вуглеводневих радикалів використовуєтьс реакція Фріделя–Крафтса, яка відбувається в присутності кислот Льюіса:
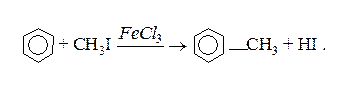
Пожежна небезпека вуглеводів
Усі вуглеводні здатні до реакції горіння. Горіння залежить від об’єму кисню, потрібного на проведення цього процесу.
При повному згорянні утворюється вуглекислий газ і вода:
2С2Н6 + 7О2  4СО2 + 6Н2О.
4СО2 + 6Н2О.
За нестачі кисню замість вуглекислого газу може утворюватися чадний газ (СО):
С4Н8 + 4О2  4СО + 4Н2О.
4СО + 4Н2О.
Сполуки з великим вмістом вуглецю при горінні в повітрі згоряють не повністю – при цьому утворюється сажа (кіптяве полум’я). Якщо вуглеводні-газоподібні сполуки утворюють вуглеводнево-повітряні суміші, вони здатні до вибуху.
Галогеновуглеводні вуглеводнів, їх застосування у пожежній справі
Галогеновуглеводні – це найпростіші похідні вуглеводнів, в яких один або кілька атомів водню заміщені на галогени.
Номенклатура та ізомерія
За систематичною номенклатурою назви галогеновуглеводнів утворюють за назвою відповідного алкану, позначаючи в префіксі назву галогену та номер вуглецевого атома, сполученого з цим галогеном.
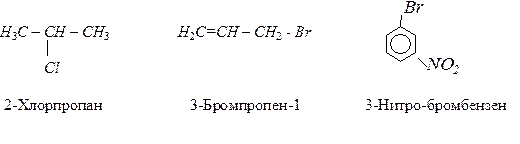
Також поширені тривіальні назви, наприклад: СНCl3 – хлороформ, СНBr3 – бромоформ, СCl4 – чотирихлористий вуглець та інш.
Будова та реакційна здатність
Реакційна здатність галогенідів з однаковими вуглецевими радикалами зменшується в ряду:
R – J > R – Br > R – Cl > R – F
Галогеналкани – одні із найбільш реакційноздатних органічних речовин. Більшість реакцій цих речовин відбувається з участю атома галогену. Зв’язок між атомом карбону і атомом галогену ковалентний. Але галоген більш електронегативний, ніж вуглець. Тому електронна пара зв’язку С  Нal значно зміщена до атома галогену. Внаслідок цього зв’язок поляризується і атом галогену має заряд d-, а атом карбону – заряд d+.
Нal значно зміщена до атома галогену. Внаслідок цього зв’язок поляризується і атом галогену має заряд d-, а атом карбону – заряд d+.
Більшість реакцій галогеноалканів відбувається з розривом С – Hal - зв’язку. Нуклеофільне заміщення є типовим для галогеналканів:
Nu-: + R ® X ® Nu–R + :Х –.
Так реакція галогеналканів з водою відбувається за звичайних умов, або при невеликому підігріванні. Для прискорення такої реакції можна використовувати луги:
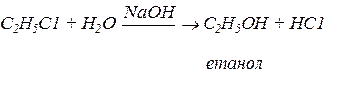
Взаємодія з металами
Реакція Вюрца. Реакція утворення насичених вуглеводнів при взаємодії з металевим натрієм:
СН3 – СН2 – Cl + 2Na + Cl – СН2 – CH3 ® 2NaCl + СН3 – СН2 – СН2 – СН3
Реакція Вюрца – Віттіга. Взаємодія сумішів галогеноалканів і галогенаренів з металевим натрієм – різновид реакції Вюрца:
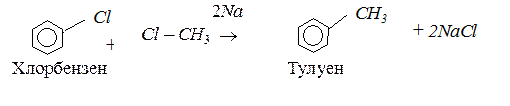
Дата добавления: 2015-03-07; просмотров: 2348;
