Тема 8. Розчини 4 страница
N2 + 3Н2 = 2 NН3.
Водень реагує з активними металами, при цьому утворюються сполуки, в яких водень має ступінь окиснення –1 (гідриди металів):
2Nа+ Н2 = 2 NаН, Са+ Н2 = СаН2..
Гідриди металів бурхливо реагують з водою з виділенням водню, який в більшості випадків займається або вибухає:
2NаН + 2Н2О = 2NаОН + Н2.
Такі властивості гідридів металів роблять їх пожежонебезпечними.
Однією з найпоширеніших сполук водню є вода. Завдяки доступності води та її властивостям, вона використовується як основний засіб для пожежогасіння. Вода термічно дуже стабільна речовина – вона починає розкладатися на водень і кисень за температур вищіх ніж 2000 °С. Вода має велику теплоємність та теплоту випаровування, що робить її ефективним охолоджуючим засобом. Водяна пара не підтримують горіння і має помірну флегматизуючу дію. Крім того, вода – найдешевищий і найдоступніщий засіб гасіння.
Але у води є ряд негативних для пожежогасіння властивостей. Висока температура замерзання (0°С) викликає ускладнення при застосуванні води за низьких температур. Особливо небезпечною для обладнання є властивість води при замерзанні розширятися. Вода має великий поверхневий натяг та невелику в’язкість, що призводить до поганого змочування деяких поверхонь та швидкого стікання води з вертикальних поверхонь. Вода та водні розчини проводять електричний струм, що призводить до обмежень при застосуванні води при гасінні електрообладнання. До негативних властивостей води можна віднести і її здатність викликати корозію металів. Крім того, воду не можна використовувати для гасіння речовин, з якими вона активно реагує. Це лужні та лужноземельні метали, гідриди металів, деякі карбіди металів, деякі метало- та елементоорганічні сполуки:
2К + 2Н2О = 2КОН + Н2, Са + Н2О = Са(ОН)2 + Н2,
2NаН + 2Н2О = 2NаОН + Н2, СаС2 + 2Н2О = Са(ОН)2 +С2Н2,
С2Н5К + Н2О = КОН + С2Н6, Ca3P2 + 6H2O = 3Ca(OH)2 + 2PH3.
Хімічні властивості галогенів
Галогени знаходяться в сьомій групі періодичної системи елементів. До них належать Флуор, Хлор, Бром, Йод і Астат. Флуор, як найбільш електронегативний елемент, проявляє в сполуках тільки одну ступінь окиснення ––1. Решта галогенів виявляють ступені окиснення від –1 до +7. Велика здатність галогенів до приєднання електронів характеризує їх як типові неметали.
Галогени реагують з більшістю металів. Причому з активними металами реакції відбуваються бурхливо:
2Al + 3Br2 = 2AlBr3.
Галогени також реагують з неметалами. Фтор реагує з усіма неметалами, за винятком О2, Не, Ne, Ar. Так, інертний газ ксенон горить у середовищі фтору:
Xe + 2F2 = XeF4.
В середовищі фтору горить навіть вода:
2F2 + 2H2O = 4НF + О2.
Фтор – дуже токсичний газ світло-зеленого кольору з різким запахом. Він надзвичайно хімічно активний, реагує з більшістю простих та складних речовин. Зі сполук флуору найбільш важливими є фтороводень (НF) та його солі. Розчин НF у воді називається плавиковою (фторидною) кислотою. Вона відрізняється від інших галогеноводневих кислот здатністю роз’їдати скло. За силою НF більш слабка, ніж інші галогеноводневі кислоти.
Хлор – жовто-зелений газ з різким запахом, отруйний. Подібно до фтору, реагує з багатьма простими та складними речовинами, але його активність трохи менша. Хлороводень (HCl) – газ, який добре розчиняється у воді.
Бром – літка коричнева рідина, при попаданні на шкіру викликає дуже сильні опіки. Пари брому дуже токсичні. Бромоводень – газ, який добре розчиняється у воді. У водних розчинах НВr дисоціює повністю.
Йод – темно-фіолетова тверда речовина, в хімічних реакціях може проявляти як окисні, так і відновні властивості.
Бром та йодпохідні вуглеводнів (хладони, фреони) є ефективними інгібіторами горіння, але завдяки їх руйнуючому впливу на атмосферний озон більшість з них для використання заборонена.
Хімічні властивості сульфуру
Для сульфуру характерні ступені окиснення: –2; +4; +6. Сульфур існує у вигляді кількох алотропних видозмін. За кімнатної температури термодинамічно стійкою є ромбічна сірка. Сірка є типовим неметалом середньої активності, з активними металами вона сполучається за кімнатної температури, з іншими – у разі нагрівання:
Zn + S = ZnS.
Сірка також реагує з багатьма неметалами:
S + O2 = SO2; S + H2 = H2S;
Ступінь окиснення –2 сульфур проявляє в сірководні (H2S).Сірководень – безбарвний, дуже токсичний газ, з запахом тухлих яєць. У водному розчині H2S – слабка кислота (сульфідна кислота).
Ступінь окиснненя +4 сульфур проявляє в оксиді сульфуру (ІV) (SO2), сульфітній кислоті (H2SО3) та її солях (сульфітах). H2SО3 – у водних розчинах двохосновна кислота середньої сили, дуже нестійка сполука, вона існує тільки у водних розчинах.
Ступінь окиснення +6 сульфур проявляє в оксиді сульфуру (VІ) (SO3), в сульфатній (сірчаній) кислоті (H2SО4) та її солях (сульфатах). H2SО4 – це безбарвна оліїста речовина з густиною 1840 кг/м3, при попаданні на шкіру викликає сильні опіки. При змішуванні сульфатної кислоти з водою виділяється велика кількість тепла. Якщо воду додавати до концентрованої H2SО4, вода закипає та розбризкується, тому при приготуванні розчинів H2SО4 кислоту додають у воду, а не воду до кислоти.
Розведена сульфатна кислота реагує з металами, завдяки наявності в розчині іонів гідрогену:
Zn + H2SО4 = ZnSО4 + Н2, Zn + 2H+ = Zn2+ + Н2.
Концентрована сульфатна кислота більш сильний окисник, ніж розведена. Вона окислює метали, що стоять в ряду активності після водню (крім золота та платини). Електроноативним елементом при цьому виступає Сульфур. Зі ступені окиснення +6 він може відновлюватися до ступіней окиснення +4, 0, -2. Ступінь відновлення сірки залежить від концентрації кислоти, температури та активності металу.
Але деякі метали (Fe, Al, Cr) пасивуються при контакті з концентрованою сульфатною кислотою.
Сірководневі солі феруму (сульфіди і полісульфіди: FeS, FeS2, Fe2S3) здатні займатися при контакті з повітрям.
Хімічні властивості нітрогену та фосфору
Нітроген і фосфор належать до головної підгрупи п’ятої групи періодичної системи елементів. Обидва елементи є неметалами. Нітроген проявляє всі ступені окиснення від –3 до +5, для фосфору характерні ступені окиснення -3, +3, +5.
За звичайних умов азот – безбарвний газ, без запаху. Азот є основною складовою частиною повітря (78% за об’ємом). Він не є отруйною речовиною, але не підтримує дихання. Азот також не підтримує горіння, але за своєю флегматизуючою дією він поступається вуглекислому газу. Молекула азоту складається з двох атомів, які пов’язані потрійним зв’язком. Завдяки цьому, молекула N2 – найбільш міцна серед двохатомних молекул простих речовин, а газоподібний азот хімічно малоактивний. За звичайних умов азот реагує тільки з літієм:
6Li + N2 = 2Li3N,
при цьому утворюється нітрид літію. Аналогічна реакція відбувається з іншими активними металами за підвищених температур, тому для гасіння таких металів азот не використовують. При реакції нітридів з водою утворюється аміак:
Li3N + 3Н2О = 3LiОН + NН3.
В аміаці та нітридах азот проявляє ступінь окиснення –3. Аміак добре розчиняється у воді: в 1 об’ємі води розчиняється близько 700 об’ємів аміаку.
У повітрі аміак горить з утворенням молекулярного азоту:
4NН3. + 3О2 = 6Н2О +6N2
Така сама реакція за наявністю каталізатора відбувається інакше:
4NН3.+ 5О2 = 6Н2О +4NО..
Така реакція використовується в процесі синтезу нітратної кислоти.
Аміак – речовина основного характеру. У водному розчині аміаку встановлюється рівновага:
NН3.+ Н2О = NН3.× Н2О = NН4 ОН = NН4 + ОН–.
З кислотами гідроксид амонію дає солі амонію; також солі утворюються при взаємодії газоподібного аміаку:
NН4ОН + НNO3 = NH4NO3 + Н2О , NH3 + HCl = NH4Cl.
З усіх оксидів нітрогену (N2O, NO, N2O3,, NO2, N2O5) найбільш поширеним є оксид нітрогену (ІV).
Нітратна (азотна) кислота (HNO3) є сильною кислотою, яка проявляє окисні властивості завдяки нітрогену в ступені окиснення +5. Вона окислює метали, що стоять в ряду активності, як до гідрогену, так і після гідрогену (крім золота та платини), перетворюючи їх в нітрати. Нітратна кислота при цьому відновлюється до різних продуктів (N2O, NO, NO2, N2, NH4NO3), залежно від концентрації кислоти, активності металу та температури.
Нітратна кислота, крім металів, окислює багато неметалів і складних речовин, в тому числі органічних. У випадку концентрованої кислоти реакція з деякими органічними речовинами може викликати займання цих речовин, а при активному змішуванні великих кількостей речовин – вибух. Тому нітратна кислота хоча і не є горючою речовиною – є пожежонебезпечною сполукою.
Солі нітратної кислоти – нітрати, завдяки наявності в їх складі атому нітрогену в ступені окиснення +5 теж проявляють окисні властивості. Їх суміші з відновниками можуть інтенсивно горіти або вибухати. Так, суміш нітрату калію з вугіллям та сіркою відома зі стародавніх часів як “чорний порох”. Нітрати використовуються як компоненти в піротехнічних генераторах вогнегасних аерозолей (КNO3,NH4NO3).
Фосфор, на відміну від нітрогену, тверда речовина. Він має кілька алотропних видозмін. Найбільш вивчені з них білий, червоний та чорний. Білий фосфор пожежонебезпечний і дуже отруйний. При контакті з повітрям за звичайних умов білий фосфор самозаймається. Це пояснюється тим, що на повітрі він інтенсивно окислюється:
2Р + 2,5О2 = Р2О5 + 1150 кДж.
Внаслідок цієї реакції він швидко самонагрівається та займається. Для ізоляції білого фосфору від повітря його зберігають під шаром води, з якою він не реагує.
Червоний і чорний фосфор значно менш активні, ніж білий фосфор.
Найбільш поширені ступені окиснення фосфору –3; +3; +5, причому з них найбільш стійка +5. Ступінь окиснення –3 фосфор проявляє в сполуках з металами (фосфідах) та гідрогеном (РН3 – фосфін). Фосфіди утворюються при взаємодії металів з фосфором:
2Р + 3Са = Са3Р2.
Фосфіди при взаємодії з водою або кислотами дають фосфін:
Са3Р2.+ 6НСl = 2PH3+ 3СаСl2 , K3P + 3H2O = 3KOH + PH3 .
З оксигеном фосфор утворює два оксиди – Р2О3 і Р2О5. При взаємодії з водою вони утворюють, відповідно, фосфітну (Н3РО3) і ортофосфатну (фосфатну) кислоти (Н3РО4):
Р2О3+ 3H2O = 2Н3РО3 , Р2О5 + 3H2O =2Н3РО4.
У водних розчинах фосфатна кислота є кислотою середньої сили (за першим ступенем). Солі фосфатної кислоти (фосфати) у великих кількостях використовуються як добрива. Гідрогенфосфати амонію використовуються як компоненти порошкових засобів пожежогасіння (П-1А, ПФ), вони, крім інгібіруючої дії на полум’я, гальмують процес горіння, завдяки утворенню на поверхні, що горить, ізолюючої плівки розплаву.
Хімічні властивості Карбону та Силіцію
Карбон і Силіцій відносяться до головної підгрупи четвертої групи періодичної системи елементів. Більшість сполук карбону вивчаються в розділі “Органічна хімія”, до неорганічних сполук традиційно відносять оксиди Карбону (СО – чадний газ, СО2 - вуглекислий газ), карбонатну (вугільну) кислоту та її солі, а також сполуки карбону з металами – карбіди. Відомі також неорганічні сполуки вуглецю – карбоніли.
Карбон утворює декілька алотропних модифікацій: алмаз, графіт, карбін і полікумулен, з яких найбільш поширеною є графіт. Часто зустрічається також аморфний вуглець. Вуглець за звичайних умов – малоактивна речовина, але його активність значно підвищується із зростанням температури. З різних модифікацій Карбону найактивнішою є аморфна, менш активним є графіт і ще менш активним – алмаз.
При спалюванні вугілля, основною складовою частиною якого є карбон, відбувається реакція:
С+ О2 = СО2.
Вуглець також безпосередньо реагує із флуором і при сильному нагріванні за присутності каталізатора з воднем:
С + 2F2 = СF4 , С + 2H2 = СH4.
Ступінь окиснення Карбону в його сполуках буває: –4, +2, +4. Карбон в неорганічних сполуках може знаходитися в таких станах гібридизації: sp, sp2, sp3, яким відповідає координаційне число, відповідно, 2, 3, 4.
Оксид Карбону (ІІ) (чадний газ) – безбарвний газ без запаху, дуже отруйний. Він може утворюватися під час пожежі в умовах недостатньої кількості кисню. Чадний газ не поглинається у звичайних протигазах, що викликає потребу використовувати ізолюючі протигази. СО – за підвищених температур сильний відновник, що використовується в металургійних процесах:
Fe2O3 + 3CO = 2Fe + 3CO2 .
Оксид карбону (ІV) (вуглекислий газ) – безбарвний газ із слабким кислуватим запахом, не підтримує горіння та дихання. Велика кількість вуглекислого газу небезпечна для людського організму: вже через наявність 7% СО2 у повітрі людина непритомніє, а за наявності 20% СО2 наступає параліч органів дихання. Вуглекислий газ є більш ефективним флегматизатором, ніж азот і аргон, тому його використовують як газовий засіб пожежогасіння у вогнегасниках типу ВВ (російська абревіатура ОУ). В цих вогнегасниках СО2 під тиском 5-20 МПа переходить в рідкий стан. Під час роботи вогнегасника вуглекислий газ, що виходить під тиском з вогнегасника, завдяки інтенсивному випаровуванню та розширенню, охолоджується і частково переходить у твердий стан (сухий лід). Він припиняє доступ повітря до осередку загоряння і одночасно охолоджує його, це приводить до припинення процесу горіння. Але найбільш активні метали можуть горіти у вуглекислому газі:
2Mg + CO2 = 2MgO + C.
Тому СО2 не можна використовувати для гасіння таких металів.
При взаємодії СО2 з водою утворюється слабка і нестійка двохосновна карбонатна (вугільна) кислота - Н2СО3. Солі карбонатної кислоти – карбонати – в більшості не розчинені у воді (крім солей лужних металів та амонію). Нерозчинені у воді карбонати при нагріванні розкладаються на вуглекислий газ та оксид металу:
СаСО3 = СаО + СО2.
Ця реакція використовується для добування негашеного вапна (СаО). При взаємодії його з водою (процес гасіння) одержують гашене вапно:
СаО + Н2О = Са(ОН)2 .
Дрібний гідрокарбонат натрію є основою вогнегасного порошку - ПСБ-3. Водний розчин NaНCO3 є основою лужної складової в хімічно-пінних вогнегасниках. Кислотна складова хімічно-пінних вогнегасників складається з сульфатної кислоти або її суміші з сульфатом феруму. При роботі таких вогнегасників використовується газоутворююча реакція:
2NaНCO3 + H2SO4 = Na2SO4 + H2O + CO2.
З металами Карбон утворює карбіди, які утворюються при сильному нагріванні вуглецю з металами або оксидами металів:
СаО +3С = СО + СаС2 , 4Аl + 3C = Al4C3.
Під час взаємодії карбідів з водою утворюються відповідні гідроксиди і вуглеводні:
СаС2+ Н2О = Са(ОН)2 + С2Н2, Al4C3 + 12Н2О=4Аl(ОН)3 +3СН4.
Виділення горючих газів при взаємодії з водою робить карбіди пожежонебезпечними. Крім того, при гасінні карбідів не можна використовувати воду. При взаємодії карбідів активних металів з водою вуглеводні, що виділяються, можуть займатися за звичайних умов.
Силіцій є другим за поширеністю елементом земної кори (26,7%). Основними ступінями окиснення Силіцію є +4 і –4. Ступінь окиснення –4 Силіцій має у сполуках з металами (силіциди) та гідрогеном (силани). Силіциди утворюються за високих температур при взаємодії простих речовин або оксидів металів з кремнієм:
2Mg + Si = Mg2Si.
При взаємодії силіцидів з водою та кислотами утворюється суміш силанів (SinH2n+2), основним серед яких є моносилан - SiH4:
Mg2Si + 4HCl = 2MgCl2 + SiH4.
Силан при контакті з повітрям і водою самозаймається:
SiH4 + 2О2 = SiО2 + 2Н2О, SiH4 + 2Н2О = SiО2 + 4Н2.
Тому силани є пожежонебезпечними речовинами, які не можна гасити засобами, до складу яких входить вода.
З киснем Силіцій утворює оксид SiО2, який є найбільш стійкою сполукою Силіцію. Кристали диоксиду Силіцію зустрічаються у природі у вигляді мінералу кварцу. Звичайний пісок – це дрібний SiО2 з невеликою кількістю домішок. Пісок широко застосовується в будівництві, для виготовлення скла, цементу, кераміки. Пісок з давніх часів використовується як простіший засіб пожежогасіння. Диоксид Силіцію не реагує з кислотами, крім фторидної (плавикової):
SiО2 + 6НF = H2SiF6 + 2H2O.
За кімнатної температури SiО2 повільно реагує з лугами, у разі нагрівання швидкість реакції збільшується:
SiО2 +2NaOH = Na2SiO3 +H2O.
Ця реакція показує, що SiО2 – кислотний оксид. Диоксид кремнію з водою не реагує, тому кислоту, яка відповідає цьому оксиду одержують з солей силікатної кислоти – силікатів:
Na2SiO3 + H2SO4 = H2SiO3¯ + Na2SO4 .
Приклад 43.
Записати рівняння реакцій за допомогою яких можна здійснити такі перетворення:
HCl®H2®KH®KOH® KCl.
Для кожної речовини дати назву, вказати до якого класу неорганічних речовин відноситься кожна сполука.. Для окисно-відновних реакцій написати електроні рівняння, для іонообмінних – іонні рівняння.
Розв'язання.
1. 2HCl + Zn = ZnCl2 + H2,

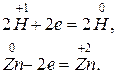
2. H2 +2 K = 2KH,
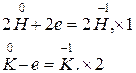
3. KH + H2O = KOH + H2.
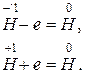
4. KOH + HCl = KCl + H2O,
K+ +OH– + H++Cl– = K++Cl– + H2O, Н+ + OH– = H2O.
Назви речовин та класи сполук: HCl – хлоридна кислота, H2 – водень, неметал, KH – гідрид калію, KOH – гідроксид калію.
Запитання для самоконтролю
1. Як змінюються неметалічні властивості в групах і періодах періодичної системи елементів?
2. Які неметали найбільш поширені у земній корі?
3. Яке значення має озон для життя на землі?
4. Які елементи не можуть проявляти додатні ступені окиснення?
5. В контакті з яким металом горить вода?
6. Який склад має повітря? Яка складова частина повітря підтримує горіння?
7. Яка кислота легко реагує зі склом?
8. В чому різниця в дії концентрованої та розведеної сульфатної кислоти на метали?
9. Що таке гідриди металів? Чи можна для їх гасіння використовувати воду?
10. Що таке гіпс? Де він застосовується? Як впливає підвищена температура на влàстивості гіпсу?
11. Які сполуки утворює азот з воднем та киснем? Чи можуть вони бути причиною пожежі?
12. Що таке нітриди?
13. Що таке піротехнічні генератори аерозолів?
14. Які вам відомі будівельні матеріали на основі сполук кремнію?
15. Що таке карбіди металів? Як вони реагують з водою?
16. В чому різниця в дії на людину вуглекислого та чадного газу?
РОЗДІЛ 6. ХІМІЯ ОРГАНІЧНИХ СПОЛУК
Тема 15. Теорія хімічної будови
Органічна хімія - наука, що вивчає сполуки карбону (вуглецю) з іншими елементами.
Основні положення теорії хімічної будови органічних сполук:
1. Атоми розташовані в молекулах у певній послідовності, відповідно до їх валентності. Валентність карбону в органічних сполуках дорівнює 4.
2. Властивості речовин залежать не тільки від їх якісного і кількісного складу, але й від хімічної будови молекул.
3. Атоми або групи атомів у молекулах впливають один на одного безпосередньо або через інші атоми.
Класифікація органічних сполук.
Ациклічні - складаються з відкритих (незамкнених) вуглецевих ланцюгів, прямих або розгалужених.
Циклічні - сполуки, які містять замкнені у кільця вуглецеві ланцюги.
Сполуки з простими зв'язками (С-С) є насиченими, а з кратними (С=С; СºС) - ненасиченими.
Функціональними називають групи атомів, що надають речовинам певних хімічних властивостей.
Гомологічним рядом називається послідовність подібних за своєю будовою та хімічними властивостями речовин, що відрізняються одна від одної за складом на одну або кілька груп атомів (CH2). Така група атомів називається гомологічною різницею.
Таблиця 2. Класи органічних сполук
| Клас сполук | Функціональна група | ||
| Назва | Загальна формула | Назва | Формула |
| Вуглеводні | R-H | – | – |
| Галогенопохідні вуглеводнів | R-Hal | Галогени | –F,–Cl, –Br,–I |
| Спирти | R-OH | Гідроксигрупа | –ОН |
| Альдегіди | R–C=O ½ H | Альдегідна | –С=O ½ H |
| Кетони | R1–C=O ½ R2 | Карбонільна | –C=O ½ |
| Карбонові кислоти | R–C=O ½ O–H | Карбоксильна | –C=O ½ O–H |
Продовження таблиці 2
| Клас сполук | Функціональна група | ||
| Нітросполуки | R–NO2 | Hітрогрупа | –NO2 |
| Аміни | R–NH2 | Аміногрупа | –NH2 |
Номенклатура IUPAC (міжнародна).
В її основу покладено назви насичених вуглеводнів. Клас сполук позначається функціональним закінченням. Назви ізомерних сполук утворюються таким чином:
а) обирають найдовший нерозгалужений вуглецевий ланцюг (головний), що містить найбільше число функціональних груп або кратний зв'язок, характерний для даного гомологічного ряду;
б) вуглеводневі радикали і функціональні групи, які знаходяться в бічному ланцюзі, розглядаються як замісники атомів водню головного ланцюга;
в) ланцюг нумерують, починаючи з того кінця, до якого ближче функціональна група або кратний зв'язок головного ланцюга, замісник у бічному ланцюзі;
г) називають насичений вуглеводень, що відповідає головному ланцюгу, і змінюють або додають закінчення залежно від наявності кратного зв'язку або функціональної групи в головному ланцюзі; положення кратного зв'язку і функціональної групи головного ланцюга позначають цифрою після кореня слова – назви;
д) положення замісників у бічному ланцюзі позначають номером вуглецевого атома, біля якого знаходиться замісник. Номер з назвою замісника ставлять на початку назви речовини. Якщо замісників кілька, цифрами позначають кожний з них і розташовують їх назви в алфавітному порядку.
Таблиця 3. Назви та загальні формули органічних сполук
| Гомологічний ряд | Загальна формула | Закінчення або префікс | Приклад |
| Алкани (насичені вуглеводні) | СnH2n+2 | ан | С2Н6 –етан |
| Циклоалкани | СnН2n | циклоалкан | С6Н12–циклогексан |
| Алкени (етиленові вуглеводні) | СnН2n | ен | С4Н8 – бутен |
| Дієнові вуглеводні | СnH2n–2 | дієн | С4Н6 – бутадієн |
| Алкіни (ацетиленові вуглеводні) | СnH2n-2 | ін або ин | С2Н2 –етин, С3Н4 – пропін |
| Ароматичні вуглеводні | С6Н5–R | бензол | С6Н5–СН3 – метил-бензол |
Продовження таблиці 3
| Гомологічний ряд | Загальна формула | Закінчення або префікс | Приклад |
| Спирти | R–OH | ол | СН3–ОН– метанол |
| Спирти двоатомні | 2–ОН | діол | СН2ОН–СН2ОН –етандіол-1,2 |
| Феноли | R–C6H4OH | фенол | СН3–С6Н4–ОН – метилфенол |
| Альдегіди | R–C=О ½ Н | аль | Н–С=О метаналь ½ Н |
| Кетони | R1–C=O ½ R2 | он | СН3–С=O ½ CH3 пропанон-2 |
| Карбонові кислоти | R–C=O ½ O–H | кислота | СН3СООН – етанова кислота |
| Прості ефіри | R1–O–R2 | ефір | СН3–О–СН3 диметиловий ефір |
| Складні ефіри | R1–C=O ½ OR2 | ефір | Н–С=О ï O–С2H5 етиловий ефір мурашиної кислоти |
| Нітросполуки | R–NO2 | нітро | СН3NO2 нітрометан |
| Аміни | R–NH2 | амін | С2Н5–NH2 етиламін |
Дата добавления: 2015-03-07; просмотров: 1428;
