Тема 8. Розчини 5 страница
Приклад 44.
Запишіть структурні формули і надайте назви ізомерам вуглеводню, формула якого С4H8. До якого класу органічних сполук відноситься цей вуглеводень?
Розв'язання.
Цей вуглеводень відноситься або до гомологічного ряду етиленових вуглеводнів або до циклоалканів (загальні формули CnH2n). Можливі наступні ізомери з формулою C4H8.
CH2=CH–CH2–CH3 – бутен-1;
CH2=C–CH3 – 2-метил-пропен;
ê
CH3
CH3–CH=CH–CH3 – бутен-2;
CH2–CH2 – циклобутан;
ê ê
CH2–CH2
CH2–CH–CH3 – метил-циклопропан;
½ /
CH2
Бутен-2 може існувати в двох просторових ізомерних формах:
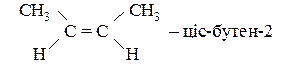
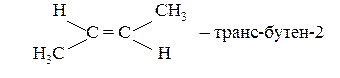
Запитання для самоконтролю
1. Сформулюйте основні положення теорії хімічної будови органічних сполук.
2. Що таке хімічна будова?
3. Що таке ізомерія?
4. Яку валентність проявляє карбон в органічних сполуках?
5. Які групи атомів називають функціональними групами?
6. Які типи гібридизації може мати карбон в органічних сполуках?
7. Що таке гомологічний ряд?
8. Сформулюйте основні положення міжнародної номенклатури для органічних сполук?
9. Які типи хімічного зв'язку існують в органічних сполуках?
10. Що таке вільні радикали?
11. Які є класи органічних сполук?
Тема 16. Вуглеводні
Алкани (насичені вуглеводні). Хімічні властивості алканів
Вуглеводні – це найпростіші органічні сполуки. Їх молекули містять лише атоми карбону та гідрогену. Вуглеводні різняться кількістю атомів карбону, їх гібридизацією та послідовністю їх зв’язку.
Вуглеводні, що мають відкритий ланцюг і містять тільки одинарні, прості зв’язки, звуться насиченими вуглеводнями або парафінами,за номенклатурою ІЮПАК – алканами.Найпростіший вуглеводень – метан (CH4). Загальна формула алканів – CnH2n+2. Алкани нерозгалуженої будови звуться нормальними.Якщо розмістити алкани нормальної будови в ряд, в якому молекула кожного наступного алкану збільшується на одну групу–СН2–, то отримаємо ряд, що зветься гомологічним.
СН4 - метан СН3-(СН2)4-СН3 - гексан
СН3-СН3 - етан СН3-(СН2)5-СН3 - гептан
СН3-СН2-СН3 - пропан СН3-(СН2)6-СН3 - октан
СН3-СН2-СН2-СН3 - бутан СН3-(СН2)7-СН3 - нонан
СН3-СН2-СН2-СН2-СН3 - пентан СН3-(СН2)8-СН3 – декан
Група– СН2 –зветься гомологічною різницею,а окремі члени гомологічного ряду - гомологами.
Існують також вуглеводні з розгалуженим вуглецевим ланцюгом:
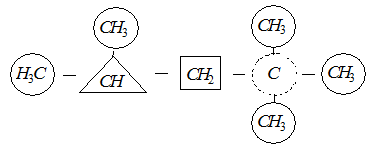
Атоми карбону в молекулах органічних сполук поділяються на первинні, вторинні, третинні й четвертинні атоми карбону. Атом карбону, що безпосередньо сполучений тільки з одним сусіднім атомом карбону, зветься первинним; атом вуглецю, що сполучений з двома сусідніми атомами карбону, – вторинним. Якщо атом карбону безпосередньо сполучений з трьома або чотирма атомами карбону, то такий атом карбону відповідно називають третиннимабо четвертинним.
Якщо відірвати від молекули алкану один атом гідрогену, то утворюється залишок R - , що зветься одновалентним радикаломабо алкільною групою. Назва радикалу утворюється за допомогою назви відповідного алкану заміною закінчення –анна закінчення –ил(іл)
Н3С - Н3С-СН2 - Н3С-СН2 – СН2 -
метил етил пропіл
Алкани, їх хімічні властивості.
Для алканів характерні реакції заміщення.
 Н3С – СН3 + nF2 ® mCF4 + 6НF + xC.
Н3С – СН3 + nF2 ® mCF4 + 6НF + xC.
При хлоруванні атоми гідрогену алканів поступово замінюються на хлор з утворенням різноманітних хлорпохідних алканів:
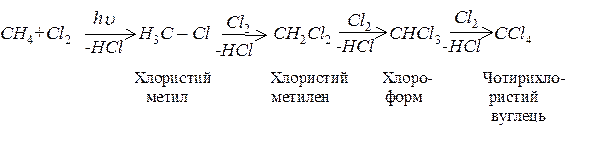
За звичайної температури насичені вуглеводні не окислюються киснем повітря і такими окисниками, як KMnO4, K2Cr2O7, але при підвищенні температури до 1500С і за наявності каталізаторів вони окислюються з утворенням різних сполук, що містять кисень.
При горінні всіх вуглеводнів утворюються диоксид вуглеводню і вода:
СnH2n+2 + O2 ® nCO2 + (n+1)H2О.
У алканів зі збільшенням кількості атомів карбону знижується температура самозаймання, а також нижня та верхня межі розповсюдження полум’я. Лінійні алкани (нерозгалужені) мають більшу схильність до детонаційного горіння, ніж розгалужені алкани. Так, добре відомо, що октанове число розгалужених алканів вище, ніж нерозгалужених. Полум’я при горінні алканів слабко світиться.
У промисловості головним джерелом добування алканів є нафта й природний газ. Природний газ містить тільки легкі алкани, тобто алкани з низькою молекулярною вагою, й, головним чином, метан з невеликою домішкою етану, пропану і т.д.
За допомогою фракційної перегонки нафту поділяють на фракції, що відрізняються леткістю. Нелеткі фракції використовують як паливо. Газова фракція разом із природним газом, головним чином, використовується як пальне. Бензин (С6 – С10, tкип. 40-2050С) використовують у двигунах внутрішнього згорання, гас (С12-С18, tкип. 175-3250С) – у тракторах, а солярове масло (С12 і вище, tкип. вище 2750С) – у дизельних двигунах. Кожен з нижчих алканів (від метану до пентану) можна добути в чистому вигляді шляхом фракційної перегонки нафти або природного газу.
Приклад 45.
Напишіть приклади реакцій заміщення пропана які відбуваються при його взаємодії з Cl2, Br2 i HNO3.
Розв‘язання.
Для алканів характерні реакції заміщення атомів карбону, які відбуваються за радикальним механізмом. Умови ініціювання таких реакцій є опромінювання світлом, великі температура і тиск.
а) хлорування:
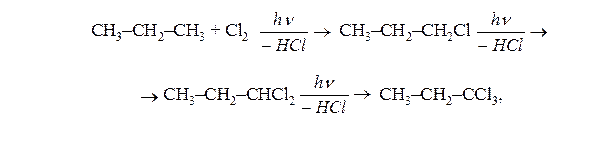 б) бромування алканів відбувається при більш жорстких умовах, бром заміщує гідроген переважно у середині молекули:
б) бромування алканів відбувається при більш жорстких умовах, бром заміщує гідроген переважно у середині молекули:
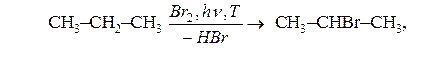
в) нітрування:
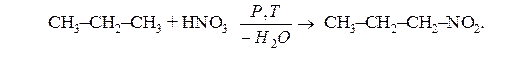
Алкени. Хімічні властивості
Ненасичені вуглеводні – це сполуки, що містять подвійні або потрійні (кратні) карбон - карбонові зв’язки. Ненасичені сполуки з подвійним зв’язком загальної формули CnH2n звуться алкенами або олефінами, вони утворюють гомологічний ряд, подібний гомологічному ряду алканів. За номенклатурою ІUРАС назви алкенів утворюють заміною закінчення -ан назви відповідного алкану на закінчення –ен, наприклад, пропан ® пропен. Крім того, широко використовують тривіальну номенклатуру, за правилами якої назви олефінів утворюють заміною закінчення –ан назви відповідного алкану на закінчення
–илен, наприклад, етан ® етилен.
Алкенам властиві всі типи ізомерії: ізомерія вуглецевого ланцюга (структурна), ізомерія розміщення замісника або подвійного зв’язку (позиційна), цис-, транс – ізомерія (геометрична).
Атом карбону в етилені утворює три s- зв’язки з використанням трьох sp2 – гібридних орбіталей і один p - зв’язок за рахунок перекривання р – орбіталей (рис.10.)
Алкени є більш реакційноздатними за алкани, тому що p - зв’язок слабкіший за s - зв’язок та електрони подвійного зв’язку С=С більш доступні для атаки реагентів, ніж електрони одинарного зв’язку. Тому для етиленових сполук характерні реакції приєднання, реакційним центром у яких є p - зв’язок.
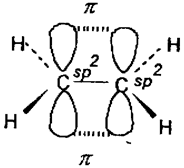
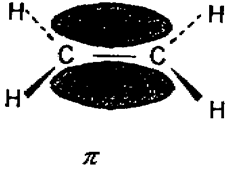
Рис.10. Схема утворення зв’язків в молекулі етилену
Приєднання водню до ненасичених сполук називають гідруванням:
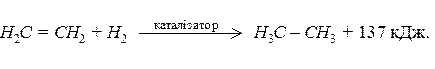
Алкени легко приєднують галогени з утворенням дигалогеналканів:
Н2С = СН2 + Сl2 ––® Сl - СН2 - СН2 - Сl.
Реакційна здатність галогенів різко зменшується в ряду F2>Cl2>Br2>І2.
Реакція з бромом проходить з обезбарвленням розчину бромної води і є якісною реакцією на подвійний зв’язок:
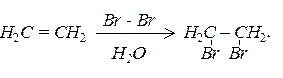
Алкени реагують з галогеноводнями:
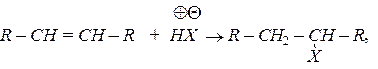
де X = Cl, Br, I, F.
У випадку несиметричних алкенів приєднання полярних молекул відбувається згідно з правилом Марковникова,  протон приєднується до найбільш гідрогенізованого вуглецевого атома, наприклад:
протон приєднується до найбільш гідрогенізованого вуглецевого атома, наприклад:
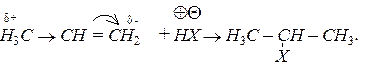
Алкени легко окислюються водним розчином перманганату калію:
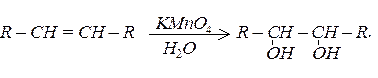
При горінні алкенів, також як і алканів, утворюється вуглекислий газ і вода. У алкенів, подібно до алканів, зі збільшенням числа атомів карбону знижуються температура самозаймання, верхня та нижня межі розповсюдження полум’я.
Характерною особливістю багатьох ненасичених сполук є їх здатність вступати в реакцію полімеризації і утворювати полімери:
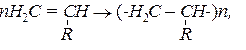
де n – ступінь полімеризації, який може мати значення до кількох сотень тисяч одиниць.
Приклад 46.
Напишіть рівняння реакцій взаємодії пропену з Cl2, H2 i HCl. Дати назву отриманим сполукам.
Розв’язання.
Реакції приєднання відбуваються за подвійним зв’язком:
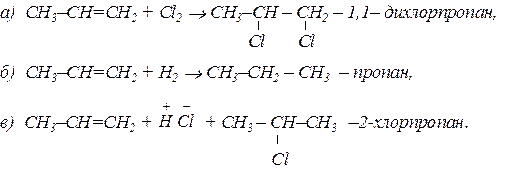
Реакція (в) відбувається за правилом Марковникова. Позитивно заряджена частина полярної молекули приєднується до найбільш гідрогенізованого атома карбону, а негативно заряджена – до найменш гідрогенизованого атома карбону, які утворили кратний зв’язок.
Алкіни. Хімічні властивості
Алкіни – це вуглеводні, що містять потрійний зв’язок СºС і мають загальну формулу CnH2n-2. Алкіни утворюють гомологічний ряд, який починається з ацетилену, а інші члени гомологічного ряду, як і члени рядів алканів і алкенів, відрізняються між собою на гомологічну різницю СН2 . За номенклатурою ІUРАС назви алкінів утворюються заміною в назві відповідного алкану суфіксу – ан на суфікс –ин(ін).
Ізомерія алканів зумовлена будовою вуглецевого ланцюга і розміщення потрійного зв’язку.
Хімічні властивості ацетиленових вуглеводнів зумовлені наявністю в їх молекулах потрійного зв’язку, який складається з одного s - зв’язку (утвореного двома sp – гібридизованими орбіталями вуглецевих атомів) і двох p - зв’язків (утворених вільними р – орбіталями), що орієнтовані у просторі у взаємно перпендикулярних площинах (рис.11):
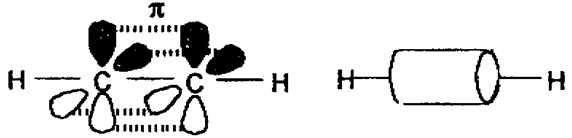
Рис.11. Схема утворення хімічних зв’язків в молекулі ацетилену
Молекула ацетилену є лінійною, всі чотири атоми розміщені на одній прямій. Обидві sp – гібридизовані орбіталі атома вуглецю скеровані під кутом 1800. p – електронна густина потрійного зв’язку має циліндричну симетрію відносно лінії сполучення ядер чотирьох атомів. На відміну від подвійного зв’язку, p – електронна густина потрійного зв’язку важче піддається поляризації, оскільки довжина потрійного зв’язку менша, ніж довжина подвійного зв’язку:
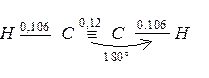
а електронегативність sp – гібридизованого атома гідрогену вища порівняно з sp2 – гібридизованим С – атомом. Тому, незважаючи на більшу ненасиченість, ацетиленові вуглеводні важче приєднують електрофільні реагенти, ніж етиленові вуглеводні. Для алкінів характерні реакції приєднання і, крім того, вони здатні заміщувати атом водню біля вуглецевого атома з потрійним зв’язком, тому що алкіни мають слабкі кислотні властивості:
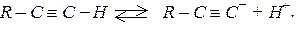
Реакції приєднання
Гідрування:
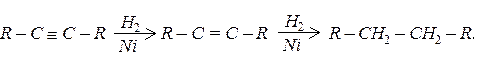
Приєднання гідрогалогенів:
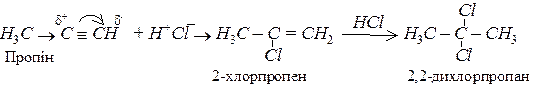
Приєднання відбувається за правилом Марковникова.
Галогенування
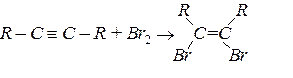
Приєднання нуклеофільних реагентів (Н2О, R – ОН, R СООН, НСN):
а) реакція Кучерова (гідратація). Приєднання води ацетиленових сполук теж відбувається в дві стадії. Спочатку утворюється нестійкий енол, який відразу ж ізомерізується в карбонільну сполуку:
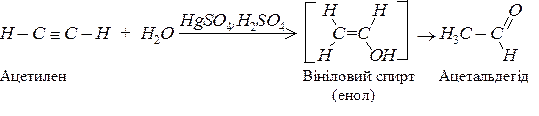
Приєднання води відбувається за правилом Марковникова:
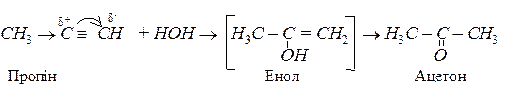
Реакції заміщення
а) утворення ацетиленідів:
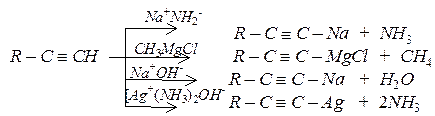
б) галогенування:
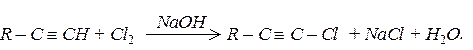
Дата добавления: 2015-03-07; просмотров: 1125;
