Тема 8. Розчини
Типи розчинів. Способи вираження складу розчинів. Молярна концентрація. Розчинність речовин. Розчини електролітів та неелектролітів. Сильні та слабкі електроліти. Ступінь і константа дисоціації. Закони Рауля. Тиск насиченої пари. Замерзання та кипіння розчинів. Закипання і викид речовин при горінні. Осмотичний тиск. Вода, її властивості як розчинника. Електролітична дисоціація води. Водневий показник середовища. Значення води у пожежогасінні. Іонні реакції в розчинах. Добуток розчинності. Гідроліз солей. Теорії кислот та основ.
Тема 9. Колоїдні системи
Колоїдні системи. Добування колоїдних систем, їх класифікація. Стійкість колоїдних систем. Поверхнева енергія. Адсорбція. Поверхнево-активні речовини. Аерозолі, пили, їх пожежна небезпечність. Піни, їх утворення та стійкість. Значення пін у пожежогасінні. Емульсії та суспензії. Порошкові засоби пожежогасіння. Піротехнічні генератори вогнегасних аерозолів.
РОЗДІЛ 4. ОСНОВИ ЕЛЕКТРОХІМІЇ
Тема 10. Окисно-відновні процеси
Ступінь окиснення. Класифікація окисно-відновних процесів. Складання рівнянь окисно-відновних реакцій. Метод електронного балансу. Основні відновники і окисники. Реакція горіння як окисно-відновний процес. Пожежна небезпека окисників та відновників.
Тема 11. Електрохімічні процеси
Електродні потенціали та ЕРС. Рівняння Нернста. Стандартний водневий електрод і воднева шкала потенціалів. Ряд стандартних електродних потенціалів. Гальванічні елементи, акумулятори та паливні елементи, їх застосування. Автономні джерела живлення в пожежній техніці.
Електроліз. Послідовність електродних процесів. Закони Фарадея. Практичне застосування електролізу. Електрична дуга та іскра як джерела запалювання.
Тема 12. Корозія та захист металів та сплавів
Основні типи корозії. Хімічна корозія. Вплив високих температур на корозію металів та стійкість металевих конструкцій. Захисні властивості поверхневих плівок. Електрохімічна корозія, утворення гальванопар. Методи захисту від корозії: легування, електрохімічний захист, захисні покриття. Застосування захисних покриттів для підвищення вогнестійкості металевих конструкцій. Інгібітори корозії. Вплив вогнегасних речовин на корозію металів.
РОЗДІЛ 5. ХІМІЯ ЕЛЕМЕНТІВ ТА ЇХ СПОЛУК
Тема 13. Хімія металів та їх сполук
Класифікація і номенклатура основних класів неорганічних речовин.
Основні методи одержання металів. Залежність властивостей металів від їх положення у періодичній системі. Лужні та лужноземельні метали, їх пожежна небезпечність. Сполуки кальцію в будівництві. Калійні добрива.
Легкі конструкційні метали (магній, алюміній, берилій, титан). Застосування алюмінію в будівництві.
Залізо — основний конструкційний метал, його хімічні властивості та застосування. Метали в сучасній техніці та будівництві. Вогнеміцність та вогнестійкість металічних конструкцій. Горіння металів. Особливості гасіння металів.
Тема 14. Хімія неметалічних елементів та їх сполук
Залежність властивостей неметалів від їх положення у періодичній системі. Повітря, його склад, участь у горінні. Хімічні властивості кисню та сполук оксигену. Роль кисню у процесах горіння. Газові засоби пожежогасіння.
Гідроген. Хімічні властивості. Гідриди металів, їх взаємодія з водою. Вода, її хімічні властивості та застосування у пожежогасінні. Самозаймання речовин при контакті з водою.
Флуор і хлор. Горіння речовин у хлорі та флуорі.
Сульфур, сполуки сульфуру з оксигеном і гідрогеном. Сульфатна кислота та її солі. Гіпсові в'яжучі матеріали. Пожежонебезпека сполук сульфуру.
Нітроген, його властивості. Сполуки нітрогену з гідрогеном і оксигеном. Нітратна кислота та її солі. Азотні добрива. Пожежо- та вибухонебезпека сполук нітрогену.
Фосфор, його горіння. Сполуки фосфору. Фосфатна кислота та фосфати. Фосфорні добрива. Поняття про антипірени.
Силіцій та його сполуки: оксид, силікатна кислота, силікати, силани.
Скло. Цемент і бетон. Кераміка. Вплив підвищених температур на будівельні конструкції на основі силікатів.
Карбон та його алотропні форми. Горіння вуглецю. Оксиди карбону, карбонатна кислота, карбонати та гідрокарбонати, їх застосування у пожежній справі. Карбіди металів, їх взаємодія з водою.
РОЗДІЛ 6. ХІМІЯ ОРГАНІЧНИХ СПОЛУК
Тема 15. Теорія хімічної будови
Основні положення теорії хімічної будови О.М. Бутлерова. Класифікація та номенклатура органічних сполук. Ізомери. Електронна природа хімічних зв'язків у молекулах органічних сполук. Механізми хімічних реакцій, способи розриву зв'язків, поняття про вільні радикали. Пожежна небезпечність органічних речовин.
Тема 16. Вуглеводні
Гомологічний ряд насичених вуглеводнів (алканів), їх фізичні та хімічні властивості. Горіння алканів. Насичені вуглеводні в природі, застосування в техніці. Вуглеводні як палива. Детонація палив. Залежність температури самоспалахування від будови та довжини вуглецевого ланцюга.
Ненасичені вуглеводні етиленового та ацетиленового ряду, їх будова та властивості. Добування та застосування ненасичених вуглеводнів.
Ароматичні вуглеводні, особливості їх електронної будови та їх властивості. Бензол, толуол.
Природні джерела вуглеводнів: нафта, природний та супутні гази, вугілля. Перегонка нафти. Крекінг нафтопродуктів. Пожежо- та вибухонебезпека вуглеводнів.
Галогенпохідні вуглеводнів. Їх фізичні та хімічні властивості. Хладони, їх застосування у пожежній справі. Екологічна небезпечність хладонів.
Тема 17. Оксигеновмісні органічні сполуки
Спирти, їх будова, номенклатура. Хімічні властивості одноатомних та багатоатомних спиртів. Застосування спиртів як палив.
Альдегіди та кетони, їх будова, хімічні властивості та застосування. Пожежонебезпечність альдегідів і кетонів.
Карбонові кислоти: будова, фізичні та хімічні властивості. Метанова та етанова кислоти, стеаринова, пальмітинова, олеїнова кислоти та їх солі. Мило.
Складні та прості ефіри. Жири як представники складних ефірів, їх здатність до окиснення, полімеризації та самозаймання. Пожежо- та вибухонебезпечність ефірів.
Вуглеводи. Глюкоза, фруктоза та сахароза. Полісахариди: крохмаль, целюлоза. Термічний розклад і горіння целюлози та деревини.
Tема18. Нітрогеновмісні та елементоорганічні сполуки
Нітрогеновмісні органічні сполуки. Нітросполуки та аміни, їх пожежо та вибухонебезпечність. Амінокислоти та білки — основа життя.
Елементоорганічні cполуки – їх фізичні та хімічні властивості: силіційорганічні, металоорганічні, фосфорорганічні речовини, їх пожежонебезпечність і токсичність.
Поняття про отруйні речовини.
Тема 19. Полімерні матеріали
Поняття про полімери. Неорганічні полімери. Органічні полімери. Біополімери. Природні та штучні полімери. Реакції полімеризації та поліконденсації. Методи одержання полімерів.
Пластичні маси, синтетичні волокна, композиційні матеріали. Основні представники полімерів. Поліетилен, поліпропілен, полівінілхлорид, полістирол, поліметилметакрилат. Синтетичний та природний каучуки. Гума. Зв'язок складу та будови з властивостями полімерів. Термодеструкція та горіння полімерів і пластичних мас. Методи зниження горючості полімерних матеріалів. Токсичність продуктів піролізу та горіння полімерних матеріалів.
РОЗДІЛ 7.Тема 20. ХІМІЯ ТА ОХОРОНА НАВКОЛИШНЬОГО
СЕРЕДОВИЩА
Роль хімії в розв'язанні екологічних проблем. Склад і властивості палив. Тверді, рідкі та газоподібні палива. Продукти горіння та захист повітряного басейну від забруднень. Токсичність продуктів горіння. Проблема фреонів. Екологічні наслідки пожеж.
Захист водного басейну від забруднення. Літосфера та її забруднення. Токсичність вогнегасних речовин. Проблема радіоактивних відходів.
Література
Основна:
1. Кірєєв О.О., Тарасова Г.В. Конспект лекцій з хімії для курсантів 1 курсу АПБУ. Частина 1. Загальна хімія. Навчальний посібник. Харків, АПБУ, 2002.
2. Кірєєв О.О., Тарасова Г.В. Конспект лекцій з хімії. Частина 2. Навчальний посібник. Харків, АПБУ, 2003.
3. Романова Н.В. Загальна та неорганічна хімія. Київ, ”Перун”, 1998.-480с.
4. Хомченко Г.П. Загальна хімія. - Київ: Вища шк., 1993.- 424 с.
5. Курс общей химии / Под. ред. Н.В. Коровина. -М.:Высш. школа, 1981.- 482 с.
6. Глинка Н.Л. Общая химия. - Л.: Высш. школа, 1980.- 720 с.
7. Домбровский А.В.,Найдан В.М. Органічна хімія.- Київ: Вища шк., 1992.- 503с.
8. Міхедькіна О.Й., Бикова А.С., Мельнік І.І., Преждо В.В. Основи органічної хімії.- Харків.: НТУ “ХПІ”, 2000.- 339с.
9. Глинка Н.Л. Задачи и упражнения по общей химии.- Л.:Химия, 1980.- 280 с.
10. Лабораторный практикум по общей химии / Под. ред. А.А. Таперовой. - М: Высш. школа, 1979.- 336 с
11. Липатников В.Е., Скоробогатова В.А. Лабораторные работы по неорганической и органической химии.- М.: Высш. школа, 1981.-109 с.
12. Методичні вказівки з лабораторних робіт з хімії. Кірєєв О.О., Яковлева Т.П., Яковлева Р.А., Курова Т.І., Сухорукова Л.С., Снагощенко Л.П. Харків: ХІПБ. 1997.-48с.
Додаткова:
1. Карапетянц М.Х., Дракин С.И. Общая и неорганическая химия. - М.: Высш. школа, 1981.- 654 с.
2. Фролов В.В. Химия.- М.: Высш. школа, 1984.- 487 с.
3. Органическая химия/ Под ред. А.А. Петрова. - М.: Высш.школа, 1983.- 623 с.
4. Курс общей химии / Под ред. Н.В. Коровина. - М.: Высш. школа, 1981.- 483 с.
5. Гофман К.Ф., Гусев А.А. Охрана окружающей среды. - М.: Природа, 1980.- 302 с.
6. Общая химия. / Под ред. Е.М. Соколовской.- М.:Высш. школа, 1980.- 386 с.
7. В.П. Басов. Хімія у вправах і задачах.- К., УМК ВО, 1990. -128 с.
8. Курс химии. ч.1/ Под ред. Г.А. Дмитриева.- М.: Высш.школа, 1971.- 417 с.
9. Воюцкий С.С. Коллоидная химия.- М.: Химия, 1986.- 527 с.
10. Гофман К.Ф., Гусев А.А. Охрана окружающей среды. - М.: Природа, 1980.- 238 с.
11. Методичні вказівкі та завдання до самостійної роботи з хімії. Частина 1. Кіреев О.О., Яковлева Т.П., Яковлева Р.А.. Курова Т.І. Харків ХІПБ, 1999.-28с.
12. Методичні вказівкі та завдання до самостійної роботи з хімії. Частина 2. Кірєєв О.О., Тарасова Г.В., Яковлева Р.А.. Курова Т.І. Харків, АПБУ, 2002.-30с.
13. Яковлева Р.А. Пластмаси в будівництві та їх пожежна небезпека: Навч. посібник. Харків, “Каравела”, 2000.-156с.
ВСТУП. Тема 1. Основні поняття і закони хімії
Хімія – це наука про склад, будову, властивості та перетворення речовин. Хімічні перетворення називаються хімічними реакціями.
Основні закони хімії.
Закон збереження маси: загальна маса речовин, які вступають у хімічну реакцію, дорівнює загальній масі речовин, що утворюються внаслідок реакції.
Закон сталості складу: кожна чиста речовина молекулярної будови має сталий склад, що не залежить від місця та способу її добування. (Для речовин немолекулярної будови може не виконуватися).
Закон простих об’ємних співвідношень: співвідношення об’ємів газів, що вступають у реакцію або утворюються внаслідок неї, є співвідношенням простих цілих чисел.
Закон Авогадро: у рівних об'ємах різних газів за однакових умов міститься однакове число молекул.
Наслідок з закону Авогадро: однакови число молекул різних газів за однакових умов займає один і той самий об’єм.
До основних понять хімії відносяться: хімічний елемент, атом, молекула, проста речовина, складна речовина, алотропія, валентність, ступінь окиснення.
Хімічний елемент - це вид (набір) атомів, що характеризуються визначеною величиною заряду ядра (при цьому маса атомів може бути різною).
Атом - це найменша частинка хімічного елемента, яка є носієм його властивостей. З точки зору структури, атом - електронейтральна частинка, що складається з позитивно зарядженого ядра і негативно заряджених електронів.
Молекула - це найменша частинка речовини, що є носієм її хімічних властивостей. До складу молекули можуть входити атоми одного чи кількох хімічних елементів, з’єднанних між собою хімічними зв’язками.
Валентність – здатність атомів вступати в хімічний зв’язок з певною кількістю інших атомів.
Ступінь окислення – умовний заряд атома в молекулі, який розраховано в припущені, що сполука складається з йонів.
Прості речовини – складаються з атомів одного хімічного елемента (наприклад, О2 - кисень, Н2 - водень, Ar - аргон, Cl2 - хлор, Р - фосфор тощо).
Алотропія – явище існування хімічного елемента у вигляді декількох простих речовин (наприклад, О2 - кисень, О3 - озон; вуглець – алмаз і графіт).
Складні речовини - складаються з атомів різних хімічних елементів (H2O, CO2, NH3, C2H5OH).
Відносною молекулярною Мr (або атомною Аr) масою речовини називають відношення маси молекули (або атома) т0 даної речовини до 1/12 маси атома Карбону-12 т0(С);
Моль — це така кількість речовини, яка містить стільки молекул, атомів, йонів або інших структурних одиниць, скільки міститься атомів у 0,012 кг нукліда Карбону 12С.
Число структурних одиниць, що міститься в одному молі будь-якої речовини, називають числом Авогадро. Число Авогадро становить 6,02•1023.
Кількість речовини можна розрахувати за формулами:
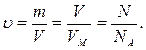
Крім відносної молекулярної маси Мr, у хімії та фізиці широко застосовують поняття “молярна маса ”.
Молярною масою (M) називають масу речовини, взятої в кількості один моль.
М=m/n
Моль будь-якого газу за нормальних умов займає об'єм 22,4 л. Цей об'єм називається молярним об 'ємом газу.
Рівняння Клапейрона – Менделєєва:
PV = (m/M)RT.
де Р – тиск, Па; V – обєм, м3; m – маса, г;M – молярна маса, г/моль; Т – температура, К; R – універсальна газова стала, що дорівнює 8,314 Дж/(моль К).
В деяких випадках зручно користуватися об'єднаним газовим законом:
PV/T = const ,або Р1V1/T1 = Р2V2/T2, або PV/T= P0V0/T0
де P0= 101,3 кПа; T0= 273 К.
Для фахівців з пожежної безпеки важливими є питання пов’язані зі знанням характеристик процесу горіння.
Горіння - це фізико-хімічний процес, для якого характерні три ознаки: хімічне перетворення, виділення тепла та випромінювання світла. Дві з них - це предмет вивчення хімії.
Приклад 1.
Визначити простішу формулу оксиду сірки, якщо відомо, що масова частка сірки в цьому оксиді складає 40%.
Розв’язання.
1.Візьмемо 100 г оксиду сірки. Маса сірки та кисню буде складати:
m(S) = m(оксиду) × w(S) = 100 × 0,4 = 40 г
m(О) = m(оксиду) × w(О) = 100 × 0,6 = 60 г
2. Розрахуємо відповідні кількості молей сірки та кисню:
n(S) = m(S)/M(S) = 40/32 = 1,25 моль,
n(О) = m(О)/M(О) = 60/16 = 3,75 моль.
3.Визначимо відношення кількості сірки та кисню.
n(S)/n(O) = 1,25/3,75; або в цілих числах:
n(S)/n(O) = 1:3.
Тобто простіша формула оксиду сірки SO3.
Приклад 2.
Обчислити молярну масу газу, якщо за нормальних умов маса 0,112 л цього газу дорівнює 0,22 г.
Розв'язання.
Згідно з рівнянням Клапейрона - Менделєєва:
P ´ V = (m/M) ´ R ´ T; M = m ´ R ´ T /(P ´ V),
де М - молярна маса, г/моль; m - маса газу, г; V - об'єм газу, ( м3 ); P - тиск, Па; T - температура, К.
M = 0.22´8.314´298/(101.3´103´0.12´10–3) = 44.0 г/моль.
Приклад 3.
Обчислити об'єм кисню, який потрібний для згоряння 1 кг бензолу, якщо температура 20° С, тиск 99992 Па.
Розв'язання.
1). Складаємо рівняння реакції горіння бензолу.
2C6H6 + 15O2 = 12CO2 + 6H2O
або в розрахунку на 1 моль бензолу:
C6H6 + 7,5 O2 = 6CO2 + 3 H2O
Згідно з рівнянням реакції, на один моль бензолу витрачається 7,5 молей кисню.
М(бензолу)=12´6+1´6=78 г/моль
78 г бензолу потребує 7,5 молей кисню
1000 г бензолу потребує n молей кисню
n = 1000 ´7,5/78 = 96,2 молей кисню
2). Об'єм кисню розрахуємо згідно з рівнянням Клапейрона - Менделєєва:
V = n´R´T/P = 96.2´8.314´293/99992 = 2,34 м3.
Приклад 4.
Природний магній складається з трьох нуклідів з нуклонними числами 24, 25 і 26, вміст яких складає 78,6%, 10,1% і 11,3% відповідно.
Визначити відносну атомну масу магнію.
Розв’язання.
Відносна атомна маса – це середнє значення атомних мас природної суміші ізотопів.
Нехай загальна кількість атомів магнію – N.Тоді нуклідів магнію з нуклонними числами 24, 25 і 26 буде відповідно: 0,786žN, 0,101žN і 0,113žN. Їх маси будуть складати: 0,786ž24žN, 0,101ž25žN і 0,113ž26žN. Середня маса дорівнює:
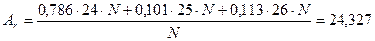
Приклад 5.
Виразити масу молекули води в грамах.
Розв’язання.
Молярна маса води дорівнює 18 г/моль. Відомо, що один моль будь якої речовини містить 6,02ž1023 молекул. Тоді маса однієї молекули води буде дорівнювати:
m(молекули) = М(Н2О) / 6,02ž1023 = 18 / 6,02ž1023 = 2,99 ž10 –23 г.
Запитання для самоконтролю
1. Що вивчає хімія? В чому суть хімічних перетворень?
2. Що таке атом, молекула, хімічний елемент?
3. Що таке молярна маса і молекулярна маса?
4. Що таке кількість речовини?
5. Що таке молярний об’єм? За яких умов він вимірюється?
6. Сформулюйте закон Авогадро. Які наслідки випливають з нього?
7. Для яких речовин справедливий закон сталості складу речовини?
8. Який процес називається процесом горіння?
Розділ 1. Будова речовини
Дата добавления: 2015-03-07; просмотров: 1244;
