Бадмаев Б.Ц. 12 страница
Проктогенные запоры встречаются при некоторых заболеваниях ано- ректальной области (геморрой, парапроктит, трещины анального отверстия). Боль, возникающая у таких пациентов при опорожнении кишечника, заставляет их подавлять позывы на дефекацию. Запор может наблюдаться также при интоксикации свинцом и ртутью, приеме ряда лекарственных препаратов (например, содержащих глюконат кальция или гидроокись алюминия), некоторых эндокринных заболеваниях (гипотиреоз).
Наконец, отдельную группу составляют запоры, связанные с органическими поражениями кишечника (долихосигма, мегаколон, опухоли, дивертикулы и стриктуры толстой кишки). Прогрессирование патологического процесса и увеличение механического препятствия для продвижения каловых масс в таких случаях может стать причиной развития кишечной непроходимости.
Глава 23. Нарушение функций печени
и желчевыводящих путей
Печень играет ведущую роль в обмене белков, жиров, углеводов, гормонов, витаминов, минеральных веществ, а также многих экзогенных соединений. В печени происходит синтез альбуминов, фибриногена, протромбина и некоторых других факторов двертывания крови, вырабатываются гепарин, а- (3- и (частично) у-глобулины, ряд ферментов. В печени осуществляются синтез гликогена, его депонирование и распад (глико- генолиз), превращение галактозы и фруктозы в глюкозу, синтез глюкозы из других соединений (глюконеогенез), образование глюкуроновой кислоты, необходимой для конъюгации некоторых веществ (прежде всего билирубина).
В печени, принимающей большое участие в жировом обмене, синтезируются холестерин, триглицериды, фосфолипиды и липопротеиды, происходят гидролиз триглицеридов и образование кетоновых тел. Кро-' ме того, в печени вырабатываются желчные кирдоты, необходимые для переваривания и всасывания жиров в кишечнике.
Печень, играя важнейшую роль в обмене билирубина, захватывает непрямой (свободный) билирубин из крови, связывает его с глюкуроновой кислотой и выделяет в желчные капилляры в виде прямого (связанного) билирубина. Она обеспечивает инактивацию стероидных гормонов (андрогенов, эстрогенов, глюкокортикоидов, альдостерона) и биогенных аминов (гистамина, серотонина), а также активно участвует в обмене многих витаминов (в первую очередь А, К, Е, D).
Огромное значение имеет детоксикационная (обезвреживающая) функция печени. В ней происходят синтез мочевины из конечных продуктов азотистого обмена, метаболизм многих лекарственных препаратов (особенно принимаемых внутрь), обезвреживаются токсичные продукты, вырабатываемые кишечной микрофлорой.
Нарушение тех или иных функций печени приводит к развитию ряда патологических синдромов с определенными патофизиологическими механизмами и характерными клиническими признаками.
23.1. Печеночно-клеточная недостаточность
Несмотря на значительные компенсаторные возможности печени и ее высокую регенераторную активность, массивный некроз или выраженная дистрофия гепатоцитов приводят к возникновению синдрома пече- ночно-клеточной недостаточности, сопровождающегося нарушением
функций различных органов и систем. Острая печеночно-клеточная недостаточность может развиться при молниеносном (фульминантном) течении острого вирусного гепатита (например, гепатита Е у беременных), передозировке некоторых лекарственных препаратов, отравлении ядом бледной поганки и четыреххлористым углеродом, чрезмерном приеме алкоголя. Хроническая печеночно-клеточная недостаточность является чаще всего результатом цирроза печени или же гепатоцеллюлярной карциномы.
Нарушения, развивающиеся при синдроме печеночно-клеточной недостаточности, представлены на схеме 23.1.
Неспособность гепатоцитов метаболизировать свободный билирубин повышает его содержание в крови и как следствие, приводит к возникновению желтухи. Кроме того, при печеночно-клеточной недостаточности повышается уровень прямого билирубина, что связано с некрозом гепатоцитов и попаданием прямого билирубина в кровеносные капилляры.
Нарушение детоксикационной функции печени, возникающее как в результате печеночно-клеточной недостаточности, так и вследствие формирования портокавальных шунтов, обусловливает накопление в организме конечных азотистых метаболитов, а также необезвреженных продуктов распада белка в кишечнике (аммиак, фенолы, мёркаптаны), что ведет к развитию печеночной энцефалопатии, (комплекс неврологических и психических расстройств), присоединению алкалоза и при прогрессиро- вании печеночно-клеточной недостаточности — к возникновению печеночной комы. С кишечной эндотоксемией и попаданием кишечных бактерий в кровь может быть связано и появление еще двух характерных
Печеиочиоклеточиая недостаточность
Нарушение мет аболичма билирубина
Нарушение
обмена эстрогепоп
Кишечная эндотоксемия
Нарушение азотистого обмена
Снижение
синтеза альбумшютз
Снижение уровня нро!ромбина
| Эндокринные нарушения |
| Печеночный запах |
| Печеночная энцефалопати* |
| Лихорадка |
| Желтуха |
Ас ди 1
| Геморрагии |
| Сентицемия |
Печеночная кома
| Импотенция |
Гинекомастия
Схема 23.1. Нарушение гомеостаза при печеночно-клеточной недостаточности. 540
симптомов печеночно-клеточной недостаточности-—лихорадки и печеночного запаха при выдохе.
Гипоальбуминемия, отражающая падение синтетической функции гепатоцитов, способствует снижению онкотического давления крови и развитию асцита. Уменьшение выработки факторов свертывания крови, в первую очередь протромбина, объясняет высокую частоту возникновения при печеночно-клеточной недостаточности различных геморрагических осложнений (носовых и десневых кровотечений, кожных кровоизлияний и т.д.).
Наконец, отмечающееся при гепатоцеллюлярной недостаточности повышение содержания эстрбгенов в крови является причиной нередкого присоединения эндокринных нарушений (импотенция, гинекомастия и др.), а также появления одного из наиболее частых кожных «печеночных знаков» — телеангиэктазий («сосудистых звездочек»), располагающихся на коже лица, шеи, груди, плеч, предплечий и тыльной поверхности кистей и состоящих из центральной артериолы с расходящимися от нее в виде «паучка» расширенными капиллярами (spider nevus).
23.2. Патофизиологические механизмы синдрома портальной гипертензии
Под синдромом портальной гипертензии понимают комплекс расстройств, развивающихся в результате нарушения кровотока в портальных сосудах, печеночных венах или нижней полой вене и последующего повышения давления в системе воротной вены.
В зависимости от локализации препятствия току крови выделяют внутри- и внепеченочную формы портальной гипертензии. Внутрипече- ночная форма развивается при циррозе печени, когда из-за разрастания соединительной ткани на месте погибших печеночных клеток возникает облитерация печеночных синусоидов и внутрипеченочных кровеносных сосудов. При внепеченочной форме препятствие току крови может локализоваться либо в самой воротной вене и ее крупных ветвях (например, в результате сдавления опухолью или тромбоза), либо в печеночных венах [например, при их тромбозе (синдром Бадда-Киари)] или нижней полой вене (при констриктивном перикардите).
Увеличение сопротивления кровотоку в портальной вене приводит к повышению давления в этой системе с 5—6 (в норме) до 18—20 мм рт.ст. и выше. При этом кровь из бассейна воротной вены начинает оттекать через существующие венозные коллатерали (портокавальные анастомозы), что приводит к варикозному расширению вен пищевода и желудка, расширению околопупочных вен («голова медузы») и образованию геморроидальных варикозных узлов. Наибольшее клиническое значение имеет расширение варикозных вен пищевода, способных стать источником массивных желудочно-кишечных кровотечений, являющихся одной из основных причин смерти больных с циррозом печени.

|
Обструкция BI гут рипечёночных сосудов
| Снижение синтеза альбуминов |
Вазодилатация и открытие артсрио-венозпых шунтов
J
f
| Повышение акгивносiи системы реи ин- анпкпензнн- альдостерои |

| Снижение онкотического давления |
| Увеличение лимфо- обраловапия |
| Повышение данления в системе воротной вены |
| Снижение активности калликреип- кипиновой системы |
| Повышение выработки ш |
| Снижение эффективного объёма плазм ы I |
| Повышение катгалыгспой рсабсорбции натрия |
| Повышение симпатической активносги |
Снижение образования PgH
Схема 23.2. Патогенез асцита при циррозе печени.
Возникающий при портальной гипертензии венозный застой крови в селезенке способствует ее увеличению (спленомегалия) с последующим усилением ее функции (гиперспленизм), проявляющимся повышенным разрушением клеток крови и торможением костномозгового кроветворения с развитием панцитопении.
Характерным проявлением синдрома портальной гипертензии служит асцит (скопление свободной жидкости в брюшной полости). Патогенез асцита при циррозе печени достаточно сложен и включает в себя целый ряд механизмов (схема 23.2).
Обструкция внутрипеченочных сосудов сопровождается повышенным лимфообразованием в печени и пропотеванием лимфы в брюшную полость (лапароскопическая картина «плачущей» печени). Кроме того, развивающееся при внутрипеченочной портальной гипертензии повышение синусоидального гидростатического давления в свою очередь обусловливает увеличение транссудации свободной жидкости из кровеносного русла в брюшную полость. Возникающие при циррозе печени гемодинамические нарушения в виде вазодилатации и открытия артерио-
венозных анастомозов приводят к снижению эффективного объема плазмы. Последующее возбуждение волюм-рецепторов стимулирует образование ренина юкстагломерулярным аппаратом почек. Активация системы ренин—ангиотензин—альдостерон ведет к увеличению реабсорбции натрия в канальцах почек. Включению этого фактора способствуюттакже повышение выработки антидиуретического гормона, активация симпатической нервной системы, снижение образования простагландина Е2 в почках и уменьшение активности калликреин-кининовой системы, возникающие в ответ на снижение эффективного объема плазмы. Наконец, уменьшение онкотического давления, обусловленное снижением синтеза альбуминов в печени, также способствует возникновению асцита и его прогрессированию.
В свою очередь асцит может осложниться развитием гепато-реналь- ного синдрома, который возникает в ответ на существующие при асците нарушения гемодинамики и характеризуется сокращением сосудов коркового слоя почек и последующим падением клубочковой фильтрации, а также спонтанного бактериального перитонита, являющегося следствием инфицирования асцитической жидкости.
23.3. Патофизиологические механизмы желтухи
Под желтухой понимают синдром, развивающийся в результате накопления в крови и тканях избыточного количества билирубина и клинически характеризующийся желтушным окрашиванием кожи и слизистых оболочек. В зависимости от уровня поражения, имеющегося при данном синдроме, выделяют несколько типов желтухи.
Так, желтуха может развиться в результате гемолиза, т.е. чрезмерного разрушения, эритроцитов, при котором печень оказывается не в состоянии перевести весь образовавшийся непрямой билирубин в прямой. Этот вариант желтухи (именуемый ранее надпеченочная) встречается при гемолитических анемиях, инфарктах различных органов и обширных гематомах и характеризуется повышением в крови уровня свободного (непрямого) билирубина, а также насыщенным цветом испражнений и гиперпигментацией мочи вследствие повышенного образования стеркоби- линогена.
Желтуха может быть обусловлена нарушением метаболизма непрямого билирубина на различных этапах: захвата и переноса свободного билирубина в гепатоцит, его конъюгации, выведения образовавшегося прямого билирубина через ка~ нальцевую мембрану в желчь.
Эти варианты объединяют также понятием «печеночная желтуха». Так, снижение активности конъюгирующего фермента глюкуронил- трансферазы, переводящей свободный билирубин в связанный, лежит в основе развития так называемой семейной негемолитической доброкачественной неконъюгированной гипербилирубинемии (синдром Жильбе- ра). Этот синдром — наследуемый по аутосомно-рецессивному типу, характеризуется умеренным повышением уровня непрямого билирубина, обычно возрастающего после голодания, и отличается, как правило, хорошим прогнозом. Синдром Жильбера встречается сравнительно нередко (у 2—5 % всего населения, преимущественно у юношей и мужчин молодого возраста) и иногда ошибочно расценивается как проявление хронического гепатита.
Иные патофизиологические механизмы лежат в основе желтухи, развивающейся при глубоких структурных повреждениях гепатоцитов. Данный вид желтухи (ее еще называют печеночно-клеточной) встречается при вирусных, алкогольных и лекарственных гепатитах, циррозах печени, других заболеваниях, протекающих с некрозом печеночных клеток. При этом в крови повышается как уровень непрямого билирубина (за счет снижения функциональных возможностей гепатоцитов), так и прямого (вследствие нарушения целостности мембран гепатоцитов и поступления билирубинглюкуронида в кровеносное русло), в моче появляется прямой билирубин, обусловливающий ее темную окраску, уменьшается (хотя полностью и не прекращается) выделение стеркобилиногена с калом. Указанный вариант печеночной желтухи протекает с повышением активности сывороточных трансаминаз и нередко сопровождается признаками печеночно-клеточной недостаточности.
При некоторых патологических процессах (например, холестатичес- кий вариант хронического гепатита) могут страдать экскреция желчи из гепатоцита во внутрипеченочные желчные протоки или выведение желчи из этих протоков (при первичном билиарном циррозе). При таком типе печеночной желтухи выявляют признаки, характерные для синдрома холестаза.
Появление желтухи возможно и вследствие нарушения оттока желчи из желчных протоков в двенадцатиперстную кишку (так называемая подпеченочная желтуха). Данный вариант желтухи развивается в результате частичной или полной обтурации печеночного или общего желчного протоков конкрементом или опухолью, при сдавлении или прорастании устья общего желчного протока злокачественной опухолью головки поджелудочной железы или большого дуоденального сосочка, при сдавлении крупных желчных протоков пакетами лимфатических узлов (например, при лимфогранулематозе), Рубцовых стриктурах общего желчного протока и целом ряде других заболеваний. Затруднение оттока желчи приводит к повышению давления в желчных капиллярах и последующему выходу желчи в кровеносные сосуды. Это способствует увеличению в крови содержания прямого билирубина, его появлению в моче, а также отсутствию выделения стеркобилиногена с калом. Комплекс расстройств, возникающих при затруднении оттока желчи в двенадцатиперстную кишку, называют синдромом холестаза, который в зависимости от уровня обструкции может быть внутри- или внепеченочным.
Характер расстройств, развивающихся при синдроме холестаза, представлен на схеме 23.3.
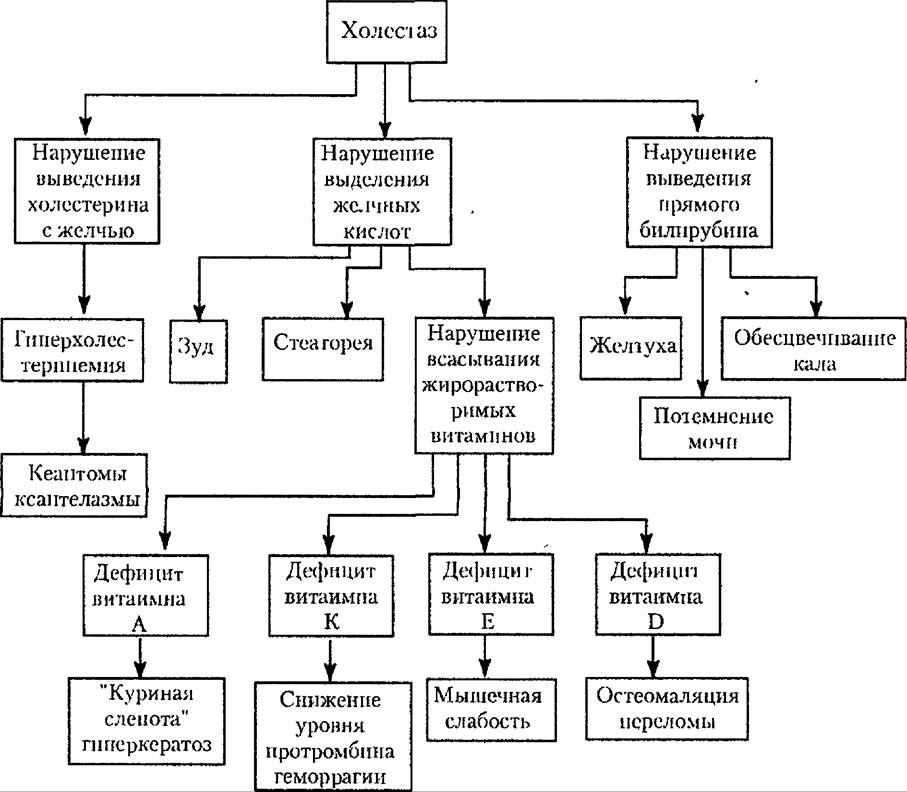 Схема 23.3. Нарушение гомеостаза при синдроме холестаза.
Схема 23.3. Нарушение гомеостаза при синдроме холестаза.
|
Недостаточное поступление желчных кислот в кишечник приводит к нарушению переваривания и всасывания жиров и возникновению стеа- тореи. При этом страдает и всасывание жирорастворимых витаминов, что может способствовать появлению клинических симптомов, характерных для дефицита витамина А (нарушение сумеречного зрения, гиперкератоз), витамина К (снижение уровня протромбина, геморрагии), витамина Е (мышечная слабость). Развитие дефицита витамина D ведет к деминерализации костной ткани, размягчению костей (остеомаляция) и возникновению патологических переломов. Нарушение выделения холестерина сжелчью и последующее повышение его уровня в крови обусловливает появление на коже плоских холестериновых бляшек, располагающихся вокруг глаз (ксантелазмы), реже на кистях рук, локтях и стопах (ксантомы).
Ведущими клиническими проявлением этого синдрома служат желтуха, потемнение мочи и обесцвечивание кала (ахоличный стул), обусловленные повышением уровня прямого билирубина в крови, его выделением с мочой (билирубинурия) и отсутствием стеркобилиногена в кале, а также кожный зуд, связанный с задержкой желчных кислот и раздражением ими нервных окончаний, расположенных в коже.
23.5. Патофизиологические механизмы холелитиаза
Желчнокаменная болезнь относится к числу наиболее распространенных заболеваний и ее выявляют в развитых странах у 10—15% всего населения. В зависимости от состава конкрементов выделяют холестериновые, черные пигментные и коричневые пигментные камни. Наиболее часто (в 70—90 % случаев) встречаются холестериновые камни, главным компонентом которых является холестерин.
Образованию холестериновых камней способствуют 3 основных фактора: перенасыщение желчи холестерином, осаждение холестерина в виде кристаллов и нарушение двигательной функции желчного пузыря. В норме холестерин находится в желчи в растворенном состоянии, удерживаясь желчными кислотами в виде смешанных липидных мицелл. Такая желчь характеризуется низким индексом насыщения холестерином, который рассчитывают, исходя из молярного соотношения холестерина, желчных кислот и фосфолипидов. При повышении индекса насыщения желчи холестерином, характеризующегося увеличением содержания холестерина в желчи или снижением концентрации желчных кислот, избыточное количество холестерина уже не может образовывать мицеллы и осаждается в виде кристаллов моногидрата холестерина. Нарушение опорожнения желчного пузыря (например, в поздние сроки беременности) способствует осаждению кристаллов холестерина и образованию в желчном пузыре так называемой желчной замазки (сладжа) и этим можно объяснить, в частности, высокую частоту холелитиаза у многорожавших женщин.
Развитию желчнокаменной болезни может способствовать целый ряд факторов. Так, заболеваемость холелитиазом значительно чаще встречается у лиц пожилого возраста, что связано с увеличением содержания у них холестерина в желчи. Существенными факторами камнеоб- разования, кроме того, являются наследственная предрасположенность, ожирение, употребление пищи с высоким содержанием рафинированных углеводов и низким содержанием растительных волокон, способствующей перенасыщению желчи холестерином, некоторые заболевания (цирроз печени, сахарный диабет). Литогенные свойства желчи повышаются и при длительном приеме пероральных контрацептивов. Определенную роль может играть проникновение в желчь бактерий, способствующих деконъюгации желчных кислот.
Глава 24. Патологическая физиология почек
Почки называют «центральным органом гомеостаза», поскольку в результате их деятельности сохраняются ионный состав и объем биологических жидкостей. Почки поддерживают гомеостаз вследствие их способности контролировать баланс натрия, калия, кальция, магния, водородных ионов, участвовать в метаболизме белков, углеводов и липидов, выделять ряд гормонов и биологически активных веществ (ренин, кинины, эритро- поэтин, простагландины). Почки осуществляют экскреторную функцию, в них образуются моча, с которой удаляется часть воды и солей, продукты метаболизма белков, многие из которых токсичны.
Многообразие почечных функций обеспечивается согласованной деятельностью клубочков и канальцев почек, где происходят клубочковая фильтрация, канальцевая реабсорбция и канальцевая секреция (рис. 24.1).
Важными показателями согласованной деятельности клубочков и канальцев (нефрона в целом) являются скорость клубочковой фильтрации, сохранение баланса натрия и обьема внеклеточной жидкости, рН крови, а также сохранение способности к мочеобразо- ванию и выделению мочи.
Рис. 24.1. Схема строения нефрона (Наточин Ю.В. «Почка». — С.-Пб. университет, 1997). Нефрон с длинной петлей А и с короткой петлей Б Внутри коры мозговой луч обозначен штриховой линией. KB — корковое вещество, HMB — наружное мозговое вещество, BMB — внутреннее мозговое вещество, НП — наружная полоска, ВП —

| нмв |
внутренняя полоска 1 — почечное тельце, включающее капсулу Боумена и клубочек (клубочек капилляров), проксимальные канальцы, 2а— извитой, 26 —прямой; тонкое колено За — нисходящее, 36 — восходящее, остальные канальцы: 4а— прямой (толстое восходящее колено): 46 — извитой, 5 — плотное пятно; 6а — аркада, образованная связующим канальцем, собирательные трубки. 7а — коры почки, 76 — наружного мозгового вещества, 7в — внутреннего мозгового вещества.
Выполнение сложных почечных функций прежде всего зависит от состояния почечного кровотока. Почки получают 20—25% крови от минутного объема сердца; нормальный почечный кровоток составляет 1100 мл/мин (плазмоток — 600 мл/мин).
В капиллярах клубочков, куда притекает более 1 л крови каждую минуту, происходит важнейший процесс — ультрафильтрация: отделение каждую минуту 100—120 мл гломерулярного фильтрата от 600 мл плазмы.
Стенка гломерулярных капилляров функционирует как пористая мембрана, регулирующая образование ультрафильтрата плазмы, свободного от белков и клеток. Процесс ультрафильтрации происходит под влиянием эффекта разности гидростатического давления (45 мм рт.ст.), создаваемого работой сердца, величины гидростатического давления в боуменовой капсуле (10 мм рт.ст.) и онкотического давления в плазме гломерулярных капилляров (20 мм рт.ст.). Взаимоотношение этих показателей отражаетуравнение:
CK0 = Kf-Puf,
где СКФ — скорость клубочковой фильтрации, Kf — коэффициент ультрафильтрации, Puf — общее фильтрационное давление, зависящее, в свою очередь, от баланса сил Старлинга, действующий через капилляры клубочка, поэтому
Р - р _ /р + п )
ruf gc \rt 1 'qc'5
где — гидростатическое давление в боуменовом пространстве (или
дс
проксимальных канальцах) и nqc — онкотическое давление в плазме гломерулярных капилляров.
Таким образом, общее фильтрационное давление поддерживается на относительно низком уровне, однако высокая скорость гломеруляр- ной фильтрации определяется высоким показателем коэффициента ультрафильтрации, который зависит от площади фильтрующей поверхности и гидравлической проводимости мембраны гломерулярных капилляров. Эти два последних параметра могут варьировать в зависимости от физиологических условий, контрактильных свойств мезангия и характера патологических процессов в клубочках (например, облитерации клубочков).
Избирательная проницаемость фильтрационного барьера зависит от особых свойств гломерулярной базальной мембраны — ее способности ограничивать пассаж органических веществ плазмы, имеющих определенный молекулярный радиус (эффективный молекулярный радиус), так что вещества с молекулярной массой свыше 50 000 фильтруются в незначительных количествах и наряду с этим базальная мембрана в большей степени ограничивает фильтрацию анионов, чем катионов, так что создается высоко плотный анионный слой (барьер).
Из боуменовой капсулы клубочковый фильтрат переходит в систему канальцев, где подвергается значительным изменениям. В разных сегментах канальцев почек с различной интенсивностью осуществляются процессы реабсорбции воды и растворенных в ней веществ первичной мочи и наряду с этим — процессы сёкреции в просвет канальцев некоторых веществ из крови околоканальцевых капилляров. Характер процессов канальцевой реабсорбции и канальцевой секреции в значительной степени определяется от состава и объема внеклеточной жидкости, т.е. почки в зависимости от потребности организма регулируют состав его внутренней среды.
24.1. Нарушение клубочковой фильтрации
Снижение скорости клубочковой фильтрации (ниже 70 мл/мин) является одним из основных показателей нарушения функций клубочков.
Снижение скорости клубочковой фильтрации может быть вызвано разными патологическими процессами в паренхиме почек, а также внепочечными факторами.
Снижение скорости клубочковой фильтрации наблюдается при диффузном повреждении клубочкового аппарата почек при острых и хронических воспалительных процессах в клубочках (гломерулонефриты разного генеза, системные болезни, васкулиты). Хронические прогрессирующие заболевания почек, сопровождающиеся гибелью нефронов и уменьшением массы функционирующих нефронов, также способствуют снижению СКФ.
Особенно выраженное снижение СКФ (клиренс креатинина ниже 40 мл/мин) характерно для потери свыше 50 % массы функционирующих нефронов, когда развивается хроническая почечная недостаточность.
Однако в некоторых случаях резкое снижение СКФ (до 10 мл/мин) возможно и при сохранении массы функционирующих нефронов, но в условиях внезапного прекращения притока крови к паренхиме почек или токсических влияний (при некоторых формах острой почечной недостаточности).
Повышение внутриканальцевого гидростатического давления также может обусловить снижение СКФ. В эксперименте установлено, что при гидростатическом давлении в мочевых путях 40—50 мм рт.ст. фильтрационное давление становится равным нулю. Повышать внутри- канальцевое давление могут процессы, вызывающие нарушение оттока мочи и повышение давления в мочевыводящих путях и боуменовой капсуле (стриктуры мочеточника, гипертрофия предстательной железы, множественные камни в почечной лоханке). Обструкция канальцев продуктами распада клеток или цилиндрами, наблюдаемая при токсическом или ишемическом повреждении канальцев (при острой почечной недостаточности) приводит к снижению СКФ.
Снижение кровотока в почках и СКФ может развиться под влиянием внепочечных факторов — стеноза почечной артерии, абсолютного или относительного снижения объема крови (кровотечение или падение сократительной функции сердца).
Увеличение симпатической активности уменьшает почечный кровоток и СКФ, поскольку почки богато иннервированы адренергическими нервными окончаниями, однако симпатическое влияние на почечный кровоток у здоровых людей сглаживается механизмами авторегуляции, и поэтому проявляется главным образом при острых ситуациях — резких болевых ощущениях (почечная и печеночная колика, оперативные вмешательства).
В тоже время не всегда снижение скорости кпубочковой фильтрации следует рассматривать как признак патологии почек. У здоровых людей умеренное снижение почечного кровотока и СКФ возможно в вертикальном положении тела, при физической нагрузке, перегревании и возрастной инволюции.
Последствием значительного снижения СКФ может быть снижение суточного количества мочи. Если у взрослого пациента количество мочи за сутки не превышает 400 мл, это обозначают термином «олигурия», при выделении за сутки не более 100 мл мочи используюттермин «анурия».
Олигурия чаще возникает при острых воспалительных процессах в почках, острой почечной недостаточности или терминальной стадии хронической почечной недостаточности; анурия — при обструкции мочевых путей.
Поскольку на кровоток почек оказывают влияние нервные и гормональные факторы, снижение диуреза может иногда наблюдаться и у здоровых людей, например, при испуге, травме.
При заболеваниях почек, сопровождающихся снижением СКФ, возможно накопление в крови веществ, выведение которых обусловлено клубочковой фильтрацией.
Это прежде всего мочевина и креатинин (азотистые шлаки). Повышение в крови уровня азотистых шлаков обозначаюттермином «азотемия». При резком уменьшении функционирующих нефронов в крови накапливаются вещества, называемые «уремическими токсинами».
Последствием снижения СКФ может быть также нарушение состава внеклеточной жидкости, с задержкой натрия и воды, накоплением водородных ионов и развитием гиперкалиемии.
В то же время не всегда тяжесть ра^ройств гомеостаза коррелирует со степенью снижения СКФ. Например, при остром повреждении клубочкового фильтра (остром нефритическом синдроме) нередко наблюдают повышение азотистых шлаков в крови, а также значительную задержку натрия, хотя при этом не определяется заметного снижения СКФ. При медленно прогрессирующих формах поражения почек в течение длительного периода может обнаруживаться лишь умеренное снижение СКФ и сохраняться постоянство гомеостаза, несмотря на значительное уменьшение массы функционирующих нефронов.
Дата добавления: 2015-02-05; просмотров: 1038;
