Бадмаев Б.Ц. 10 страница
При орофарингеальной дисфагии, обусловленной парезом или дис- координацией мышц, участвующих в акте глотания, пища (особенно жидкая) может попадать в носоглотку и дыхательные пути, вызывая появление кашля, чиханья, поперхивания и способствуя аспирации содержимого в бронхи с развитием аспирационной пневмонии и абсцесса легких, а иногда — и развитию асфиксии (например, при бешенстве).
Расстройства нормальной перистальтики тела пищевода могут возникать при нарушении центральной нервной регуляции двигательной функции пищевода (например, сильные эмоциональные потрясения), дегенеративно-дистрофических изменениях нейронов в интрамуральных ганглиях, замещении мышечных волокон стенки пищевода соединительной тканью (при системной склеродермии). К наиболее частым проявлениям нарушений двигательной функции тела пищевода относится эзо- фагоспазм (сегментарный или диффузный), отмечающийся нередко при неврозах и характеризующийся периодически возникающей дисфагией. Эпизодически эзофагоспазм может наблюдаться даже у здоровых людей при поспешном приеме пищи (например, сухого творога или сваренного вкрутую яичного желтка). Органические поражения тела пищевода, сопровождающиеся сужением его просвета (ожоговые или пептические рубцовые стриктуры, злокачественные опухоли), обусловливают появление постоянной, как правило, неуклонно прогрессирующей дисфагии.
Рефлекторное расслабление нижнего пищеводного сфинктера (НПС) при глотании способствует поступлению пищевого комка в желудок. Последующее восстановление и сохранение нормального тонуса НПС (в пределах 15—35 мм рт.ст.) предотвращает обратный заброс (рефлюкс) кислого желудочного содержимого в пищевод и поддерживает обычный уровень внутрипищеводного рН (>4). Нормальная функция НПС обеспечивается холинергической иннервацией. Кроме того, определенные биологически активные вещества и гастроинтестинальные пептиды понижают (секретин, желудочный ингибиторный пептид, соматостатин, серотонин, допамин и др.) или повышают (гастрин, мотилин, субстанция Р) тонус НПС.
Нарушение нормального расслабления НПС во время глотания ведет к развитию характерного заболевания, также протекающего с картиной дисфагии, именуемого ахалазией кардии (греч. а — отсутствие, chalasis — расслабление). Считают, что в основе нарушения регуляции функции НПС при ахалазии кардии лежит дефицит специфического ней- ротрансмиттера — оксида азота (N0), образующегося из L-аргинина с участием фермента NO-синтетазы и вызывающего расслабление гладкомышечных клеток. Определенную роль в возникновении ахалазии кардии играет, возможно, и недостаток выработки вазоактивного интести- нального пептида (ВИП), способствующего освобождению N0 из нейронов пищевода.
В свою очередь снижение тонуса НПС, приводящее к забросу кислого желудочного содержимого в пищевод, служит основным механизмом развития гастроэзофагеальной рефлюксной болезни, являющейся сейчас одним из наиболее распространенных гастроэнтерологических заболеваний.
Как показали результаты исследований, и у здорового человека в течение суток периодически (в среднем 20—30 раз) самопроизвольно расслабляется НПС. Это кратковременное (обычно не более 20 с) снижение тонуса НПС вызывает так называемый физиологический желудочно- пищеводный рефлюкс, который не ведет к развитию заболевания. О патологическом гастроэзофагеальном рефлюксе говорят в тех случаях, когда общее число эпизодов рефлюкса в течение суток становится более 50 или же суммарная продолжительность времени снижения внутрипи- щеводного рН <4 превышает 1 ч.
Патологический желудочно-пищеводный рефлюкс обусловливает появление часто встречающихся клинических симптомов гастроэзофагеальной рефлюксной болезни, к которым относятся изжога, отрыжка, срыгивание.
Изжога (лат. pyrosis) представляет собой неприятное ощущение жжения в области мечевидного отростка, возникающее при раздражении слизистой оболочки пищевода кислым желудочным содержимым. Реже она вызывается щелочным рефлюксом; в таких случаях это связано с действием на слизистую оболочку пищевода желчных кислот, попадающих в желудок (а затем и в* пищевод) в результате дуоденогастрального рефлюкса желчи.
Отрыжкой (лат. eructatio) называют непроизвольное выделение в полость рта газов (отрыжка воздухом) или небольшого количества пищи, которое происходит при сокращении мускулатуры желудка на фоне синхронного расслабления НПС. Срыгивание (регургитация), представляя собой заброс содержимого желудка обратно в полость рта, встречается часто у детей первых месяцев жизни при их перекармливании. Иногда оно свидетельствует о наличии препятствия для прохождения пищи по пищеводу. Отмечающееся в ночное время срыгивание в таких случаях обусловливает появление у пациентов так называемого симптома мокрой подушки.
Гастроззофагеальная рефлюксная болезнь может быть причиной отраженных болей в левой половине грудной клетки, обусловленных нарушением моторики пищевода й получившие в медицинской литературе название «боли в грудной клетке некардиального происхождения» (англ. — non-cardiac chest pain), симулирующие стенокардию. Кроме того, попадание желудочного содержимого в бронхи способно рефлекторно вызвать развитие бронхоспазма. Длительное (в течение многих лет) раздражение слизистой оболочки терминального отдела пищевода может привести к перестройке (метаплазии) эпителия слизистой оболочки дис- тального отдела пищевода по кишечному типу (так называемый синдром Баррета) с последующим высоким риском развития рака пищевода.
22.2. Нарушение функций желудка
Желудок выполняет в организме человека многообразные функции. В нем происходят физическая и химическая обработка пищи, ее депонирование и эвакуация, выработка гастромукопротеида (внутреннего фактора Касла), необходимого для всасывания в кишечнике витамина В12. К наиболее важным функциям желудка относятся образование в нем соляной кислоты и пепсина, выработка слизи, а также синтез простагланди- нов и некоторых гастроинтестинаяьных пептидов.
22.2.1. Нарушения секреции соляной кислоты и пепсина
Соляная кислота выделяется париетальными (обкладочными) клетками слизистой оболочки желудка, число которых у здорового человека составляет 1 миллиард (109). Регуляция ее секреции — достаточно сложный механизм, включающий в себя 3 фазы секреции: психическую, цефа- лическую и периферическую (пищеварительную). Психическая фаза возникает при соответствующих мысЬях о предполагаемом приеме пищи; цефалическая фаза «запускается» в ответ на вид, запах и вкус пищи. Периферическая, или пищеварительная, фаза включается при действии таких факторов, как растяжение желудка, наличие в составе пищи стимуляторов секреции (например, некоторых аминокислот); местное освобождение гастроинтестинальных гормонов (в первую очередь, гастрина).
В регуляции функциональной активности париетальной клетки принимают участие нервная система (медиатором здесь служит ацетилхо- лин), а также различные гормоны, выделяющиеся в кровь (секретин, инсулин) или межклеточную жидкость (например, соматостатин).
Основные механизмы регуляции функции париетальной (обкладоч- ной) клетки слизистой оболочки желудка представлены на схеме 22.1.
1 IMITH
| Hrb |
^нпидшчии
(а '
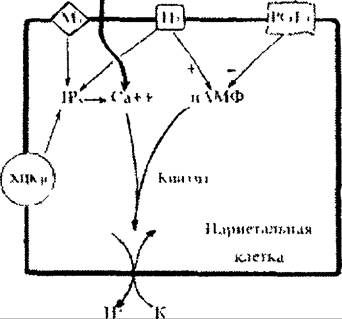 Схема 22.1. Регуляция функции париетальной (обкладочной) клетки
слизистой оболочки желудка. Обозначения: ХЦК — холецистокинин; ХЦКр — рецепторы для холецистокинина; М3 — мускариновые рецепторы; Н2 — гистаминовые рецепторы; PGE2 — простагландин Е2;
!Р3 — инозитол-трифоефат; цАМФ — аденозин-монофосфат.
Схема 22.1. Регуляция функции париетальной (обкладочной) клетки
слизистой оболочки желудка. Обозначения: ХЦК — холецистокинин; ХЦКр — рецепторы для холецистокинина; М3 — мускариновые рецепторы; Н2 — гистаминовые рецепторы; PGE2 — простагландин Е2;
!Р3 — инозитол-трифоефат; цАМФ — аденозин-монофосфат.
|
| К),к<»ь |
Париетальная клетка содержит рецепторы для гистамина, освобождающегося из энтерохромаффинных (ECL) клеток, гастрина и холецистокинина (ХЦК-рецепторы), а также рецепторы для ацетилхолина (М3-рецеп- торы). Стимуляция Н2-рецепторов способствует высвобождению (+) циклического аденозинмонофосфата (цАМФ), тогда как стимуляция ХЦК- рецепторов и М3-рецепторов приводит к повышению уровня внутриклеточного кальция (Са++). Стимуляция М3-рецепторов увеличивает, кроме того, поступление Са++ в клетку и благодаря возрастанию уровня инози- толтрифосфата (IP3) усиливает выход внутриклеточного Са++. Гастрин, холецистокинин и гистамин также повышают выход Са++ благодаря действию на IP3. Париетальная клетка содержит рецептор для простагланди- на Е2 (PGE2), стимуляция которого уменьшает уровень цАМФ и приводит к торможению секреции соляной кислоты.
Секреция соляной кислоты париетальной клеткой осуществляется по принципу протонного насоса (помпы), в котором К+ обменивается на Н+, a CI" на НС03\ Важную роль в этом процессе играет Н+К+-АТФаза, которая, используя энергию, выделяющуюся при расщеплении АТФ, обеспечивает транспорт Н+ из париетальной клетки и их обмен на К+.
Столь сложный механизм регуляции выработки соляной кислоты объясняет многообразие факторов, способствующих повышению или снижению ее продукции. Так, субъективно неприятные ощущения, связанные с процедурой желудочного зондирования, могут вызвать торможение выработки соляной кислоты за счет воздействия на психическую фазу желудочной секреции. В результате этого уровень базальной кис
лотной продукции, например, при желудочном зондировании может оказаться заниженным. На характер желудочного кислотовыделения влияют, кроме того, такие факторы, как эмоциональное возбуждение, или, наоборот, подавленность, тоска.
Гиперсекреция соляной кислоты, играющая важную роль в развитии целого ряда гастроэнтерологических заболеваний, может наблюдаться при наследственно детерминированном увеличении массы обкладоч- ных клеток; повышенном тонусе блуждающего нерва (в частности, улиц с конституционально обусловленной ваготонией); растяжении антрально- го отдела желудка в случаях нарушения его опорожнения; возрастании выработки гастрина у больных с гастринпродуцирующей опухолью поджелудочной железы (синдром Золлингера—Эллисона), а также при увеличении количества ECL-клеток в слизистой оболочке желудка (у больных с карциноидным синдромом) и т.д.
Помимо соляной кислоты, в желудочном соке содержится протео- литический фермент пепсин, который образуется из своего профермента пепсиногена, вырабатываемого главными клетками слизистой оболочки желудка. В настоящее время различают? разновидностей пепсиногена, из которых первые 5 обнаруживают в фундальном отделе желудка, составляя пепсиноген-1, а остальные 2 синтезируются слизистой оболочкой всех отделов желудка и проксимальной частью двенадцатиперстной кишки, образуя пепсиноген-ll. Нарушение пепсинобразующей функции желудка имеет определенное значение в возникновении ряда гастроэнтерологических заболеваний, например повышенная выработка пепси- ногена-1 является одним из генетически детерминированных факторов, способствующих развитию язвенной болезни.
22.2.2. Нарушение слизеобразующей функции желудка
Еще в 1856 г. выдающийся французский физиолог Клод Бернар писал, что прокладка, образуемая слоем желудочной слизи, заключает в себя желудочный сок подобно непроницаемой фарфоровой вазе.
Желудочная слизь (муцин), вырабатываемая добавочными клетками (мукоцитами) слизистой оболочки желудка, представляет собой сложную динамическую систему коллоидных растворов, состоящую из низкомолекулярных органических компонентов (протеинов, липидов), минеральных веществ, лейкоцитов, слущенных эпителиальных клеток слизистой оболочки. В состав желудочной слизи входят 2 группы веществ: гликозаминогликаны (их содержание коррелирует с секрецией пепсина) и гликопротеиды. В свою очередь гликопротеиды могут быть нейтральными (фукоза и дигексозаминовые) и кислыми, к которым относятся суль- фогликопротеиды и сиаломуцины. Из сиаловых кислот наиболее важная N-ацетилнейраминовая кислота, обеспечивающая способность желудочной слизи образовывать водонерастворимое вискозное покрытие слизистой оболочки желудка.
Секреция желудочной слизи происходит непрерывно. При этом разрушенные гликопротеиды восстанавливаются за счет их синтеза постоянно обновляющимися слизеобразуЮщимй клетками. Стимулирующее влияние на выработку слизи оказывают возбуждение адрено- и холинорецеп- торов, простагландины. Определенную р!оль в процессах слизеобразова- ния играеттакже стабильность лизосом: освобождающиеся при нарушении их целостности гидролазы вызывают дегидратацию гликопротеинов.
Желудочная слизь (вместе с бикарбонатами, секретируемыми эпителиальными клетками) принимает участие б формировании защитного слизистого барьера, поддерживающего определенный градиент рН между просветом желудка и его слизистой оболочкой и задерживающего Н+, поступающие из просвёта желудка.
Нарушение целостности данного барьера в результате уменьшения синтеза простагландинов в стенке желудка Является одним из основных механизмов повреждающего действия на слизистую оболочку желудка некоторых распространенных лекарственных препаратов (в частности, ацетилсалициловой кислоты и других нестероидных противовоспалительных средств). Напротив, синтетические аналоги простагландинов, обладающие цитопротективными свойствами и повышающие желудочное сли- зеобразование, позволяют предотвратить развитие поражения желудка при их приеме.
22.2.3. Патофизиологические механизмы язвенной болезни
Согласно современным представлениям, патогенез язвенной болезни в общем виде сводится к нарушению равновесия между факторами кислотно-пептической агрессии желудочного содержимого и элементами защиты слизистой оболочки желудка и двенадцатиперстной кишки, к которым относятся неизмененное желудочное слизеобразование, достаточная выработка панкреатических бикарбонатов, хорошая регенерация эпителиальных клеток, сохранное кровоснабжение слизистой оболочки желудка, нормальное содержание простагландинов в стенке желудка.
Гастродуоденальные язвы возникают как при усилении агрессивных свойств желудочного содержимого, так и при ослаблении защитных (цитопротективных) возможностей слизистой оболочки желудка и двенадцатиперстной кишки.
В последние годы важную роль в ослаблении защитных свойств сли^ зистой оболочки желудка и двенадцатиперстной кишки придают микроорганизмам Helicobacter pylori (HP), обнаруженным в 1983 г. австралийскими учеными Б. Маршаллом (В. Marshall) и Дж. Уорреном (J. Warren).
Спектр неблагоприятного влияния HP на слизистую оболочку желудка и двенадцатиперстной кишки достаточно многообразен. Эти бактерии вырабатывают целый ряд ферментов (уреаза, протеазы, фосфолипазы), повреждающих защитный барьер слизистой оболочки, а также различные цитотоксины. Наиболее патогенными являются Vac А-штамм HP, продуцирующий вакуолизирующий цитотоксин, приводящий к образованию цитоплазматических вакуолей и гибели эпителиальных клеток, и Сад А-штамм, экспрессирующий гён, ассоциированный с цитотоксином. Этот ген кодирует белок массой 128 кДа, который оказывает прямое повреждающее действие на слизистую оболочку.
HP способствуют высвобождению в слизистой оболочке желудка интерлейкинов, лизосомальных энзимов, фактора некроза опухолей, что вызывает развитие воспалительных процессов в слизистой оболочке желудка.
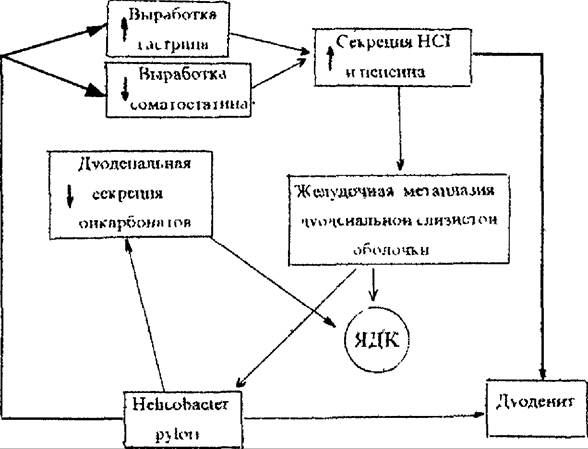
Патофизиологические механизмы развития язвы двенадцатиперстной кишки, которая в 95 % случаев оказывается ассоциированной с HP, представлены на схеме 22.2.
Обсеменение слизистой оболочки желудка HP сопровождается раз-
 t t t
Дополнительные факторы нчоиедслвмдоая предрасположи шосп. курение, V rptU, прием HI (ВС
t t t
Дополнительные факторы нчоиедслвмдоая предрасположи шосп. курение, V rptU, прием HI (ВС
|
Схема 22.2, Механизмы развития язвы двенадцатиперстной кицжи (ЯДК),
ассоциированной с Helicobacter pylori,
витием поверхностного антрального гастрита и дуоденита и ведет к повышению уровня гастрина с последующим усилением секреции соляной кислоты. Избыточное количество соляной кислоты, попадая в просвет двенадцатиперстной кишки, в условиях относительного дефицита панкреатических бикарбонатов способствует прогрессированию дуоденита и, кроме того, обусловливает появление в двенадцатиперстной кишке участков желудочной метаплазии (перестройки эпителия дуоденальной слизистой оболочки по желудочному типу), которые быстро заселяются HP. В дальнейшем при неблагоприятном течении, особенно при наличии дополнительных этиологических факторов (наследственная предрасположенность, 0(1) группа крови, курение, нервно-психическиестрессы и др.), в участках метаплазированной слизистой оболочки формируется язвенный дефект.
Однако связь возникновения язвенной болезни с инфицированнос- тью слизистой оболочки желудка HP выявляют не всегда. Примерно у 5 % больных с язвами двенадцатиперстной кишки и у 15—20 % больных с язвами желудка заболевание развивается без участия этих микроорганизмов.
К гастродуоденальным язвам, не ассоциированным с пилорическим HP, относятся в первую очередь эрозивно-язвенные поражения, вызванные приемом аспирина и других нестероидных противовоспалительных препаратов (НПВС). Повреждающему действию лекарственных препаратов также способствует присутствие HP, но язвы могут образовываться и без участия этих бактерий. Ведущую роль в их формировании играет снижение цитопротективных свойств слизистой оболочки, которое происходит в результате уменьшения синтеза простагландинов в желудке под влиянием НПВС. Не ассоциированными с HP являются также «стрессо- - вые» язвы, которые возникают у больных, находящихся в критических состояниях (при распространенных ожогах, тяжелых черепно-мозговых травмах, после^обширных полостных операций, особенно связанных с трансплантацией органов, и т.д.). Их развитию способствуют главным образом нарушения микроциркуляции в слизистой оболочке желудка, развивающиеся в указанных ситуациях. Особую группу гастродуоденаль- ных язв (иногда их называют симптоматическими) составляют язвенные поражения, возникающие в результате гиперсекреции соляной кислоты на фоне избыточной продукции гастрина (гастринома поджелудочной железы, или синдром Золлингера—Эллисона) или гистамина (карцино- идный синдром).
Доказана связь HP с развитием рака желудка кишечного типа, на основании чего эти бактерии были включены в группу канцерогенов I типа (облигатных). Онкогенгное действие HP обусловлено тем, что эти микроорганизмы могут изменять пролиферативную активность эпителиальных клеток слизистой оболочки желудка, способствуя развитию их метаплазии и атрофии. Кроме того, под влиянием HP в слизистой оболочке желудка образуется протеин р53, считающийся сильным канцерогеном, и снижается уровень аскорбиновой кислоты, являющейся важным ингибитором синтеза нитрозаминовых соединений, способствующих развитию рака желудка.
22.2.4. Нарушение двигательной функции желудка
У здорового человека натощак в желудке возникают периодические перистальтические сокращения его стенки продолжительностью около 20 с. Сразу же после приема пищи расслабляется фундальный отдел желудка (этот процесс называют аккомодацией); в результате желудок оказывается способным принять в себя достаточно большой объем пищи. Последующее перемешивание пищи с желудочным соком происходит с помощью перистальтических сокращений стенки желудка. Эвакуация пищи из желудка осуществляется благодаря градиенту давления, существующему между желудком и двенадцатиперстной кишкой. Скорость эвакуации зависит от консистенции и качественного состава пищи. Так, эвакуация жидкой пищи начинается практически сразу после ее приема; плотная пища сохраняется в желудке до 4—6 ч, при этом белки и углеводы покидают желудок быстрее, чем жиры.
В норме соотношение между моторно-эвакуаторной функцией желудка и секрецией соляной кислоты обратное: чем выше секреция соляной кислоты, тем ниже двигательная активность желудка, и наоборот. Важную роль в процессах эвакуации пищи из желудка играет так называемая антро-дуоденальная координация — синхронное расслабление привратника при сокращении антрального отдела желудка.
В регуляции моторно-эвакуаторной функции желудка участвуют симпатический и парасимпатический отделы нервнбй системы, а также гаст- роинтестинальные пептиды, например, секретин, желудочный ингибитор- ный пептид и холецистокинин тормозят моторику желудка. Стимуляция волокон блуждающего нерва приводит к усилению двигательной активности желудка, а стимуляция симпатической нервной системы — к торможению его моторики.
Нарушение моторики желудка разного генеза лежат в основе появления диспептических расстройств, часто встречающихся при гастроэнтерологических заболеваниях.
Так, расстройства аккомодации обусловливают возникновение та^ кого симптома, как раннее насыщение. Ослабление моторики антрального отдела желудка и нарушение антродуоденальной координации вызывают появление тяжести и чувства переполнения в подложечной области после еды. Изжога и ощущение горечи во рту часто отражают гаст- роэзофагеальный и дуоденогастральный рефлюксы. При этом нарушение моторики желудка может возникать как первично в результате расстройств нервной регуляции двигательной функции верхних отделов желудочно-кишечноготракта (идиопатический гастропарез, нервная ано- рексия), так и вторично вследствие различных заболеваний (например, при диабетическом гастропарезе, связанном с диабетической нейропа- тией) или оперативных вмешательств (постваготомический синдром).
Нехарактерным проявлениям вторичных нарушений моторики желудка и двенадцатиперстной кишки относится демпинг-синдром, развивающийся после операций — резекции желудка. Возникновение демпинг- синдрома обусловливается быстрым продвижением гиперосмолярного содержимого желудка в тонкую кишку. При этом вода пассивно переходит из плазмы в гиперосмолярную среду кишечника, способствуя развитию гиповолемии. Увеличение объема жидкости в кишечнике стимулирует выделение вазоактивных веществ (в частности, серотонина), вызывающих вазодилатацию и последующие ортостатические реакции (артериальная гипотензия, обморок). Наблюдающееся при демпинг-синдроме ускоренное всасывание глюкозы приводит к гипергликемии с вторичным повышением выработки инсулина. В результате происходит быстрая утилизации глюкозы крови, что обусловливает возникновение гипогликемии, проявляющейся слабостью, потливостью, тахикардией.
Проявлениями измененной Моторики желудка служат и такие симптомы, как тошнота и рвота. В то же времся конкретные причины развития указанных симптомов могут быть различны.
Рвота (vomitus, emesis) представляет собой сложный рефлекторный акт непроизвольного выбрасывания желудочного содержимого через пищевод, глотку, полость рта, носовые ходы, который осуществляется за счет усиленной перистальтики антрйльногб и пилорического отделов желудка при расслаблении фундального отдела, кардии и пищевода и одновременном сокращении мышц диафрагмы и брюшной стенки.
Сложный механизм рвоты регулируется специальным рвотным центром, расположенным в продолговатом мозге. Стимуляция рвотных центров происходит благодаря импульсам, передающимся с рецепторов слизистой оболочки, брюшины, почек и других органов, хеморецепторов триггерныхзон IV желудочка, афферентных волокон лабиринта и т.д. Возбудимость рвотного центра у людей различная. У женщин рвота возникает обычно легче, чем у мужчин, а у детей — легче, чем у взрослых.
В зависимости от ведущих патогенетических механизмов, лежащих в основе рвоты, выделяют рвоту центрального происхождения, гемато- генно-токсическую и рвоту висцерального происхождения.
Рвота центрального генеза обусловливается повышением внутричерепного давления и наблюдается, в частности, при опухолях головного мозга, гипертонических кризах, повышенной возбудимости лабиринтного аппарата (морская и воздушная болезнь). Иногда такая рвота имеет условно-рефлекторное происхождение и возникает при виде или ощущении неприятных предметов, запахов и т.д.
Гематогенно-токсическ&я рвота наблюдается при различных эндогенных и экзогенных интоксикациях, например, лекарственными препаратами (цитостатики, наркотические анальгетики), никотином, алкоголем, при нарушениях метаболизма (диабетический кетоацидоз), а также при лучевой болезни.
Рвота висцерального происхождения может возникать при раздражении слизистой оболочки желудка бактериальными токсинами, химическими веществами и, кроме того, при самых различных заболеваниях, причем необязательно гастроэнтерологических. Любая очень сильная боль (например, при почечной колике, болезнях органов малого таза) может рефлекторно вызвать появление рвоты.
Частая и обильная рвота приводит к развитию в организме тяжелых нарушений (дегидратация, гиповолемия, электролитные сдвиги), которые в свою очередь способны вызвать серьезные расстройства сердечной деятельности, функций почек и нервной системы. Кроме того, упорная рвота может осложниться аспирацией рвотных масс в бронхиальное дерево (синдром Мендельсона) и возникновением надрывов слизистой оболочки в области гастроэзофагеального перехода с последующим желудоч- но-кишечным кровотечением (синдром Маллори—Вейсса).
Тошнота (nausea) представляет собой тягостное ощущение приближения рвоты, сопровождающееся чувством давления в подложечной области, а нередко и разнообразными вегетативными нарушениями (слабость, потливость, головокружение, гиперсаливация). В основе появления тошноты лежит подпороговое,т.е. недостаточное для возникновения рвоты, возбуждение рвотного центра-
i
22.3. Патофизиологические механизмы болей в животе
Слизистая оболочка желудка и кишечника не содержит болевых рецепторов и не реагирует на раздражения (в частности, укол), вызывающие, например, болевые ощущения в коже. В связи с этим биопсия слизистой оболочки желудка или полипэктомия не сопровождаются в отличие от биопсии кожи ощущением боли. Окончания болевых рецепторов, ин- нервирующих полые органы, локализуются в их мышечной стенке, поэтому адекватные раздражения висцеральных болевых нервных волокон возникают либо при растяжении полых органов (например, при метеоризме), либо при интенсивных спастических сокращениях (желчная колика, кишечная колика), либо при непосредственном воздействии раздражителя (соляная кислота) на нервные окончания, расположенные в дне язвенного дефекта.
В паренхиматозных органах (печень, селезенка, почки) нервные окончания располагаются в капсуле и реагируют на ее растяжение при увеличении органа. При этом увеличение органа и растяжение капсулы дблжны происходить очень быстро, поскольку при постепенном увеличении адекватного раздражения болевых рецепторов капсулы не возникает. Снижению порога чувствительности болевых рецепторов может способствовать также воздействие на нервные окончания различных биологически активных веществ и медиаторов, выделяющихся при воспалении, таких, как серотонин, гистамин, лейкотриены, простагландины и др.
Ишемия органов брюшной полости ведет к возникновению абдоминальных болей за счет повышения концентрации тканевых метаболитов в области чувствительных нервов. Болевые нервные волокна содержатся в адвентиции сосудов, поэтому растяжение сосудистой стенки (например, при аневризме брюшного отдела аорты) также способно стать причиной болевых ощущений. Наконец, боль в животе может быть в результате непосредственного инфильтрирования нервных окончаний растущей опухолью (например, при распространении рака поджелудочной железы в ретроперитонеальное пространство).
В зависимости от ведущего патофизиологического механизма выделяют 3 основных типа абдоминалгий.
Висцеральная боль, обусловливаемая раздражением рецепторов в стенке полых органов, возникающим при их спазме или растяжении, обычно тупая и не имеет строгой локализации. При поражении непарных органов она проецируется ближе к средней линии выше (желудок, двенадцатиперстная кйшка, желчный пузырь, поджелудочная железа) или ниже пупка {мочевой пузырь). Этим можно объяснить своеобразие некоторых клинических симптомов: так, боль при желчной колике локализуется не в области правого подреберья (как было бы логично предположить), а в подложечной области.
Париетальная или соматическая боль возникает при раздражении париетального листка брюшины и более четко локализуется соответственно анатомическому положению органа. В связи с этим при остром холецистите, при котором в процесс вовлекается брюшина, покрывающая желчный пузырь, боль локализуется в области правого подреберья. Подобная миграция боли характерна и для воспаления червеобразного отростка (острый аппендицит): боль, первоначально локализованная в эпигастрии или околопупочной области (висцеральные боли за счет растяжения червеобразного отростка), при вовлечении в процесс брюшины перемещается затем в правую подвздошную область.
Наконец, отраженная боль наблюдается при заболеваниях органов, локализованных вне брюшной полости. Возникающая при этом передача болевых ощущений от различных органов (в частности, грудной клетки) на центральные пути афферентных нейронов создает картину боли в тех или иных областях живота. Классическими примерами отраженной боли служат болевые ощущения в правой половине живота при острой правосторонней нижнедолевбй пневмонии, а также описанная В.П. Образцовым и Н.Д. Стражеско в 1909 г. абдоминальная (гастралгическая) форма инфаркта миокарда.
Дата добавления: 2015-02-05; просмотров: 1036;
