Бадмаев Б.Ц. 11 страница
22.4. Нарушение экзокринной функции поджелудочной железы
Экзокринная функция поджелудочной железы включает в себя выработку пищеварительных ферментов в ацинозных клетках, а также секрецию воды и электролитов (преимущественно бикарбонатов), осуществляемую главным образом эпителиальными клетками панкреатических протоков. Жидкая часть секрета, содержащая НС03", обеспечивает транспортировку панкреатических ферментов в двенадцатиперстную кишку и защищает их от расщепления соляной кислотой желудочного сока, обеспечивая при рН 7—8 их оптимальную активность. Снижение выработки панкреатических бикарбонатов (например, при хроническом панкреатите) приводит, кроме того, к ацидификации (закислению) дуоденального содержимого, способствуя тем самым развитию язвенных поражений (так называемых панкреатогенных язв). Общий объем панкреатической секреции достигает 2,5 л в сутки.
В поджелудочной железе вырабатывается большое число различных ферментов, необходимых для переваривания белков, жиров и углеводов. Так, протеазы (трипсин, химотрипсин, эластаза, карбоксипепти- даза, калликреин) расщепляют белки на олигопептиды; липолитические ферменты (липаза, колипаза, фосфолипазаА2и карбоксилэстергидрола-
за) эмульгируют капельки жира в присутствий желчных кислот и расщепляют триглицериды и холестерин на моноглицериДЫ и жирные кислоты; амилаза участвует в переваривании крахмала и гликогена, превращая эти углеводы в ди- и олигосахариды.
Существуют различные стимуляторы панкреатической секреции. При этом вазоинтестинальный пептид (ВИП) и секретин оказывают стимулирующее влияние за счет активации аденилатциклазы и последующего образования цАМФ, который в свою очередь активирует протеинкиназу А. Другие стимуляторы (ацетилхолин, холецистокинин, субстанция Р) воздействуют на специфические рецепторы, в результате чего увеличивается внутриклеточное содержание промежуточных «мессенджеров» (ино- зитол-трифосфата, Са++ и др.), также активирующих различные протеинкиназы. Тормозящее влияние на панкреатическую секрецию оказывают панкреатический полипептид, соматостатин, глюкагон, энкефа- лины и другие нейропептиды,
Регуляция внешнесекреторной функции поджелудочной железы представлена на схеме 22.3. В межпищеварительный период уровень секреции панкреатических ферментов, а также воды и электролитов очень невелик, составляя соответственно 10 и 1—2 % от их максимально возможной продукции. Пищеварительная секреция поджелудочной железы включает в себя несколько фаз.
Цефалическая фаза инициируется представлениями о пище, ее ви-
| Секреция фермеггтов | |||
| Ам и л ол итичсс и не | Лннолитпческие | ||
| Протеолптнческис |

| Кишечная фаза |
| Секреция бикарбонатов |
| Цефалическая фаза Желудочная фаза -представления о пище -растяжение -пил пищи желудка -запах пищи -ВКУС 1ШИ1Г1 |
- трипсин -оеамилаза - липаза
-химотрипсин -колипаза
-эластаза -фосфолипаза А2
■ карбокашептидаза ' -карбоксилэстср-
-калликрени гид рол а л а
Схема 22.3. Регуляция внешнесекреторной функции поджелудочной железы.
527
дом, запахом и вкусом. Их возбуждающее влияние реализуется через ветви блуждающего нерва и приводит к значительному увеличению секреции бикарбонатов и умеренному повышению выработки панкреатических.фер- ментов.
Желудочная фаза включается — через ваго-вагальные рефлексы — в ответ на растяжение пищей фундального иантрального отделов желудка, приводящее к освобождению ацетилхолина и секретина и последующему значительному увеличению продукции панкреатических ферментов и очень умеренному повышению секреции бикарбонатов.
Интестинальная (тонкокишечная) фаза панкреатической секреции наиболее значима. В физиологических условиях она сопровождается повышением кровотока в поджелудочной железе и выработкой панкреатического секрета с очень высоким содержанием ферментов. Выраженное стимулирующее действие на секрецию поджелудочной железы (в большей степени — панкреатических ферментов, в меньшей — бикарбонатов) оказывают продукты расщепления жиров, в частности, жирные кислоты. Этот эффект опосредуется через высвобождение секретина, ацетилхолина и холецистокинина. Соляная кислота, попадая в двенадцатиперстную кишку, приводит к ацидификации дуоденального содержимого, вследствие чего включается ваго-вагальный энтеро-панкреатический рефлекс с последующим высвобождением ацетилхолина и секретина, способствующим выраженному повышению секреции бикарбонатов и умеренному увеличению выработки панкреатических ферментов. Наконец, пептиды и аминокислоты, также вызывая ваго-вагальный рефлекс и при их приеме в большом количестве повышая освобождение холецистокинина, приводят к значительному увеличению выработки панкреатических ферментов и очень умеренному возрастанию секреции панкреатических бикарбонатов.
Нарушение регуляции различных фаз панкреатической секреции (например, усиленная стимуляция внешнесекреторной функции поджелудочной железы ацетилхолином, соляйОй кислотой, холецистокинином и панкреозимином) может приводить к развитию повреждения паренхимы поджелудочной железы. Это, в частности, находит свое отражение при воспроизведении различных экспериментальных моделей острого панкреатита у животных. Однако конкретное значение указанных нарушений в развитии заболеваний поджелудочной железы у человека остается пока еще недостаточно изученным.
22.4.1. Патофизиологические механизмы развития острого панкреатита
В физиологических условиях существуют защитные механизмы, предохраняющие поджелудочную железу от самопереваривания образующимися в ней ферментами. Это прежде всего выработка панкреатических протеаз в виде проферментов, которые активируются энтерокиназой только в двенадцатиперстной кишке. Плотные контакты апикальных частей ацинозных клеток между собой препятствуют рефлюксупищеваритель- ных ферментов в межклеточное пространство. Лизосомы ацинарных клеток также надежно защищены от возможного воздействия на них панкреатических ферментов. Наконец, ингибиторы панкреатической секреции, действующие по принципу обратной связи, предупреждают избыточную выработку пищеварительных ферментов поджелудочной железой.
Острый панкреатит представляет собой острое воспаление поджелудочной железы, в основе которого лежит массивный аутолиз ациноз- ных клеток и которое характеризуется типичными клиническими проявлениями, а также повышением уровня панкреатических ферментов в крови и моче.
Частой (40 %) причиной острого панкреатита служит желчнокаменная болезнь. В таких случаях билиарный панкреатит развивается вследствие повышения давления в панкреатических протоках при прохождении конкремента через большой дуоденальный сосочек. Определенную роль играет также рефлюкс в панкреатические протоки желчи и дуоденального содержимого. У 30 % больных возникновение острого панкреатита обусловливается приемом алкоголя, который, стимулируя секрецию ферментов поджелудочной железы, одновременно вызывает спазм сфинктера Одди, способствуя, таким образом, повышению давления в панкреатических протоках. Значительно реже острый панкреатит развивается в результате травм, операций, некоторых диагностических манипуляций (эндоскопическая ретроградная холангиопанкреатография), гиперлипи- демии и ряда других заболеваний.
Возникающая в результате различных причин гипертензия главного панкреатического протока приводит к разрыву мелких панкреатических протоков и выделению панкреатического секрета в паренхиму поджелудочной железы с последующей активацией панкреатических ферментов и самоперевариванием паренхимы поджелудочной железы. Ключевую роль в этих процессах играет преждевременное образование трипсина, который в дальнейшем активирует другие проферменты поджелудочной железы. Активация фосфолипазы А2 способствует превращению лецитина, входящего в состав клеточных мембран, в лизолецитин, оказывающий цитотоксичное действие, Кроме того, трипсин обеспечивает превращение проэластазы в эластазу, калликреиногена — в калликреин с последующим образованием кининов (брадикинина), тромбопластина — в тромбин. Активация указанных вазоактивных веществ ведет в дальнейшем к развитию выраженных системных микроциркуляторных расстройств. Важную роль в развитии острого панкреатита играют также лизосомальные гидролазы ацинозных клеток, активирующие при их высвобождении панкреатические ферменты. Комплекс нарушений, возникающих при наиболее тяжелой форме острого панкреатита — панкреонекрозе — ведет к возникновению тяжелых осложнений.
Центральное место в цепочке развертывающихся событий занимает экссудация плазмы в ретроперитонеальное пространство (за короткое время в нем может скопиться до 8 л жидкости). В результате потери жидкости возникает гиповолемический шок, ведущий в свою очередь к развитию острой почечной недостаточности. Одновременно с жидкостью теряются альбумины и электролиты (в частности, кальций) Накапливающиеся в крови в результате панкреонекроза токсины вызывают интер- стициальный отек легких с последующим нарастанием явлений острой дыхательной недостаточности (респираторный дистресс-синдром взрослых). Прогрессированию данного осложнения способствует и фосфоли- паза А2, обладающая способностью снижать активность сурфактанта.
Интоксикация и гипоксия обусловливают развитие энцефалопатии. Появление рвоты и паралитической кишечной непроходимости вследствие токсемии гипокалиемии, утяжеляют гиповолемию. Дефицит инсулина приводит к появлению гипергликемии. При снижении фибринолиза и активации тромбопластических факторов создаются условия для возникновения синдрома диссеминированного внутрисосудистого свертывания. Присоединение инфекции, чаще вызываемой грамотрицательными бактериями, ведет к развитию септических осложнений, значительно ухудшающих прогноз. Летальные исходы, частота которых при остром некро- тизирующем панкреатите достигает 30 %, бывают чаще всего обусловлены системными осложнениями заболевания (гиповолемический шок, острая почечная недостаточность) или же развитием перитонита.
22.4.2. Патофизиологические механизмы развития хронического панкреатита
Хронический панкреатит представляет собой хроническое воспаление поджелудочной железы, сопровождающееся развитием фиброза и снижением ее экзо- и эндокринных функций. Главной причиной возникновения хронического панкреатита (в 75 % случаев) служит злоупотребление алкоголем. Ежедневный прием 40—80 г алкоголя в пересчете на чистый спирт в течение 10 лет может способствовать развитию хронического панкреатита. Второй по частоте причиной хронического панкреатита является желчнокаменная болезнь. К редким формам заболевания относятся хронический тропический панкреатит, распространенный преимущественно в Индии, Индонезии, странах Центральной Африки и обусловленный недостаточным питанием, а также наследственный хронический панкреатит, передающийся по аутосомно-доминантному типу и встречающийся главным образом в детском и юношеском возрасте.
Патогенез хронического алкогольного панкреатита представлен на схеме 22.4.
Злоупотребление алкоголем повышает уровень белка и снижает содержание воды и бикарбонатов в панкреатическом секрете, что вызывает его сгущение и образование в мелких протоках поджелудочной железы белковых преципитатов с их последующей кальцификацией. Возникающая обструкция панкреатических протоков приводит к нарушению оттока секрета, расширению протоков, воспалительным изменениям с развитием атрофии ацинусов и склероза паренхимы поджелудочной же-
 Схеме 22.4. Патогенез хронического панкреатита.
Схеме 22.4. Патогенез хронического панкреатита.
|
лезы.
Кроме того, алкоголь оказывает и прямое повреждающее действие на ацинозные клетки и эпителий панкреатических протоков, что отчасти связано с отсутствием в поджелудочной железе фермента алкогольде- гидрогеназы, разрушающей алкоголь. В настоящее время определенная роль в развитии кальцифицирующей формы хронического панкреатита придается снижению уровня литостатина — белка, вырабатывающегося в поджелудочной железе и препятствующего образованию белковых преципитатов. На месте участков некроза паренхимы, а также в результате расширения панкреатических протоков могут образовываться псевдокисты, способные в ряде случаев (обычно при их значительном размере) приводить к различным осложнениям (кровотечение, разрывы, абсцеди- рование и др.). Кроме того, наличие хронического панкреатита повышает риск развития рака поджелудочной железы.
Выраженный фиброз паренхимы поджелудочной железы и сформировавшиеся псевдокисты могут обусловить возникновение экзокринной и эндокринной панкреатической недостаточности. При этом в наибольшей степени страдает переваривание липидов, что способствует-возник- новению диареи с высоким (более 7 г в сутки) содержанием нейтрального жира в кале, называемой стеатореей. Стеаторея не относится к ранним проявлениям внешнеоекреторной панкреатической недостаточности и развивается лишь в тех случаях, когда в поджелудочной железе остается менее 10 % функционирующих клеток. Выраженная стеаторея может привести к значительной потере массы тэла. Повышение давления в панкреатических протоках, а также вовлечение в воспалительный процесс нервных окончаний, иннервирующих поджелудочную железу, являются причиной появления упорной опоясывающей боли в животе. Нарушение оттока желчи, возникающее при сдавлении общего желчного протока увеличенной и уплотненной вследствие фиброза головкой поджелудочной железы, может сопровождаться желтухой,
Расстройства углеводного обмена также являются поздним симптомом хронического панкреатита и возникают только при утрате более 80% островковых клеток поджелудочной железы. В отличие от первичного сахарного диабета эти нарушения углеводного обмена, как правило, не бывают тяжелыми.
22.5. Нарушение функций кишечника
I
Функции кишечника могут нарушаться вследствие многих органических заболеваний и приводить к серьезным изменениям функций различных органов и систем. В некоторых случаях эти нарушения возникают вследствие расстройства нервной регуляции моторики тонкой и толстой кишки и тогда имеют достаточно благоприятный прогноз.
22.5.1. Нарушение переваривания и всасывания в кишечнике
Основные процессы переваривания и всасывания белков, жиров и углеводов происходят в тонкой кишке. Общая поверхность эпителиальных клеток слизистой оболочки тонкой кищки (энтероцитов), обеспечивающих эти функции, значительно возрастает за счет многочисленных микроворсинок, расположенных на апикальном участке энтероцитов и образующих так называемую щеточную каемку. Микроворсинки покрыты гликокаликсом, состоящим из мукополисфсаридов. Внутри гликокаликса находятся ферменты, вырабатываемые эитероцитами для окончательного расщепления и всасывания питательных веществ.
Сложные процессы всасывания в кишечнике протекают с участием ряда механизмов. К основным из них прежде всего относятся активный транспорт, который обеспечивает перенос веществ против градиента их концентрации и потому оказывается энергозавиримым (с помощью активного транспорта всасываются аминокислоты, моносахариды, витамин В12), и пассивный (в виде диффузии и осмоса), который происходит в соответствии с градиентом концентрации веществ в кишечнике и крови (таким путем всасываются вода, хлориды, аскорбиновая кислота).
Продукты переваривания белков панкреатическими ферментами — олигопептиды — расщепляются в дальнейшее зкзо- и эндопептидазами микроворсинок энтероцитов в просвете кишечника до ди- и трипептидов, которые всасываются затем с помощью активного транспорта. Последующее расщепление олигопептидов до аминокислот завершается уже внутриклеточными (цитозольными) пептидазами энтероцитов.
Олигосахариды, образовавшиеся из крахмала под действием амилазы, а также содержащиеся в пищи сахароза и лактоза расщепляются в тонкой кишке до моносахаридов высокоспецифичными дисахаридазами щеточной каемки (сахаразой, лактазой, мальтазой и др.). Глюкоза и галактоза всасываются с помощью активного №+-зависимого транспорта, а фруктоза — посредством диффузии.
Липиды, поступившие в двенадцатиперстную кишку и эмульгированные желчными кислотами, расщепляются в дальнейшем под действием липолитических ферментов поджелудочной железы (липаза, колипаза, фосфолипаза А2) до жирных кислот, лизолецитина и холестерина После этого жирные кислоты с короткими и средними цепями непосредственно диффундируют в энтероциты. Жирные кислоты с длинными цепями и холестерин переносятся к мембране энтероцитов в виде мицелл, образованных ими с желчными кислотами, после чего захватываются и переносятся специальными транспортными белками. Параллельно с всасыванием жиров происходит и всасывание жирорастворимых витаминов.
Вода и электролиты способны перемещаться через стенку кишечника в обоих направлениях, поддерживая таким образом изоосмотичность кишечного содержимого и плазмы крови. Большая часть воды и электролитов всасывается в верхних отделах тонкой кишки, причем вода пассивно диффундирует в направлении гиперосмотичного содержимого, тогда как всасывание натрия происходит по механизму активного транспорта. По мере продвижения содержимого по кишечнику концентрация натрия в нем уменьшается. При этом изоосмотичность содержимого тонкой кишки поддерживается за счет поступления в ее просвет эквимолярного количества ионов калия. Энтероциты, кроме того, сами обладают способностью секретировать электролиты (в основном бикарбонаты и ионы хлора).
Комплекс расстройств, возникающих в организме в результате нарушения процессов переваривания и всасывания, получил название синдрома малъабсорбции (от франц. mal — болезнь).
Синдром мальабсорбции может развиваться при различных пато[ логических состояниях. В первую очередь к ним относятся заболевания, протекающие с недостаточной выработкой тех или иных пищеварительных ферментов: хронический панкреатит, дисахаридазная (чаще всего лактазная) недостаточность, болезни печени и желчевыводящих путей, сопровождающиеся снижением поступления желчи в кишечник. Сравнительно большую группу составляют заболевания, при которых поражается эпителий слизистой оболочки тонкой кишки: целиакия (глютеновая энтеропатия, развивающаяся вследствие наследственно обусловленного снижения активности пептидаз тонкой кишки, расщепляющих белок злаковых культур глиадин), амилоидоз кишечника, лимфомы тонкой киш
ки, радиационный энтерит, поражения слизистой оболочки тонкой кишки при иммунодефицитных состояниях и др. К развитию синдрома мальаб- сорбции могут привести операции, в частности, обширные резекции желудка и тонкой кишки (особенно с удалением очень важных в функциональном отношении отделов — тощей и подвздошной кишки), синдром избыточного роста бактерий (усиленное размножение бактерий в тонкой кишке, возникающее, например, при синдроме короткой кишки или наличии тонко-толстокишечных свищей).
Развитие синдрома мальабсорбции обусловливает комплекс расстройств, характер которых представлен на схеме 22.5. Основным проявлением этих расстройств являются диарея. Накопление в просвете кишечника невсосавшихся осмотически активных веществ, например углеводов, лежит в основе синдрома диареи. Непереваренные жиры гид- роксилируются в просвете толстой кишки бактериями, в результате чего стимулируется секреторная активность колоноцитов. Возникающее со- путствуйэщее поражение тонкой кишки способствует нарушению всасывания натрия и воды в кишечнике и повышению секреции хлоридов. При синдроме мальабсорбции объем стула обычно значительно увеличивается (полифекалия).
| Схема 22.5. Нарушение гомеостаза при синдроме мальабсорбции. |
Недостаточное поступление в организм питательных веществ приво-
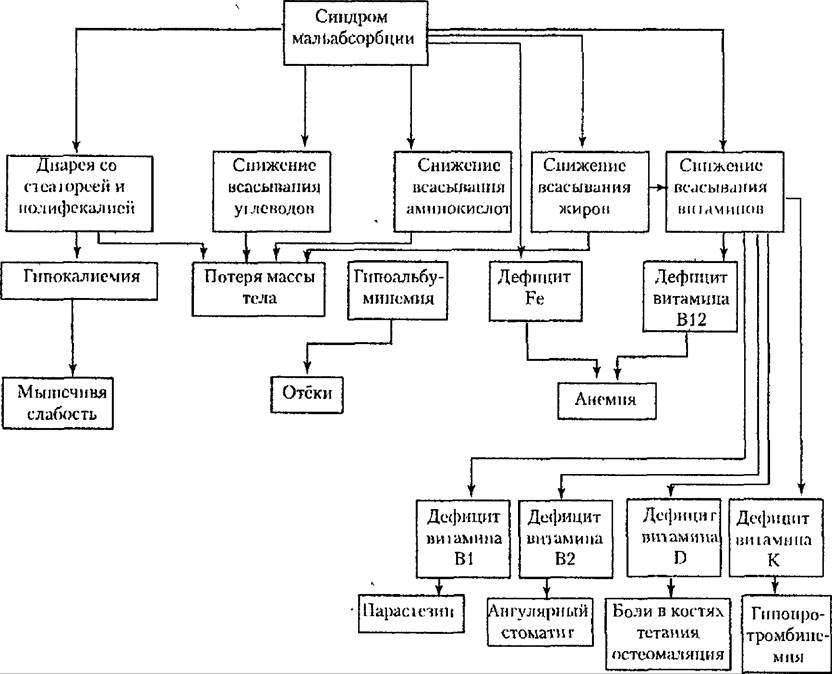
|
дит к прогрессирующей потере массы тела. Уменьшение содержания альбуминов в крови (помимо уменьшения всасывания, этому в ряде случаев может способствовать и увеличенная потеря белка желудочно-кишечным трактом) обусловливает снижение онкотического давления плазмы и приводит к появлению отеков. Снижение всасывания железа и витамина В12 способствует возникновению анемии. У многих больных развивается дефицит различных витаминов, в частности жирорастворимых (А, К, Е, D) и витаминов группы В. При длительном и тяжелом течении синдрома маль- абсорбции прогрессирует кахексия, присоединяются признаки полиглан- дулярной недостаточности (надпочечников, половых желез), возникает мышечная атрофия.
22.5.2. Нарушения двигательной функции кишечника
В физиологических условиях формы двигательной активности кишечника различные. Так, маятникообразные сокращения, захватывающие короткие сегменты тонкой и толстой кишки, обеспечивают попеременное перемещение кишечного содержимого в дистальном и проксимальном направлениях, за счет чего достигается равномерное перемешивание химуса и всасывание содержащихся в нем ингредиентов. Пропульсивные перистальтические волны способствуют поступательно- му продвижению содержимого по кишечнику в сигмовидную и прямую кишку. Последующее растяжение каловыми массами прямой кишки вызывает не только раздражение рецепторов ее стенки, которое передается в аноспинальный центр дефекации, контролируемый головным мозгом, но и ответную эфферентную импульсацию, обеспечивающую расслабление внутреннего анального сфинктера.
Моторика тонкой и толстой кишки регулируется межмышечными и подслизистыми нервными сплетениями и, кроме того, находится под сложным гормональным контролем. При этом возбуждение парасимпатических нервных волокон оказывает на моторику кишечника стимулирующий эффект, а активация симпатических влияний — тормозящий. Врожденное отсутствие межмышечного и послизистого нервных сплетений в различных по своей протяженности участках прямой и сигмовидной кишки (болезнь Гиршпрунга) приводит к длительному тоническому сокращению пораженного сегмента кишки при одновременном исчезновении пропульсивной перистальтики с последующим выраженным престеноти- ческим расширением толстой и прямой кишки (мегаколон и мегаректум) и отсутствием нормальной дефекации.
Нарушение двигательной функции кишечника, приводящее к ускорению или замедлению пассажа содержимого, обусловливает появление таких симптомов, как понос (диарея) и запор (обстипация). Патофизиологические механизмы возникновения этих симптомов при различных заболеваниях могут быть неодинаковыми.
Под диареей понимают обычно учащенное (как правило, более 2—3 раз в сутки) опорожнение кишечника с выделением жидких или кашицеобразных испражнений. При этом следует иметь в виду, что и ежедневный однократный стул (но более жидкой, чем в норме, консистенции) также может быть вариантом диареи, тогда как стул с частотой 3—4 раза в день, при котором кал остается оформленным, напротив, не будет считаться поносом. Главным признаком диареи является повышение содержания воды в кале с 60—75 до 85—95 %. Часто в качестве характерной особенности диареи указывают увеличение общей массы кала — более 200 г в сутки (по- лифекалия). Однако и этот признак встречается при диареи далеко не всегда. Так, при функциональной диарее (синдром раздраженного кишечника) суточная масса кала будет меньше 200 г, тогда как при питании преимущественно растительной пищей более высокая масса кала (300— 400 г) возможна и при нормальном характере стула. В зависимости от ведущего патофизиологического механизма выделяют различные виды диареи.
В основе секреторной диареи лежит усиленная секреция натрия и воды в просвет кишечника. Этот вариант диареи наблюдается при действии на слизистую оболочку тонкой кишки бактериальных (при холере) или вирусных энтеротоксинов; при опухолях, выделяющих полипептидные гормоны, усиливающие кишечную секрецию (например, ВИП-проду- цирующая опухоль поджелудочной железы [випома], секретирующая ва- зоинстинальный пептид). Для секреторной диареи характерно более низкое осмолярное давление кишечного содержимого по сравнению с осмоляр- ным давлением плазмы и в отличие от других видов диареи выраженность секреторной диареи не уменьшается при голодании.
Гиперосмолярная (осмотическая) диарея является ведущим признаком синдрома мальабсорбции. Невсосавшиеся растворимые вещества (например, углеводы при дисахаридазной недостаточности) повышают осмолярность кишечного содержимого и таким образом препятствуют всасыванию воды. Сходным действием обладают со/1евые слабительные (сульфат натрия), антациды (содержащие гидроокись магния), сорбит. Осмотическое давление кишечного содержимого при гиперосмолярной диареи выше осмотического давления плазмы. Осмотическая диарея уменьшается или прекращается при голодании.
Гиперкинетическая диарея обусловливается повышенной перистальтической активностью кишечника (прежде всего при нарушении его нервной регуляции) и особенно часто встречается у больных с синдромом раздраженного кишечника и у пациентов с тиреотоксикозом. При этой форме диареи осмолярность кала соответствует осмолярности плазмы.
Экссудативная диарея возникает в результате выделения в просвет кишечника воспалительного экссудата с примесью белка, крови или слизи, увеличивающего объем каловых масс и содержание в них жидкости. Экссудативная диарея встречается при острых кишечных инфекциях (дизентерия, сальмонеллез), хронических воспалительных заболеваниях кишечника (неспецифический язвенный колит, болезнь Крона), ишеми- ческом колите, псевдомембранозном колите, вызываемом микроорганизмами Clostridium difficile (например, при бесконтрольном приеме антибиотиков). При этой форме диареи осмотическое давление каловых масс
обычно выше осмотического давления плазмы.
Своеобразным вариантом диареи являются ложные (запорные) поносы (парадоксальная диарея), возникающие при сужении просвета толстой кишки в результате опухолевого поражения. В основе парадоксальной диареи лежит компенсаторная кишечная гиперсекреция, облегчающая продвижение каловых масс через суженный участок кишечника.
Иногда при одном и том же заболевании сочетаются различные патофизиологические механизмы диареи, например, диарея при СПИДе, являющаяся одним из основных симптомов данного заболевания, может быть связана как с «оппортунистическими» инфекционными возбудителями (криптоспоридии, цитомегаловирус), развитием специфической ВИЧ-ассоциированной энтеропатии, протекающей с проявлениями синдрома мальабсорбции, так и со способностью вируса иммунодефицита человека — аналогично холерному вибриону — резко усиливать процессы секреции воды и электролитов в кишечнике и доводить таким образом объем каловых масс больного СПИДом до 12—14 л в сутки.
Последствием диареи может быть развитие (особенно часто у детей) дегидратации и тяжелых электролитных нарушений. Именно эти нарушения, возникающие при инфекционной диарее, служат причиной ежегодной гибели во всем мире более 4 млн детей в возрасте до 5 лет.
Под запором понимают задержку опорожнения кишечника до 48 ч и более. Запоры относятся к числу наиболее распространенных нарушений двигательной функции кишечника; ими страдают примерно 15 % всего взрослого населения и до 30 % лиц пожилого и старческого возраста. Причины и механизмы возникновения запоров разнообразны.
Достаточно часто встречаются алиментарные запоры, обусловленные недостаточным содержанием в пищевом рационе растительной клетчатки, голоданием, уменьшением потребления жидкости. Нормальный дефекационный рефлекс возникнет только в том случае, если объем каловых масс, вызывающих растяжение прямой кишки и возбуждение рецепторов ее стенки, будет большим. В свою очередь объем кишечного содержимого зависит от содержания в пище балластных веществ (пустых клеточных оболочек растений), связывающих воду и таким образом увеличивающих общую массу кала. Питание легкоусвояемой пищей, не содержащей клетчатки, приводит к уменьшению объема каловых масс, который оказывается недостаточным для возбуждения дефекационного рефлекса.
С ослаблением дефекационного рефлекса связаны и так называемые привычные запоры, которые возникают при некоторых ситуационных обстоятельствах, когда человек в силу различных причин (неподходящая обстановка, спешка, плохие санитарно-гигиенические условия и т.д.) вынужден подавлять позывы на дефекацию. Следует иметь в виду, что в норме у большинства людей стул бывает после завтрака, что связано с рефлекторным усилением пропульсивной моторики толстой кишки (так называемый желудочно-толстокишечный рефлекс). Слишком легкий завтрак может вызвать подавление этого рефлекса и обусловить возникновение запора. Развитию привычных запоров способствуют также малоподвижный образ жизни, необходимость длительного соблюдения постельного режима, ослабление мышц брюшного пресса (у пожилых и тучных людей).
Нередко наблюдаются нейрогенные запоры, обусловленные нарушением нервной регуляции функции кишечника. Они встречаются, в частности, у больных с синдромом раздраженного кишечника при спастических сокращениях толстой кишки (спастические запоры) или снижении ее моторики (атонические запоры). Тяжелые запоры нейрогенноге происхождения возможны при различных поражениях головного и спинного мозга (травмы, опухоли, нарушения мозгового кровообращения).
Дата добавления: 2015-02-05; просмотров: 1243;
