Бадмаев Б.Ц. 14 страница
Локальная ишемия может быть причиной острого тубулярного некроза при васкулитах, злокачественной гипертензии, а также при преэк- лампсии, остром отторжении трансплантата, сепсисе, гепаторенальном синдроме.
Целесообразность использования понятия «острый тубулярный некроз» признана в тех случаях, когда характер изменений биохимических показателей крови и мочи свидетельствует о тяжелом повреждении канальцевой системы почек.
Нефротоксическое влияние чаще обусловлено действием антибиотиков (аминогликозиды), рентгеноконтрастных веществ, химиотерапев- тических средств, цитостатиков. В последние годы значительно расширился перечень этиологических факторов, ведущих к рабдомиолизу или обструкции канальцев другого генеза (гемоглобинурия, уратная нефро- патия).
Современное представление о патогенезе ОПН основано главным образом на результатах экспериментальных данных: ишемической модели — наложение зажима на почечную артерию или введение норадреналина; нефротоксической модели (аминогликозиды, хлористая ртуть), миоглобинурической модели (глицерол).
Независимо от характера этиологического фактора повреждение нефрона при ОПН зависит от развития гипоксии или аноксии клеток канальцев, клеток сосудистого эндотелия и гладких мышц сосудов.
При ОПН в результате прекращения (или снижения) кровоснабжения почек нарушается клиренс отдельных веществ и
реабсорбционная функция канальцев.
Патогенез ишемнческой ОПН. Гипоперфузия почек является пусковым механизмом развития ОПН. На ранних стадиях ишемия обусловливает комплекс биохимических изменений в эпителии канальцевых клеток, и в эндотелии сосудов (схема 24.3). В зависимости от продолжительности ишемии и баланса между тяжестью повреждения и компенсаторной возможностью внутриклеточных механизмов достигается опреде- ленный функциональный дисбаланс, определяющий дальнейшее прогрессирование или восстановление функций клеток.
Прекращение или уменьшение доступа кислорода к клетке, прежде всего, приводит к нарушению функций митохондрий в связи с нарушением синтеза аденозинтрифосфата (АТФ). АТФ снабжает клетки энергией, поэтому падение АТФ прямо или косвенно вызывает повреждение клетки. Например, снижение АТФ регулирующей функцию Na+, К+ аденозин-
Повреждающие факторы и медиаторы повреждения
ИШЕМИЯ
Клетки сосудов (эндотелия и гладких мышц) Клетки канальцев
I
____ . Дисфункция
| Внутриклеточная защита |
Дезорганизация
Повре>одение мембран
▼
Падение АТФ Гидролиз фосфолипидов Дезорганизация цитоскелета Отек клетки
Нарушение кальциевого статуса


| Сдавление канальцев после диффузии гломерулярного фильтра |
| Восстановление потенциальных возможностей к регенерации |
| Гликолиз Глицин Внутриклеточный ацидоз Глютатион Антиоксидантные ферменты Белки теплового шока Гипотермия |
| П р о д о лжа ю щая с я обструкция и/или отсутствие регенерации |
Реактивные кислородные радикалы Протеолиз Повреждение нуклеиновых кислот Гипертермия
Острое или подострое падение эффективной скорости клубочковой фильтрации и функции реабсорбции
▼ V
Потеря массы нефронов Сохранение массы нефронов
и падение скорости и нормальная скорость
клубочковой фильтрации, клубочковой фильтрации хронизация процесса
Схема 24.3. Патогенез ишемической ОПН. [модифицированная схема по J. Weinberg: The principes and practice of nephrology /
Ред. H. Jacobson etal. — Mosby, 1995].
трифосфотазы приводит к увеличению внутриклеточного Na+, потере К+, деполяризации клеточной мембраны, притоку воды в клетку.
Падение АТФ вызывает также изменение кальциевого статуса в клетке, поскольку нарушается выкачивание кальция из клетки и увеличивается цитозольный кальций. Увеличение цитозольного кальция может активировать процесс расщепления внутриклеточных белков, липидов, нуклеиновых кислот и обусловить нарушение цитоскелета клетки.
Ишемическое повреждение эндотелия способствует увеличению проницаемости эндотелия, диффузии плазмы и повышению вязкости кро
ви в сосудах почек. Наряду с этим ишемия влияет на гладкомышечные клетки сосудов, вызывая дисбаланс между продукцией медиаторов, обусловливающих вазоконстрикцию и вазодилатацию, и способствуя нарушению регуляции внутрипочечного сосудистого тонуса (и, таким образом, потере функциональной интеграции нефрона).
Продолжающаяся гипоперфузия ссопроввождается прогрессирующим повреждением клеток проксимальных канальцев и последующим нарушением канальцевой реабсорбции и секреции. Расстройства функций обнаруживают и в дистальных канальцах, включая толстый восходящий сегмент петли Генле. Необратимые изменения или некроз клеток вызывают увеличение проницаемости плазменной части мембраны клетки и развитие закупорки просвета канальцев продуктами распада клеток, образовавшимися цилиндрами, диффузии гломерулярного фильтрата в интерстиций.
Последствиями этих процессов являются сдавление канальцев отечным интерстицием с повреждением апикальной части клеток канальцев, дисфункция канальцев, увеличение внутриканальцевого давления, потеря эпителиального барьера и уменьшение скорости гломерулярной фильтрации.
Нарушение функций почек при ишемической ОПН. В течение острой почечной недостаточности выделяют три стадии:
• начальная;
• стадия олигоанурии;
• стадия восстановления диуреза.
Выделение стадий при ОПН условно. В последние годы доказана возможность развития ОПН без олигурии, т.е. выделена так называемая не о- лигурическая форма 0/7Н, для которой характерны менее тяжелое повреждение клеток и лучший прогноз,
Тяжесть функциональных расстройств при ОПН определяется тяжестью повреждения системы канальцев и степенью нарушения СКФ.
Начальная стадия (от нескольких часов до нескольких суток) редко распознается, хотя именно в этот период имеется максимум возможностей для восстановления функций почек, если будут распознаны и удалены этиологические факторы. Распознавание ранней стадии ОПН в клинике возможно при проведении квалифицированной оценки факторов, потенциально способных вызвать ОПН, так как признаки нарушения функций почек могут отсутствовать. При тщательном контроле СКФ на ранней стадии ОПН можно зарегистрировать только нерезкое падение скорости клубочковой фильтрации и в некоторых случаях обнаружить повышение в крови азотистых шлаков.
Вторую стадию обозначают как стадию схабилизации повреждения почек. Продолжительность второй стадии 10—14дней, при тяжелых формах ОПН и при присоединении осложнений — до 6 недель. В этот период наблюдают значительное падение почечного кровотока, однако отмечена его региональная неоднородность. Почечный кровоток наружной медуллярной зоны снижается до 10 20 %от нормы, в то время как почечный кровоток внутренней медуллярной зоны увеличивается, поэтому кортикальный почечный кровоток умеренно снижается — до 50 % от нормы. Скорость клубочковой фильтрации в этот период может падать ниже 5—10 мл/мин и при тяжелом течении ОПН низкий уровень СКФ может сохраняться в течение 2 нед или более.
Несоответствие между характером изменения почечного кровотока и степенью снижения СКФ свидетельствует об участии разных механизмов в развитии этих расстройств. Предполагают, что падение СКФ при ише- мической ОПН связано с нарушением интеграции тонуса афферентной и эфферентной артериолы, регулирующего внутригломерулярное перфузи- онное давление и последующим изменением коэффициента ультрафильтрации, а также вызвано обструкцией канальцев, выходом канальцевой жидкости и повышением внутриканальцевого давления.
В период второй стадии при олигурической ОПН наблюдается падение диуреза (ниже 400 мл/сут) с последующим нарушением функций проксимальных канальцев, развитием дисфункций дистальных канальцев, включая толстый сегмент петли Генле. Нарушается реабсорбция натрия, хлоридов, бикарбонатов, концентрация натрия в моче увеличивается до 40 мэкв/л, хотя определяется низкий удельный вес мочи и низкая осмоляль - ностьмочи.
Нарушение функции разведения и концентрирования мочи обусловлено расстройством концентрационной способности дистальных канальцев, частично вследствие потери их чувствительности к АДГ.
Третья стадия — стадия выздоровления характеризуется восстановлением диуреза или развитием полиурии.
Восстановление диуреза предшествует повышению скорости клубочковой фильтрации, хотя в течение последующих нескольких дней падает концентрация в крови креатинина и СКФ достигает нормальных величин в течение 2—4 нед.
Увеличение СКФ в эксперименте обычно регистрируют через 24—48 ч после восстановления диуреза. Восстановление канальцевых и клубочко- вых функций происходит асинхронно, с умеренным повышением СКФ в течение 1—2 нед и затем более медленным восстановлением канальцевых функций.
Нарушение концентрационной функции почек и способности к под- кислению мочи может сохраняться длительный период (годы), несмотря на восстановление диуреза, поэтому в течение некоторого периода необходим тщательный мониторинг содержания натрия и калия в моче.
Биохимические показатели при ОПН. Характерным для ОПН является значительное увеличение концентрации креатинина и азота мочевины в крови, однако не всегда степень повышения этих веществ в крови адекватна степени снижения СКФ, например, при состояниях с повышенным катаболизмом (сепсис, диабет) или применении некоторых лекарств (кортикостероиды) возможно увеличение концентрации азота мочевины при нормальной скорости СКФ. Повышение содержания креатинина — бо^ лее адекватный показатель снижения СКФ при ОПН и только в редких случаях (например, ОПН вследствие рабдомиолиза) может значительно возрастать уровень креатинина в крови без сопутствующего снижения СКФ.
Развитие метаболического ацидоза при ОПН обусловлено нарушением экскреции нелетучих кислот, которые в норме ежедневно продуцируются в организме в результате метаболизма пищевых белков. Ацидозу при ОПН сопутствует накопление в сыворотке отрицательно заряженных анионов, фосфатов и сульфатов. Содержание бикарбонатов в сыврротке у больных ОПН падает до 1 —2 мэкв/л, а при усилении катаболических процессов (например, при сепсисе) регистрируется более резкое падение бикарбонатов в крови. При различных формах ОПН развитие метаболического ацидоза могут определять разные механизмы. Так, при диабетической нефроп^тии возможны кетоацидоз и лактикоацидоз.
Метаболический ацидоз при ОПН может обусловить развитие дыхания Куссмауля и ряд метаболических и гемодинамических расстройств, например депрессию миокарда с развитием гипотензии, резистентность к инсулину, увеличение катаболизма белков.
Расстройство водно-электролитного баланса при ОПН способствует к задержке жидкости и гиперволемии, связанной с нарушением экскреции воды и солей. При неолигурической ОПН наблюдается менее резкое расстройство водно-электролитного баланса, однако неадекватное введение жидкости в этих случаях также может обусловить быстрое развитие гиперволемии.
Гиперкалиемия при ОПН может быть следствием нарушения способности почек адекватно экскретировать калий, но не всегда проявляется клинически, поскольку она может быть компенсирована функцией дисталь- ных канальцев, а также зависеть от наличия или отсутствия олигурии, Изменения на ЭКГ регистрируются при значительном увеличении содержания калия в сыворотке — выше 6 ммоль/л, При некоторых формах ОПН содержание калия может сохраняться на нормальном уровне или даже пониженным, например, при неолигурической форме нефротоксической ОПН, вызванной цисплатином.
Осложнения при ОПН определяются тяжестью расстройств функций сердечно-сосудистой системы (сердечная недостаточность вследствие гиперволемии, аритмии), патологией крови (анемия, нарушение функций тромбоцитов под влиянием увеличения оксида азота и др. причин), неврологическими расстройствами (мышечные подергивания, судороги, уремическая энцефалопатия).
Присоединение инфекций — самая частая причина смерти пациентов ОПН, и связано с подавлением иммунных функций — хемотаксиса нейтрофилов, относительной лимфопенией и нарушением клеточно опосредованной иммунной защиты.
24.6. Хроническая почечная недостаточность
Хроническая почечная недостаточность (ХПН) — синдром, развивающийся вследствие постепенного снижения функций почек, обусловленного прогрессирующей гибелью нефронов. ХПН — в большинстве случаев необратимый процесс.
Термин «уремия» обычно используют для обозначения конечной стадии ХПН, когда определяется комплекс биохимических и патофизиологических расстройств и особенно выражены клинические проявления «уремического отравления».
Причины ХПН. Хроническая почечная недостаточность — исход многих болезней почек, чаще исход гломерулонефрита; к ХПН могут привести интерстИциальные болезни почек, урологическая патология, поли- кистоз почек, амилоидоз и диабетическая нефропатия, стеноз почечной артерии, системные болезни и др. В последние годы отмечено учащение ХПН как исхода токсического воздействия лекарств.
Стадии ХПН. При медленном прогрессировании ХПН целесообразно выделить три стадии, которые в определенной степени отражают тяжесть расстройств функций почек. Первая стадия характеризуется падением скорости клубочковой фильтрации до 50 % от нормы, т.е. клиренс креатинина составляет 50—60 мл/мин. В этот период у пациентов сохраняется способность поддерживать жизненно важные функции — выделять воду, органические вещества без существенного изменения диеты. При уменьшении массы нефронов и снижении скорости клубочковой фильтрации в крови прежде всего накапливаются соединения, баланс которых поддерживается уровнем клубочковой фильтрации — т.е. азотистые шла- ки, креатиНин и(в меньшей степени) мочевина. На ранних стадиях ХПН отмечают нерезкое увеличение этих веществ в крови. Возможно эпизодическое повышение их концентрации при воздействии некоторых отягощающих факторов (инфекция, кровотечение или потеря жидкости).
Первую стадию ХПН обозначают как стадию снижения почечного резерва, т.е. стадией снижения способности к максимально достигаемому уровню клубочковой фильтрации.
Вторая стадия соответствует снижению СКФ на 75 % от нормы или клиренсу креатинина 20—30 мл/мин. В этот период содержание азотистых шлаков в крови значительно увеличивается. Однако при стабилизации СКФ на уровне 25 мл/мин не всегда регистрируют признаки нарушенного гомеостаза и могут наблюдаться периоды кратковременного снижения концентрации азотистых шлаков. Нарастание тяжести ХПН (снижение СКФ до 10—15 мл/мин) сопровождается высокой азотемией, расстройством водно-электролитногобаланса, нарушением концентрирования мочи, гиперволемией, гиперкальциемией, гиперфосфатемией и развитием метаболического ацидоза.
Дальнейшее прогрессирование ХПН приводит к третьей стадии или стадии уремии, когда клиренс креатинина падает ниже 15 мл/мин, выражены высокая трудно корректируемая азотемия, расстройство функций многих органов и систем.
Темпы прогрессирования ХПН зависят от характера основного заболевания, адекватности лечения и состояния индивидуальных адаптационных механизмов, оценка которых сопряжена с определенными трудностями. Например, отмечены возможность многолетнего сохранения гомеостаза при ХПН и проявление выраженных расстройств лишь в терминальную стадию болезни; в то же время описано развитие анемии на ранних стадиях ХПН.
Адаптация нефронов к снижению функции почек. Изменение функций почек при ХПН определяется соотношением областей сохранившихся нефронов и областей нефункционирующих нефронов.
Гиперфункция остаточных нефронов и сохранение согласованности функций клубочков и канальцев (гломерулярно-тубулярный баланс) ответственны за сохранение гомеостаза в течение определенного периода при ХПН.
Скорость клубочковой фильтрации. Характер патологического процесса, обусловившего ХПН, может влиять на степень вовлечения гло- мерул и темпы прогрессирования ХПН. Например, если уменьшить массу почечной ткани нефрэктомией, скорость клубочковой фильтрации в каждом из оставшихся нефронов повышается в 2—3 раза. При патологических процессах, вызвавших распространенное поражение гломеруляр- ного аппарата (например, гломерулонефрит), скорость клубочковой фильтрации в остаточных нефронах будет разной, и зависит от степени вовлечения гломерул: в сохраненных или минимально пораженных гло- мерулах СКФ повышается, в то время как в других — более пораженных, уменьшается или сохраняется на нормальном уровне.
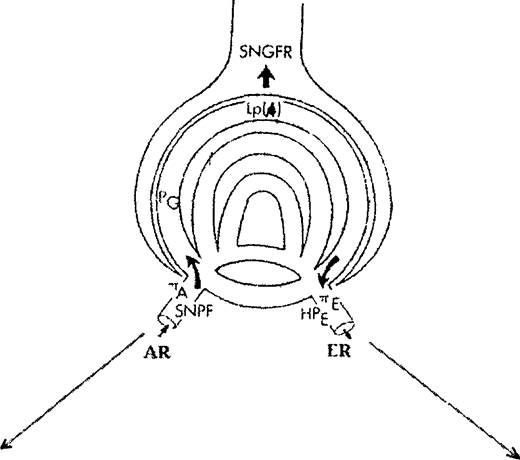
Компенсаторное увеличение СКФ в остаточных нефронах обусловливается влиянием нескольких факторов (рис. 24.2) — повышением плаз- мотока в клубочках вследствие дилатации афферентной артериолы, увеличением внутригломерулярного давления при наличии дилатации афферентной артериолы и одновременной констрикции эфферентной артериолы и наряду с этим увеличением коэффициента ультрафильтрации, связанного (предположительно) с адаптивной гипертрофией клубочков, увеличивающих фильтрующую поверхность или с увеличением гидравлической проводимости капилляров остаточных гипертрофированных нефронов.
Положительный эффект адаптационного повышения СКФ в остаточных нефронах проявляется увеличением клиренсатоксичныхх веществ. Однако, как свидетельствуют экспериментальные и клинические данные, ги- перфильтрация остаточных нефронов может привести к усилению склеротических процессов в почках и, в свою очередь, способствовать прогрессированиюХПН.
Данные по этой проблеме противоречивы, и предстоит выяснить, каков должен быть характер адаптационных механизмов нефрона, обеспечивающих длительное сохранение гомеостаза.
При ХПН наблюдается интенсификация «работы» канальцев почек, однако функция канальцев зависит от уровня СКФ в остаточных нефро-
|
| I SNGFR i SNPF t AR f ER t ДР Xor 44 LPA |
| t SNGFR t SNPF iAR = ER t ДР -or I LPA |
А Б*
Нис. 24.2. Ультрафильтрация при уменьшении массы нефронов (А)
и при гломерулонефрите (Б). Скорость клубочковой фильтрации в отдельном нефроне (SNGFR) определяется показателями: скоростью плазмотока в отдельном нефроне (SNPF), градиентом гидростатического давления в гломерулах(ДР), системнымонкотическим давлением (яА, яЕ), коэффициентом ультрафильтрации (LPA), который зависит от эффективной площади гломерулярных капилляров и общей гидравлический проводимости стенок гломеруляр- ных капилляров. Скорость плазмотока в отдельном нефроне определяется резистентностью афферентной артериолы (AR) и резистентностью эфферентной артериолы (ЕЙ); гидростатическим давлением в гломерулярных капиллярах (PG) и гидростатическим давлением в эфферентной артериоле (НРЕ) [Модифицированная схема по R.C. Blantz, F.B. Gabbai: The Principles and Practice of
Nephrology / Ред. И. Jacobson et al. — Mosby, 1995.
нах. Частично клубочково-канальцевый баланс достигается физическими силами перитубулярных капилляров, действующих на уровне эпителия проксимальных канальцев, уменьшение или увеличение реабсорбции связано с сопутствующим изменением СКФ в соответствующих остаточных не- фронах.
Механизмы, мобилизующие адаптивные функции канальцев, не ясны. Полагают, что некоторые из них связаны с влиянием гуморальных факторов, например, усилением секреции альдостерона (усиление выведения камня) или увеличением высвобождения паратгормона (ингиби- ция реабсорбции фосфатов).
При нарастании тяжести ХПН нарушается функция концентрирования и разведения мочи, хотя не меняется способность к модуляции сек
реции АДГ. Нарушение концентрационных способностей почек связано с дезорганизацией мозгового слоя почки и расстройством функции проти- воточной множительной системы концентрирования мочи, и наряду с этим с развитием осмотического диуреза в остаточных нефронах, обусловленного увеличением фильтруемой нагрузки мочевиной и падением канальцевой реабсорбции натрия и воды. По мере нарастания концентрации растворенных веществ в канальцевой жидкости осмолярность выделяемой мочи увеличивается в разведенной моче и уменьшается в концентрированной моче, и в результате осмолярность мочи становится равной таковой в плазме лишенной белка (1008—1010), т.е. развивается изостенурия.
В этих условиях адекватность экскреции растворенных веществ зависит от объема экскреции воды. Если пациент потребляет меньше воды, чем это необходимо для обеспечения скорости движения воды, у него развивается дегидратация и гипернатриемия. Если пациент потребляет больше воды, чем требуется для адекватного выведения растворенных веществ, у пациента развивается водная «интоксикация» и гипон&триемия.
Баланс натрия при ХПН. Уменьшение массы функционирующих нефронов, гиперперфузия остаточных нефронов и потребность к чрезмерной мобилизации резервных возможностей почек при ХПН приводят к снижению адаптации канальцев к нагрузке натрием, и, таким образом, снижению способности почек экскретировать солевую нагрузку.
Если потребление солей превышает способность канальцев экскретировать натрий, содержание натрия в плазме повышается и развивается синдром гиперволемии. В то же время при ХПН нарушается способность сохранять натрий и резкое ограничение потребления натрия может вызвать гиповолемию и падение артериального давления. При далеко зашедшей стадии ХПН реабсорбция натрия подавлена постоянно, поскольку в этих условиях менее выражена восприимчивость систем транспорта натрия к колебаниям концентрации натрия в просвете канальцев.
Гиперкалиемия при ХПН. При падении функции почек для увеличения экскреции калия необходимо усиление процесса секреции калия канальцами остаточных нефронов. Это достигается повышением мине- ралокортикоидной активности.
Концентрация калия в плазме может сохраняться при ХПН на нормальном уровне достаточно длительный период, однако гиперкалиемия может возникнуть внезапно, если нарушается механизм экскреции калия дистальными канальцами в связи с уменьшением скорости мочеотделения или нарушением достатки натрия.
Гиперкалиемия при ХПН мбжет быть вызвана бесконтрольным приемом калийсберегающих диуретиков, ингибиторов ангиотензинпревра- щающего фермента, (32-блокаторов, нестероидных противовоспалительных препаратов.
При снижении СКФ до 40 мл/мин нарушается экскреция аммония, что способствует задержке ионов водорода и развитию хронического метаболического ацидоза.
Концентрация бикарбонатов в сыворотке редко падает ниже 12 мэкв/ л, благодаря буферной способности костных тканей. Соотношение анионов изменяется в сторону увеличения концентрации неизмеряемых анионов — фосфатов, сульфатов, уратов, анионов гиппурата, поэтому возможно увеличение показателя «anion дар».
Развитие второй и третьей стадий ХПН сопровождается нарушением продукции некоторых гормонов, главным образом эритропоэтина и витамина D3, Недостаток эритропоэтина — главная причина анемии при ХПН. Плазма уремических больных содержит значительно меньше эритропоэтина по сравнению с плазмой пациентов с анемией другого генеза. В костном мозге пациентов с анемией при ХПН отсутствуют гиперпролифе- ративные процессы в отличие от пациентов с анемией другого происхождения.
При ХПН нарушается образование 1,25-гидроксихолекальциферо- ла — метаболита витамина D3 (в норме он образуется в клетках проксимальных канальцев с помощью фермента 1-а-гидроксилазы), что является причиной нарушения минерализации костей в связи с развитием вторичного гиперпаратиреоза и остеодистрофии. Гиперпаратиреоз при ХПН связан также с потерей способности почек поддерживать баланс фосфатов. При значительном снижении СКФ реабсорбция фосфатов падает с 90 % до 15 % и увеличивается экскреция фосфатов. Это стимулирует гиперсекрецию паратгормона, вызывающего задержку фосфатов, что обусловливает снижение уровня ионизированного кальция в плазме и усиление проявлений вторичного гиперпаратиреоза.
Для ХПН характерно расстройство обмена глюкозы, развивается потеря чувствительности тканей к инсулину. Продукция глюкоза и процесс усвоения глюкозы печенью остаются в норме. При падении СКФ ниже 10— 5 мл/мин снижается клиренс инсулина, и поэтому у некоторых больных диабетом исчезает потребность в инсулине.
При ХПН накапливается в кро?и большое количество пептидныхгормонов — гастрина, глюкагона, гормона роста, лютеинизирующегогормона, фолликулостимулирующего гормона, клиническое значение которых вариабельно.
Содержание гормона роста нередко повышено при ХПН, поскольку падает скорость его распада, однако у детей может наблюдаться задержка роста в связи с нарушением питания, ацидозом и остеодистрофией.
Уремические токсины. Поиску уремическихтоксинов уделено много внимания, хотя проблема патогенетической роли уремических токсинов при ХПН остается дискуссионной.
Предположение о существовании «уремических токсинов» поддерживается клиническими наблюдениями, свидетельствующими о клиническом улучшении и обратимости многих биохимических показателей после гемодиализа.
Уремический синдром — результат влияния многих факторов, действующих на вне- и внутриклеточную среду. Снижение экскреторной функции почек ведет к накоплению токсичных веществ, органических и неорганических, которые нарушают механизмы, регулирующие функцию клетки.
57 г
Терминальной стадии ХПН сопутствует нарушение транспорта ионов. Уменьшение активности Na+, К+аденозинтрифосфатазы, эритроцитов, клеток скелетных мышц, островковых клеток поджелудочной железы вызывает деполяризацию мембраны и увеличение в клетках Na+, Са++. Полагают, что расстройство транспорта ионов при ХПН составляет основу «уремического отравления».
Признано, что «уремическое отравление» может быть результатом взаимодействия разных соединений плазмы, не токсичных по природе, но оказывающих токсический эффект при взаимодействии с другими веществами, например,при карбомаилировании.
К уремическим токсинам в последние годы относят мочевину, гуа- нидин, мионозитол, р2-микроглобулин, «средние молекулы», парат гормон, микроэлементы.
Мочевина спонтанно расщепляется до цианата, концентрация которого может быть высокой, и в эксперименте на животных продемонстрирован токсический эффект цианата. Однако в клинике токсический эффект мочевины более очевиден только при быстром повышении концентрации мочевины в крови.
Токсический эффект гуанидинов и мионозитола продемонстрирован в эксперименте на животных, но не доказан их токсический эффект in vivo.
При ХПН меняется кишечная бактериальная флора, что способствует накоплению алифатических аминов, таких как диметиламин. Выделение паров диметиламина при дыхании может усилить одышку у больных ХПН и вызвать дыхание «рыбы, выброшенной на берег».
Не все функции полиаминов при ХПН выяснены, но установлено, что эти вещества могут стимулировать синтез РНК и ДНК, регулировать активность ферментов, способствовать клеточному росту и влиять на эрит- ропоэз.
Концепция «средних молекул» не получила клинического подтверждения, хотя исследования в этом направлении продолжаются, не определена также химическая структура «средних молекул».
В последние годы к «главным» уремическим токсинам относят па- ратиреоидный гормон (паратгормон). При второй и третьей стадиях ХПН наблюдается гиперсекреция или стимуляция его высвобождения в связи с влиянием различных факторов: метаболического ацидоза, недостатка витамина D3, гипокальциемии и гиперфосфатемии. Избыток паратгормо- на при ХПН способствует накоплению внутриклеточного кальция, который ингибирует окислительный процесс в митохондриях и генерацию АТФ. Уменьшение активности Na+, К+-аденозинтрифосфатазы ведет к гипер- калиемии и увеличению внутриклеточного натрия, уменьшению потенциала покоя клеточной мембраны, нарушению цитоскелета и обмена фос- фолипидов.
В эксперименте метаболические нарушения, вызванные па- ратгормоном, можно предотвратить паратиреоидэктомией, однако паратиреоидэктомия у человека не влияет на обратимость указанных нарушений.
Уремическая стадия характеризуется расстройством функций многих органов и систем: сердечно-сосудистой, эндокринной, нервной системы (уремическая энцефалопатия и периферическая нейропатия), поражением желудочно-кишечного тракта (гастрит, энтероколит, желу- дочно-кишечное кровотечение), системы гемостаза (изменение функций тромбоцитов) и гемопоэтической функции.
Сердечно-сосудистые осложнения — самая частая причина смерти больных ХПН.
Задержка воды и солей с последующей гиперволемией и увеличением минутного объема сердца — основные факторы, способствующие развитию артериальной гипертензии при ХПН.
Дата добавления: 2015-02-05; просмотров: 1066;
