Бадмаев Б.Ц. 5 страница
Р102 = (РЬ — 47) х F102,
где РЬ — барометрическое давление, 47 мм рт.ст. — давление водяных паров, a F^ — процентное содержание кислорода во вдыхаемом воздухе.
Если в норме при дыхании атмосферным воздухом РА02 = 150 — 40/ 0, 8 = 100 мм рт.ст., то у пациента с РаС02 60 мм рт.ст., РА02 = 150 — 60/ 0,8 = 75 мм рт.ст. При нормальной альвеолярно-артериальный разнице по кислороду (10—20 мм рт.ст.) парциальное напряжение кислорода в артериальной крови в этом случае снизится до 55—65 мм рт.ст. Гипоксемия в этом случае будет легко корригироваться кислородотерапией. Следует учитывать, что в ряде случаев, например при нарушении центральной регуляции дыхания, когда вентиляция легких стимулируется исключительно гипоксемией, может отмечаться декомпенсация газообмена вплоть до полной остановки дыхания при назначении кислорода даже в небольших дозах. Вдыхание кислорода в этом случае будет подавлять инспираторную активность дыхательного центра, усугубляя дальнейшую задержку С02.
Наконец, увеличение парциального напряжения двуокиси углерода приводит к снижению рН артериальной крови (респираторный ацидоз). В редких случаях компенсаторная гиповентиляция наблюдается в ответ на метаболический алкалоз. При острой гиповентиляции рН снижается от нормального уровня (7,40) на 0,0075 при превышении нормального РаС02 на 1 мм рт.ст., т.е. при острой задержке С02 с повышением РаС02 с 40 до 60 мм рт.ст. можно ожидать снижения рН приблизительно до 7,25. Если же ретенция углекислоты развивается постепенно, происходит лишь незначительное изменение рН. Причиной этого является компенсаторная задержка бикарбонатов почками в ответ на повышение РС02 в клетках канальцев почек.
Выраженный респираторный ацидоз обычно сочетается с метаболическим ацидозом, что обусловлено образованием избытка молочной кислоты в результате уменьшения доставки кислорода к тканям. У больных, которые находятся на ИВЛ, снижение до'ставки кислорода иногда усугубляется высоким внутригрудным давлением, создаваемым респиратором, которое уменьшают венозный возврат, сердечный выброс и, следовательно, периферический кровоток.
Задержка углекислоты вызывает увеличение мозгового кровотока, головную боль и повышение внутричерепного давления. Мозговые симптомы гиперкапнии обычно сочетаются с признаками гипоксемии и проявляются в виде беспокойства, тремора, спутанной речи, неустойчивости поведения. Высокий уровень С02 обладает наркотическим действием и приводит к нарушению сознания — оглушению, сопору и коме. Единственно эффективным средством коррекции этих нарушений является искусственная вентиляция легких.
Глава 19. Патологическая физиология крови
19.1. Основы регуляции клеточного цикла
Кровь — существует в виде жидкого компонента и солидных образований. Жидкая ее часть — собственно кровь — состоит из клеточного и неклеточного отделов. Солидная часть представлена кроветворными органами, определяющими ее клеточный состав (костный мозг, лимфатические узлы, вилочковая железа), очагами скопления форменных элементов в других местах (пейеровы бляшки кишечника и пр.) и органом, где происходит разрушение отдельных форменных элементов крови (селезенка). Считается, что крови присущи три функции — транспортная, определяющая перенос кислорода, энергетического и пластического материала, а также, регулирующих субстанций — гормонов и некоторых биологически активных субстанций к отдельным клеткам организма и удаление от них продуктов метаболизма (углекислого газа и пр.); защитная, характеризующаяся проявлениями клеточного и гуморального иммунитета, и функция поддержания гомеостаза, т.е. обеспечения поддержания постоянства внутренней среды организма. Последняя функция крови несколько неотчетлива.
Кровь — это среда, представляющая возможность клеткам
организма осуществлять процессы их жизнедеятельности.
Раздел «Патологическая физиология крови» имеет целью рассмотреть те ее изменения, отличия от ее нормальных констант, которые происходят вследствие болезней или различных жизненных ситуаций. При анализе изменений клеточного состава крови следует иметь в виду, что они должны рассматриваться с учетом показателей периферической крови, состояния продуцирующих органов и органов, где происходит ее разрушение.
Форменные элементы крови, подразделяющиеся в периферической крови на ядросодержащие (это практически исключительно клетки лейкоцитарного ряда) и безъядерные — гемоглобинсодержащие клетки (эритроциты) и пластинкообразные клетки (тромбоциты), берут свое начало исключительно в структурах костного мозга длинных костей конечностей, черепа, тел позвонков, грудины, ребер, таза. Ежесуточно костный мозг вырабатывает около 3,7х1011 клеток крови. Происходя из полипотентной стволовой клетки, каждая клетка крови также проходит стадии предшественников полиолигопотентного и монопотентного ком- митированного. Но в этих стадиях клетки еще не имеют характерных отличительных признаков и являются морфологически нераспознаваемыми. Однако все они способны формировать колонии подобных себе клеток как in vivo, так и in vitro, получив название «колониеобразующих единиц — КОЕ».
На основании анализа клеточного состава и численности клеток в колонии делается вывод о количестве делений, временных параметрах клеточного цикла и количестве каждого из видов морфологически не распознаваемых клеток клонируемой популяции. На сегодня известно, что до появления зрелой клетки крови в эритроидном ряду происходит до 12 делений, 9 из которых приходятся на морфологически не распознаваемые клетки. В гранулоцитарном ряду также происходит 10 делений, и лишь 4 последних осуществляются морфологически распознаваемыми клетками, Аналогичная картина наблюдается и при формировании моноцита и тромбоцита. Продолжительность клеточного цикла различных клеток крови колеблется от 13 ч для эритробласта до 116 ч для миелобласта.
Продолжительность существования различных клеток в кровотоке также различна, колеблясь от 120 сут для эритроцитов до 7—12 ч для зрелых нейтрофилов, базофилов и эозинофилов. Тромбоциты, образующиеся из цитоплазмы мегакариоцитов путем отшнуровки, живут в крови до 10 сут. После достижения зрелости почти все клетки крови перед тем, как попасть в кровоток, некоторое время находятся в костном мозге. Примечательно, что многие из них там и разрушаются, не достигнув крови. Гибель нейтрофилов в костном мозге составляет около 90 %. Недостаточно точно известно время жизни клеток крови после того, как они попадают в ткани. Моноциты там даже продолжают развиваться, превращаясь в макрофаги, в виде которых функционируют еще неопределенное время. На современном этапе достаточно много известно о том, каким образом осуществляется регуляция отдельных фаз развития клеток крови. Клеточный цикл находится под контролем генов и регулируется как на транскрипционном, так и на посттрансляционном уровне.
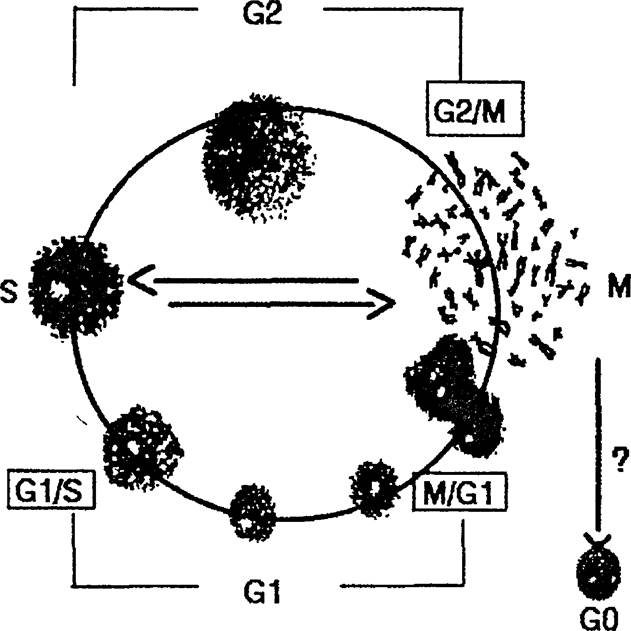
Существенную роль в формировании сигнальной информации играют процессы фосфорилирования и дефосфорилирования специфических аминокислотных остатков. В норме стадия митоза (М) и стадия синтеза ДНК-пролиферирующих соматических клеток (S-фаза) разделены премитотической и постсинтетической стадиями интерфазы — G1 и G2. Границы стадий четко фиксируются в точках M/G1, G1/S и G2/M. Наиболее полно изучен генетический контроль перехода клетки из поздней интерфазы G2 в митоз (рис. 19.1). Гены контроля клеточного деления функционируют, кооперируясь друг с другом. Их транскрипты — белки с молекулярной массой от 13 до 115 кД фазово-специфически модифицируются в клеточном цикле, фосфорилируясь рядом киназ и дефосфори- лируясь фосфатазами. Они определяют размеры клеток в митозе, координируя их рост. Фаза митоза контролируется специфическим белковым комплексом размерами 220—250 кД, получившего название М-киназы. Субстратами этого фермента являются такие белки, как c-src, bcl-2, RB1 -
Рис. 19.1. Клеточный (митотический) цикл пролиферирующих соматических клеток.
oabl, p-53, а также крупные ядрышковые белки — нуклеолин, нуклеофозмин и фибриллярин. Модификация генетических факторов транскрипции может нарушать дифференци- ровку клеток и создавать базу для их злокачественной трансформации.
Патологическими отклонен иями в системе крови считаются увеличение или уменьшение количественного состава отдельных клеток крови, а также изменения их соотношения относительно друг друга или же изменения их формы.
Отклонением от нормы считается также стойкое появление в периферической крови таких клеток, которые там отсутствуют, но которые постоянно можно обнаружить в костном мозге. С целью лучшего анализа перечисленной патологии принято рассматривать отклонения в отдельных ростках кроветворения раздельно друг от друга.
19.2. Патология красной крови
В норме поддерживается постоянство морфологического и биохимического состава крови. Эритроциты, как и все живые клетки, подвержены старению и гибели, поэтому для поддержания эритроцитарного баланса необходимо постоянное образование новых эритроцитов.
Активность процесса размножения и созревания клеток красной крови определяется содержанием в крови эритропоэтинов. Эритропоэ- тины усиливают процессы деления и созревания эритроидных клеток костного мозга, а также стимулируют захват этими клетками железа.
|
Клеткой-предшественницей зрелого безъядерного эритроцита является ретикулоцит. Название этой клетки происходит от содержащейся в ней сетчатой субстанции, представляющей собой конгломерат рибосо- мальных белков, выявляемых как артефакт при суправитальной окраске этих клеток специальным красителем. В норме содержание ретикулоци- тов в периферической крови — 0,2—1,2 % (2—12%о)- Подсчет числа этих клеток в крови имеет важное диагностическое значение при оценке функ
ции костномозгового кроветворения. Активная регенерация костного мозга сопровождается увеличением содержания ретикулоцитов в крови (ретикулоцитозом), гипо- и арегенераторные состояния — снижением их содержания (ретикулоцитопения) вплоть до полного исчезновения из крови. До 10—15 % эритроцитов гибнет в костном мозге.
19.2.1. Анемии
Анемия — состояние, характеризующееся уменьшением (по сравнению с нормой) количества эритроцитов или гемоглобина, или того и другого в единице объема крови. Нормальными показателями эритроцитов считаются (4,8±0,6)х1012/л у женщин и (5,5±0,9)х1012/л у мужчин. Нормальные показатели гемоглобина составляют 140±20 г/л для женщин и 160±20 г/л для взрослых мужчин. Об анемизации в некоторой степени можно судить на основании изучения показателей гематокрита, т.е. объема, занимаемого клеточной частью крови. В норме гематокрит составляет 42,0±5,0 % для женщин и 47,0±5,0 % для мужчин.
При оценке основных гематологических показателей больных анемиями, помимо количества гемоглобина и числа эритроцитов, необходимо принимать во внимание качественные изменения в самих эритроцитах: средний диаметр (СДЭ) и наличие регенеративных элементов красной крови — ретикулоцитов. Если большинство эритроцитов у больного анемией имеет СДЭ 7—8 мкм, такая анемия классифицируется как нормо- цитарная. Для микроцитарных анемий характерно преобладание в крови эритроцитов с СДЭ меньше 6—7 мкм, для макроцитарныханемий — СДЭ, превышающий 9—11 мкм, для мегалоцитарных анемий — СДЭ 12—13 мкм и выше.
Математическим отражением размеров всей популяции эритроцитов в крови (с учетом различного их диаметра) служит кривая Прайса- Джонса, показывающая частоту встречаемости эритроцитов различного диаметра у конкретного человека.
Кроме того, важной качественной характеристикой системы эритроцитов является цветовой показатель, свидетельствующий о степени насыщения эритроцитов гемоглобином. В норме его величина равна 0,86—1,1. Анемии при нормальном цветовом показателе называются нор- мохромными, при сниженном — гипохромными, при цветовом показателе более 1,1— гиперхромными.
Для большинства анемии характерным признаком является нарушение формы эритроцитов. Это явление называется анизоцитозом и пой- килоцитозом Оно свидетельствует о неполноценной деятельности костного мозга, заканчивающейся образованием в нем форм эритроцитов.
Важным диагностическим критерием, отражающим состояние костномозгового кровообразования, является подсчет ретикулоцитов периферической крови (в норме — 2—12 %о)- По содержанию ретикулоцитов в периферической крови анемии классифицируют следующим образом:
• регенераторные — количество ретикулоцитов умеренно повышено;
• гиперрегенераторные — содержание ретикулоцитов значительно выше нормы;
• гипо-и арегенераторные — отсутствие повышения или снижение ретикулоцитов вплоть до полного исчезновения их из крови. Причины анемий крайне разнообразны. Анемии могут сопровождать
ряд заболеваний (инфекции, интоксикации, злокачественные новообразования, болезни желудочно-кишечного тракта), осложнять острые и хронические кровопотери, развиваться при действии некоторых лекарств и химических соединений.
Классификация анемий основана на патогенетическом принципе. По механизму развития выделяют следующие формы анемий:
• гипоэритропоэтические (вследствие нарушения выработки эритроцитов в костном мозге);
• гемолитические (вследствие избыточного разрушения);
• дилюционные (вследствие разведения);
• смешанные (вследствие сочетания вышеуказанных механизмов).
Гипоэритропоэтические анемии в свою очередь подразделяются на следующие формы:
• гипопластические (апластические), при которых выработка эритроцитов нарушается из-за снижения потенции эритропоэтического ростка (уменьшение эритропоэтина, гибель родоначальных клеток);
• дефицитные, при которых выработка (а часто и строение) эритроцитов нарушается из-за недостатка факторов, необходимых для их формирования (железо, витамин В12, фолиевая кислота, медь и др.). Гипопластические анемии — группа анемий, основой которых является резкое угнетение кроветворения. Этиология более чем 75 % гипо- (апластических) анемий неизвестна. Среди этиологических факторов выявляют действие лучевой энергии, химических веществ (анилиновые красители, бензол), образование антител к гемопоэтическим клеткам.
Гипоплазия эритроидного ростка проявляется в виде недостаточного количества клеток костного мозга — предшественников эритропоэ- за. Это наблюдается при одновременном угнетении нескольких ростков кроветворения — лейкоцитарного и тромбоцитарного или же при несостоятельности только эритроидного ростка — чистая красноклеточная аплазия костного мозга. Недостаток эритропоэза может быть также при уменьшении плацдарма кроветворения вследствие вытеснения костного мозга иными клетками — лейкемическими, опухолевыми, миелофиброз- ными.
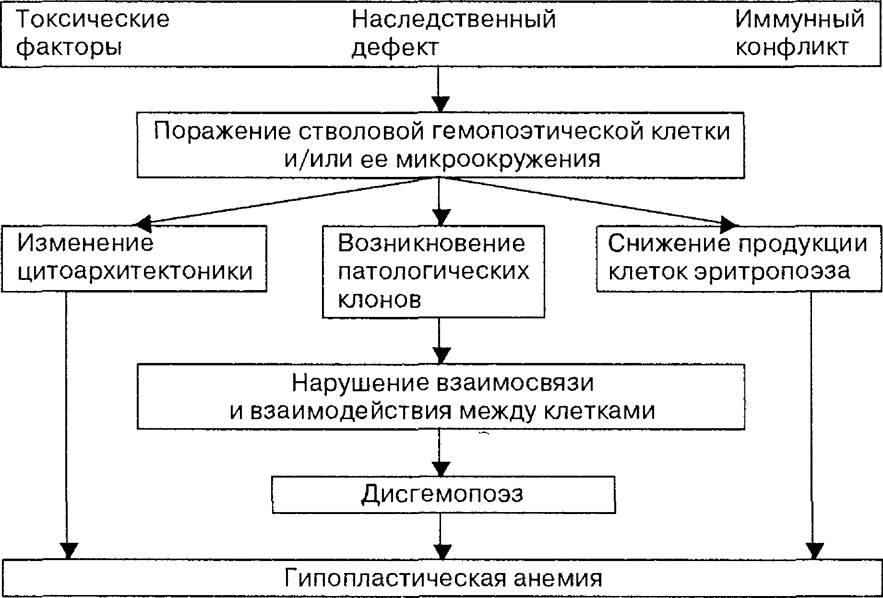
Существует несколько теорий патогенеза гипопластических анемий. Все перечисленные факторы могут непосредственно уменьшать количество стволовых клеток, вызывать их внутренний дефект, нарушать систему микроокружения, что ведет к снижению передачи сигналов классу
|
Схема 19.1. Механизмы развития гипопластической анемии.
пролиферирующих клеток, либо вызывать иммунное повреждение на территории костного мозга, ведущее к нарушению нормальной функции стволовой клетки (схема 19.1).
Внутренний дефект гемопоэтических стволовых клеток — основа аплазии костного мозга. На пролиферативную активность, дифферен- цировку и созревание стволовых клеток влияют колониестимулирующие факторы (КСФ), воздействующие на все ростки миелопоэза. Вырабатываются КСФ активно пролиферирующими клетками стромы. Дисбаланс между стволовыми клетками и стромой ведет к прекращению сигнала от стволовых клеток к клеткам стромы и снижению эффективности действия секретируемых ими факторов, что вызывает дифференцировку последних в адипогенном направлении. Это и объясняет высокое содержание жира в костном мозге больных гипо- и апластической анемией. Доказательствами теории поражения стволовой клетки являются развивающиеся при этом заболевании панцитопения и эффективность трансплантации костного мозга от однояйцовых близнецов без предварительной иммуноде- прессии реципиента.
Нарушение системы кроветворного микроокружения. Теория пользуется в настоящее время большой популярностью. В ее основе лежит концепция соматических поломок стромального самоподдержания стволовых клеток. В качестве возможной причины изменения генетической программы костного мозга рассматривают вирусы. Вирусная инфекция часто выявляется при аплазии костного мозга. Усиление экспрессии антигенов гистосовместимости DR-2 является косвенным признаком присутствия вирусов.
Иммунное повреждение на территории костного мозга. В основе этого механизма лежит усиление цитотоксического действия активированных Т-лимфоцитов.
Угнетение активности эритропоэтина может наблюдаться при злокачественных новообразованиях, воспалительных процессах, при влиянии фактора некроза опухоли или интерлейкина-1.
В механизме развития дефицитных гипоэритропоэтических анемий важная роль отводится дефициту железа.
Как известно, содержание железа в организме человека исчисляется всего 4,0 г; 5/8 от этого количества находится в гемоглобине, 1/4 — в тканевых депо и 1/8 — в миоглобине. Однако значение этого элемента для организма трудно переоценить. При формировании гема — основной структуры гемоглобина — именно атомы железа являются ответственными за перенос кислорода к клеткам и тканям организма. Недостаточное насыщение эритроцита гемоглобином приводит к формированию специфической гипохромной клетки с низким цветовым показателем, характеризующим степень насыщения эритроцита гемоглобином.
Микроцитарные гипохромные анемии чаще всего бывают следствием хронической кровопотери, источник которой обычно локализуется в желудочно-кишечном тракте. Ими могут быть эрозии и язвы желудка и двенадцатиперстной кишки, геморроидальные кровотечения, кровопотери при грыже пищеводного отверстия диафрагмы. У женщин частой причиной дефицита железа являются менструальные кровопотери. Носовые кровотечения у отдельных лиц могут быть ведущими. Кроме потерь железа вследствие кровоточивости, следует иметь в виду возможность повышенной потребности организма в железе, что отмечается у подростков, у беременных и часто усугубляется ограничением приема такого железосодержащего продукта, как мясо.
Нарушению снабжения организма железом могут способствовать патология кишечника, при которой всасывание железа нарушается, гаст- рэктомия и воспалительные поражения кишечника.
Гипохромные анемии, характеризующиеся низким цветовым показателем и имеющие небольшие размеры эритроцитов, могут иметь место при нарушении структуры гемоглобина как в связи с дефектным формированием белка-глобина, так и за счет несовершенного строения порфиринового кольца гема.
Патологические состояния именуются гемоглобинопатиями при дефекте структуры гемоглобиновой цепи или же талассемиями при дефекте образования всей цепи глобина. Эти состояния, так же как и дефекты структуры порфиринового кольца, характеризуются избыточным количеством железа в крови, которое не способно включиться в структуру гемоглобина. Подобные анемии носят название сидероахрестических. Они возникают вследствие невозможности введения железа в гем (за счет дефицита гемосинтетаза гемоглобинсинтетазы, при отравлении свинцом, при острых воспалительных заболеваниях). В этих случаях снижение уровня эритроцитов также сочетается с низким цветовым показателем.
В ря^це случаев костномозговое кроветворение является неэффективным вследствие нарушения генетической регуляции продукции эритроцитов, которые неспособны выполнять функцию здоровых эритроцитов, а также подвержены избыточному разрушению. Такой неэффективный эритропоэз констатируется при дефиците в организме витамина В12 ифолиевой кислоты, а также проявляется образованием неполноценных гемоглобинов в результате неправильного формирования отдельных цепей гемоглобина при гемоглобинопатиях или при формировании ненормальной молекулы гемоглобина вследствие дефекта образования отдельных глобиновых цепей — талассемии.
Гемолитические анемии — группы анемий, развивающихся вследствие повышенного разрушения эритроцитов.
Гемолитические анемии в зависимости от вызывающих их механизмов подразделяются на следующие подгруппы:
• анемии, возникшие в результате образования антител к эритроцитам (аутоиммуныые, изоиммунные);
• анемии, возникшие при разрушении неполноценных эритроцитов
При неполноценной оболочке эритроцита, которая определяется
генетическим дефектом белков стромы эритроцита — спектрина и анки- рина, развивается микросфероцитарная анемия. Эти протеины определяют роль поддерживателей каркаса эритроцита и его двояковогнутой формы. При нарушении структуры эритроцит становится сферообразным, уменьшаясь одновременно и в диаметре. Это приводит к определенным трудностям прохождения данных клеток через селезеночные фильтры и избыточным разрушениям последних. Развивается микросфероцитарная анемия, названная анемией Минковского—Шоффара (впервые описавших эту форму). Избыточное разрушение эритроцитов приводит к желтухе, которая может быть непостоянной, и образованию камней в желчном пузыре, обычно она сопровождается увеличением селезенки. Описанный патогенез данной анемии подтверждается положительным эффектом спленэктомии. Дефекты структуры эритроцита могут проявляться и иными вариантами — стоматоцитозом, овалоцитозом и др.
При неполноценныхгемоглобинах — гемоглобинопатии и талассемии — гемолиз эритроцитов является основой развития анемии. В настоящее время известно, что молекула гемоглобина состоит из четырех цепей. У большинства людей имеются по две ос-цепи, состоящих из 141 аминокислоты, и по две (3-цепи, состоящие из 146 аминокислот. Дефекты в аминокислотной последовательности впервые были описаны в структуре (3-цепи Лайнусом Поллингом, который обнаружил замещение в 6 положении глутаминовой аминокислоты валином. Эта патология была названа гемоглобинопатией S. В последующем были описаны иные нарушения той же р-цепи; в 6-м положении замена лизином, а также в 26-м, 98-м, 99-м и 102-м положениях. Неправильные гемоглобины приводят к образованию внутри эритроцита желатинозной субстанции, называемой тектоидом, которая может уплотняться и нарушать способность эритроцита изменять свою форму при прохождении им через капилляры.
При иных генетических дефектах происходит нарушение образования одной из цепей, в результате чего формируются гемоглобины, нехарактерные для здорового человека. При нарушении образования а-цепи развивается состояние, названное а-талассемией. При этом формируются гемоглобины, состоящие из (3- и у-цепей, причем иногда формируются гемоглобины, целиком состоящие из (3-цепей — (34, названного гемоглобином Барта. При нарушении формирования Р-цепи развивается состояние, названное (3-талассемией. Вследствие нестабильности гемоглоби- нов, а иногда и мембран эритроцитов развиваются гемолиз, желтуха, спленомегал'ия. Одновременно с гемолизом для лиц, страдающих патологией гемоглобинов, свойственны тромботические проявления, которые нередко являются причиной инфарктов различных органов, чаще поражаются кожа, головной мозг, селезенка, легкие. При этом нередки инсульты, развитие гипертензии малого круга кровообращения, снижение иммунитета. Обострениям могут способствовать гипоксические состояния, инфекции, обезвоживание.
Гемолитические анемии могут быть также обусловлены недостаточностью ферментных систем, обеспечивающих жизнеспособность эритроцита. Наиболее частыми являются дефицит пируваткиназы и особенно— 6-глюкозофосфатдегидрогеназы, который обнаруживается более чем у 200 миллионов человек в мире. Проявляясь при попадании в организм определенных субстанций — конских бобов или даже их пыльцы, многих лекарств (антималярийные, сульфаниламиды, нитрофураны, аналгетики и пр.), данные состояния сопровождаются желтухой, развитием желчнокаменной болезни и спленомегалии.
Известны анемии, обусловленные разрушением эритроцитов паразитами (малярия, лихорадка Оройя — перуанская бородавка); анемии, связанные с разрушением эритроцитов вследствие действия прямых гемолизинов. Выявление гемолитических анемий основано на определении повышенного содержания в крови неглюкуронированного (непрямого) билирубина, сочетающегося с увеличением числа ретикулоцитов крови.
Наряду с анемиями, характеризующимися уменьшенным или нормальным размером эритроцитов, имеются состояния, для которых характерен макроцитоз.
Наиболее часто в этой группе анемий можно наблюдать патологические состояния, вызванные нарушением формирования нормальных эритроцитов и образованием очень крупных клеток — размером до 12— 13 мкм — мегалоцитов, иногда более молодых, содержащих ядра и называемых мегалобластами. Данные состояния вызываются дефицитом в организме витамина В12 или фолиевой кислоты. Мегалобластные анемии в настоящее время встречаются весьма часто.
В12-дефицитная анемия была описана задолго до распознавания механизмов ее развития и в связи со своей тяжестью получила название пернициозной, т.е. злокачественной. В настоящее время суть ее хорошо изучена. Содержащийся вне организма атом кобальта в соединении с органической структурой, сходной со структурой порфиринового кольца, может попасть в организм только с животной пищей — мясной или молочной. В желудке он связывается со специальным связывающим белком R, который охраняет его от разрушения и доносит до двенадцатиперстной кишки. Там кобаламин соединяется с внутренним фактором, вырабатываемым париетальными клетками желудка, и доносится имдодисталь- ного отдела подвздошной кишки, где и связывается специальными клеточными рецепторами. Внутренний фактор здесь разрушается, а кобаламин всасывается, связываясь с очередным белком — транскоба- ламином, способствующим его поступлению в костный мозг, печень и другие клетки. Действенным началом в организме являются две формы кобаламина — метилкобаламин и аденозилкобаламин. Влияя на конъюгацию метилтетрагидрофолата, метилкобаламин обеспечивает нормальное функционирование ДНК и нормализует имеющееся без него мега- лобластное кроветворение. Ацетилкобаламин влияет на превращение метилмалонового коэнзима А в сукцинил-коэнзим А и тем самым способствует введению атома углерода в липидные образования нейронов. Поэтому дефекты фолиевой кислоты и кобаламина определяют и ме- галобластную анемию и неврологическую картину заболевания, характеризующуюся проявлениями фуникулярного миелоза с нарушениями чувствительности. Дефекты ДНК определяют нарушения и иных митоти- чески активных клеток, в частности эпителиальных клеток желудочно-кишечного тракта. Их дефект проявляется наличием у больных с этой патологией атрофического гастрита и ярко-малиновым цветом языка.
Наиболее частыми причинами мегалобластных анемий являются вегетарианская диета, нарушения всасывания кобаламина при дефекте внутреннего фактора — наследственного и приобретенного (гастрэкто- мия), нарушения терминального отдела подвздошной кишки при энтеритах, резекциях, опухолях и наследственных дефектах (болезнь Имерслун- да), при конкурентном захвате фактора глистами типа широкого лентеца, а также бактериями (при синдроме слепой петли), при приеме некоторых лекарств — колхицина, неомицина, пара-аминосалициловой кислоты.
Дефект фолиевой кислоты чаще всего отмечается при дефектах питания (консервы), при алкоголизме, с связи с повышенной потребностью в периоды роста организма, при беременности, опухолях, эксфолиатив- ном дерматите, при приеме лекарств (антифолиевые препараты), при некоторых наследственных дефектах.
Дилюционные анемии встречаются часто, однако существуют кратковременно. Тем не менее знать о них необходимо, чтобы правильно интерпретировать неожиданно выявленные изменения показателей красного ростка крови. Обычно подобные состояния возникают при лечении мочегонными препаратами и объясняются «отеком крови», который происходит вследствие выхода в кровяное русло межклеточной жидкости. Дилюционные анемии могут встречаться и при переливании больным растворов низкомолекулярных белков и т.п.
К группе смешанных анемий относят анемии, в основу которых положено влияние нескольких из перечисленных факторов. В этой группе целесообразно выделение подгруппы анемий, которые развиваются при недостатке в организме нескольких веществ, необходимых для осуществления нормального гемопоэза.
Так, при недостатке в организме железа, который встречается очень часто, наблюдается не только недостаточное образование гемоглобина из-за нарушения формирования гема, но и уменьшение образования самих эритроцитов вследствие снижения эритропоэтических потенций ги- поксического костного мозга. По-видимому, именно этим можно объяснить случаи железодефицитных анемий с нормальным цветовым показателем.
К анемиям смешанного генеза следует относить те анемии, которые возникают при наличии недостатка факторов, обеспечивающих переход мегалобластического кроветворения в нормальное (дефицит витамина В12, фолиевой и оротовой кислот).
Такие анемии сопровождаются не только угнетением активности костномозгового кроветворения, но и разрушением — гемолизом мега- лоцитарных и мегалобластных форм.
Дата добавления: 2015-02-05; просмотров: 889;
