Бадмаев Б.Ц. 2 страница
Эктопические очаги автоматической активности могут возникать в коронарном синусе, предсердиях, атриовентрикулярных клапанах, в соединительной части атриовентрикулярного узла, в проводящей системе Гиса—-Пуркинье. Кэктопической активности потипу выскальзывания при
водят резкое замедление частоты синусового ритма или замедление про- ведения импульса, атакже активация водителей второго, третьего порядка. Усиление эктопической активности на фоне нормальной частоты синусового ритма или даже синусовой тахикардии приводит к появлению преждевременных импульсов в результате уменьшения величины диасто- лического потенциала из-за нарушений транспорта ионов калия и кальция.
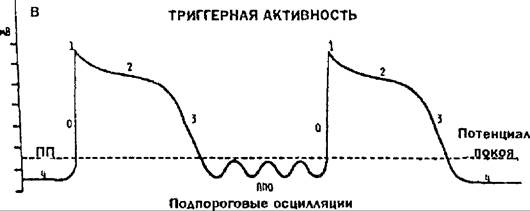
Возникновение эктопических импульсов может быть также связано с триггерной активностью. Необходимым условием для ее развития является наличие предшествующего импульса, проведенного из очага более высокого порядка (например, для импульса из предсердий таковым будет ритм из синусового узла). Преждевременная деполяризация возможна до или после достижения полной реполяризации, т.е. порогового потенциала (рис. 17.4). В связи с этим в таких случаях имеет место ранняя или поздняя постдеполяризация соответственно. Ранняя постдеполяризация, вероятно, связана с реактивацией вольтажзависимых кальциевых каналов типа L; поздняя постдеполяризация возникает при
|
|
|
|
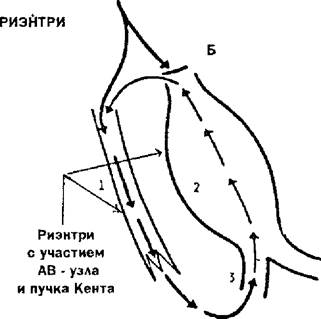
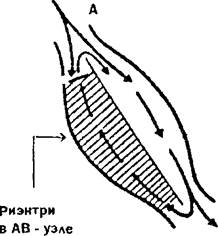
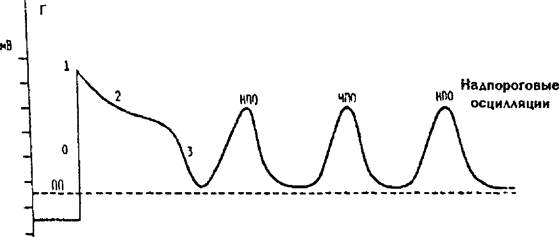
Рис. 17.4. Механизмы возникновения аритмий (схема). А: — стрелками показано направление распространения импульса возбуждения в пределах АВ-узла; заштрихован участок ткани узла, в котором развилась временная блокада проведения возбуждения в ан- тероградном направлении и возникли условия для распространения импульса в ретроградном направлении, что обусловило появление круга циркуляции возбуждения; Б. 1 — пучок Кента; 2 — АВ-узел; 3 — правая ножка пучка Гиса Стрелками указаны направления распространения импульса возбуждения; В: представлены два внутриклеточных потенциала действия (первый — нормальный, второй — преждевременно возникший}. Обозначение — тВ на шкале отражает величину потенциала; ПП — пороговый потенциал; 1, 2, 3, 4 — фаза потенциала действия; Г:обозначения те же, что на рис. 17.4, В Первый потенциал действия — нормальный, последующие преждевременные импульсы, обусловливающие возникновение тахикардии. НПО — надпоро- говые осцилляции.
избыточном содержании ионов кальция внутри клеток, избыточной симпатической стимуляции, после передозировки сердечных гликозидов.
Предположить триггерный механизм аритмии можно на основе следующих данных;
• при учащении эктопического ритма после прекращения электростимуляции (постстимуляционное учащение), проводившейся с большей частотой, чем это наблюдалось во время пароксизма тахикардии;
• в случаях, в которых одиночные преждевременные экстрастимулы провоцируют и подавляют пароксизм тахикардии,
17,7,2, Риэнтри
Риэнтри (циркуляция волны возбуждения по замкнутым путям) как механизм возникновения аритмии является результатом развития однонаправленной блокады в определенном участке проведения импульса возбуждения в антероградном направлении, но которая исчезает в нем к моменту, когда импульс может распространяться из противоположного направления. В результате импульс возбуждения начинает циркулировать по кругу и генерирует возбуждение окружающей ткани, Однонаправленная блокада проведения импульсов возникает потому, что в определенной области проводящей системы или в сократительном миокарде увеличивается рефрактерность и уменьшается скорость проведения.
Полагают, что большинство пароксизмальных тахикардий возникают по механизму риэнтри, допускается возможность возникновения аритмии по одному механизму, а ее продолжения — мобилизацией другого механизма,
Экспериментальные и клинические наблюдения свидетельствуют о том, что аритмии по механизму риэнтри возникают в синусовом узле, предсердиях, предсердно-желудочковом узле, желудочках, Наиболее доказательна роль механизма риэнтри при развитии пароксизмальной формы тахикардии при наличии дополнительных путей проведения возбуждения от предсердий на желудочки (пучки Кента, Джеймса и Махай- ма), В таких случаях круг циркуляции волны возбуждения достаточно большой. В опытах на сердце кроликов, в которых создавали функционально неактивную зону, возбуждение в антероградном направлении распространялось по волокнам, характеризующимся коротким рефрактерным периодом, а ретроградно — по волокнам с более продолжительным рефрактерным периодом, Длина круга циркуляции импульса была очень малой — всего 6—8 мм.
Возникновение аритмии, особенно пароксизмальное учащение ритма сердца, приводит к падению ударного объема сердца, повышению периферического (сосудистого) сопротивления, нарушению регионарного кровотока, активации нейро-гуморальной системы, в частности симпатоадреналовой, и увеличению выброса предсерд- ного натрийуретического пептида, Во время учащения сердечного ритма уменьшается время наполнения желудочков, особенно при ухудшении сократимости миокарда.
Снижение наполнения левого желудочка может быть также обусловлено прекращением систолы предсердий (мерцание предсердий), асин- хронностью сокращения камер сердца (блокада проводимости возбуждения), одновременным сокращением (систолой) предсердий и желудочков (атриовентрикулярная пароксизмальная тахикардия).
Учащение ритма сердца до 180 ударов в 1 мин при исходно нормальной сократимости миокарда может не сопровождаться серьезными расстройствами гемодинамики из-за включения компенсаторных механизмов (выброс катехоламинов, активация баро- и волюмрецепторов).
При сердечной недостаточности или тяжелом поражении миокарда (инфаркт миокарда) ритм свыше 120 ударов в 1 мин часто приводит к нарушению кровоснабжения жизненно важных органов.
При наджелудочковыхтахикардияхи относительно невысокой частоте сердечного ритма мозговой кровоток снижается на 7—12 %, а при большой частоте — до 40 %; коронарный кровоток может уменьшится на 35 %.
При желудочковой тахикардии нарушения гемодинамики, как правило, более значительны, например коронарный кровоток может уменьшиться на 60 %. Особенно снижается кровоток в субэндокардиальном слое миокарда из-за повышения внутрижелудочкового диастолического давления. Уменьшается также почечный и мезентериальный кровоток.
17.7.3. Нарушение проводимости
Нарушения проводимости могут возникать в различных участках проводящей системы сердца:
• в синоатриальной области;
• в атриовентрикулярном узле;
• в системе Гиса—Пуркинье,
Нарушение проводимости может быть обусловлено:
1) прекращением генерации импульсов,
2) уменьшением величины импульса до субпороговой,
3) возникновением блокады проведения импульса,
4) нарушением возбудимости миокарда или возникновением электромеханической диссоциации,
Причиной блокад сердца в большинстве случаев является органическое его поражение воспалительного, ишемического или дегенеративного происхождения. Развитие умеренной степени нарушения проводимости (например, во время сна) может носить функциональный характер. В частности, возможно урежение синусового ритма до 40 ударов в 1 мин или замедление атриовентрикулярной проводимости I или НА степени (удлинение интервала Р—Я, блокада сердца типа Мобитц I).
Нарушения проведения импульсов проявляются развитием блокады их распространения, что может вызвать асистолию сердца, замедление проведения возбуждения по проводящей системе сердца, бради кардию. Проводимость определяется:
® состоянием клеточных мембран, в частности амплитудой и скоростью фазы «О» деполяризации; ® состоянием возбудимости тканей, по которым импульс должен распространяться; » однородностью распространения волны возбуждения; © состоянием межклеточных связей, особенно в местах контакта разнородных клеточных структур (например, синоатриальная область, атриовентрикулярное соединение); ® влиянием вегетативной нервной системы.
Некоторые варианты нарушения проведения связывают с декре- ментным и со скрытым проведением возбуждения. Декрементное про- ведение с электрофизиологической точки зрения отражает свойство волокна, при котором происходит потеря эффективности потенциала действия как возбуждающего стимула для нижерасположенных участков этого же волокна. Прогрессирующее снижение эффективности распространяющегося вдоль волокна потенциала действия, вероятно, связано со снижением амплитуды и скорости деполяризации клеточных мембран. Используя данный механизм, в клинической практике объясняют развитие блокады проведения по типу Мобитц 1 (блокада типа Венкебаха—Самойлова).
Скрытое проведение характеризуется тем, что возбуждение, распространяясь до определенного участка проводящей системы, не достигает эпикарда, поэтому не находит отражения на ЭКГ. Однако при этом может меняться частота основного ритма или происходить его трансформация. Электрофизиологической основой скрытого проведения и возникающей блокады проведения является неоднородность рефрактерности и скорости проведения возбуждения в различных участках проводящей системы сердца и миокарда. Скрытое проведение может влиять на распространение импульсов как в антероградном, так и в ретроградном направлениях.
Степень выраженности нарушений проводимости колеблется в пределах от умеренной до тяжелой, что либо не приводит к серьезным последствиям, либо способствует развитию жизнеопасных нарушений гемодинамики (гипотония, обморок, судорожное состояние). Тяжелая степень нарушения проводимости характеризуется остановкой функции синусового узла или асистолией желудочков.
Глава 18. Патологическая физиология
внешнего дыхания
Органы дыхания вместе с аппаратом кровообращения обеспечивают снабжение организма кислородом. Дыхание в широком понимании — это сложный биологический процесс, входе которого организм потребляет кислород и выделяет в окружающую среду углекислый газ. В процессе биологического окисления образуются богатые энергией фосфорорга- нические соединения, необходимые для функционирования и обновления структур организма.
Для удобства изучения принято различать дыхание внутреннее (или тканевое) и внешнее (или легочное). Внутреннее дыхание представляет собой комплекс биохимических окислительных процессов, происходящих в тканях. Под внешним дыханием понимается совокупность физиологических механизмов, обеспечивающих обмен газов между наружным (атмосферным) воздухом и кровью легочных капилляров.
Внешнее дыхание обеспечивается функционированием аппарата внешнего дыхания, в структуре которого можно выделить 5 основных звеньев:
1) дыхательный (регуляторный) центр продолговатого мозга;
2) нервно-мышечный аппарат грудной клетки;
3) грудная клетка, или легочный «каркас»;
4) дыхательные пути;
5) паренхима легких.
Патология любого из них может привести к развитию недостаточности внешнего дыхания или дыхательной недостаточности.
18.1. Определение понятия «дыхательная недостаточность»
Термин дыхательная недостаточность стал широко использоваться в медицинской практике сравнительно недавно — с 50—60-х годов, что связано с совершенствованием аппаратуры для проведения искусственной вентиляции легких (ИВЛ) и мониторирования жизненно важных функций организма.
В настоящее время существует несколько распространенных определений дыхательной недостаточности (ДН), хотя ни одно из них до сих пор не является общепринятым. Наиболее часто в литературе приводится определение, предложенное E.J.M. Campbell еще в 1965 г.
Дыхательная недостаточность — патологический синдром, при котором парциальное напряжение кислорода в артериальной крови (Ра02) меньше 60 мм рт.ст., а парциальное напряжение углекислого газа (РаС02) больше 46 мм рт.ст. при условии, что больной (в покое) дышит атмосферным воздухом при нормальном барометрическом давлении.
К ДН не относятся случаи развития артериальной гипоксемии, обусловленные внелегочным шунтированием крови справа налево, что может отмечаться, например, при врожденных пороках сердца.
В связи с тем что основные клинические проявления ДН — одышка, цианоз, изменения частоты дыхания — неспецифичны, биомаркерами ДИ принято считать изменения показателей газового состава артериальной крови — снижение парциального напряжения кислорода (гипоксемия) и/ или повышение содержания в ней углекислоты (гиперкапния).
Парциальное напряжение газов в артериальной крови для каждого конкретного индивидуума зависит от множества факторов, таких, как барометрическое давление, содержание кислорода во вдыхаемом воздухе, положение тела (стоя, лежа) и возраст пациента, поэтому иногда абсолютные значения показателей газового состава крови могут оказаться ; не столь важным, как динамика и скорость их изменений.
В зависимости от характера патологического процесса динамика показателей газового состава артериальной крови при ДН может быть принципиально различной (рис. 18.1). В одних случаях она проявляется нарастающей гипоксемией (ДН I типа), в других —ее сочетанием с ги- перкапнией (ДН II типа). Более того, по мнению ряда исследователей, на определенных этапах развития ДН показатели газового состава крови могут сохраняться на нормальном уровне, прежде всего за счет активного использования функциональных резервов, поэтому ими вводится понятие угрожаемой (или компенсированной) ДН, а само состояние ДН трактуется более широко. Согласно одному из последних определений.
Дыхательная недостаточность — это состояние организма, при котором либо не обеспечивается поддержание напряжения 02 и С02 в артериальной крови на нормальном уровне, либо оно достигается за счет повышенной работы системы , внешнего дыхания, либо поддерживается исскуственным
путем.
В зависимости от скорости изменений газового состава артериальной крови принято различать острую и хроническую формы ДН.
При острой ДН (ОДН) нарушения газового состава артериальной крови развиваются в течение нескольких дней, часов (или даже минут) и,
РаСО, кПа
12 г
2 4 6 8 10 12 U 16 1® 20
РаСО, кПа
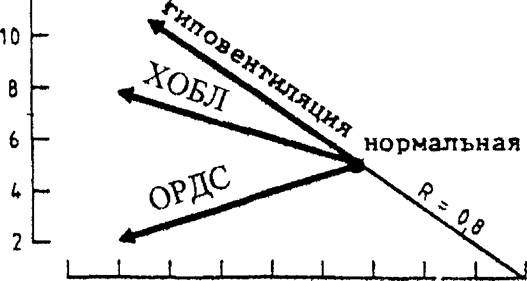
|
| Рис. 18.1. Динамика показателей газового состава артериальной крови при центрогенной гипо- вентиляции легких, хронической обструктивной болезни легких (ХОБЛ) и остром респираторном |
как правило, требуют проведения интенсивной терапии. При быстром развитии ДН не успевают включиться компенсаторные механизмы со сто-
дистресс-синдроме (ОРДС)
[West J. В., 1998],
роны других органов и систем организма, прежде всего почек, поэтому характерным признаком ОДН являются острые нарушения кислотно- основного баланса (КОБ), в частности респираторный алкалоз при избыточном выведении С02 (гипервентиляция легких при ДН I типа) или респираторный ацидоз вследствие задержки С02 в организме (гиповентиля- ция легких при ДН II типа). Острая дыхательная недостаточность практически всегда сопровождается выраженным нарушением функций сердечно-сосудистой системы, поэтому острая форма ОДН носит название асфиксии, что в переводе с греческого означает «без пульса».
В клинической практике ОДН нередко развивается в случаях уже существующей ДН — так называемая «ОДН на фоне хронической дыхательной недостаточности». Среди факторов, провоцирующих обострение ДН, ведущая роль отводится респираторным инфекциям, тромбоэмболии легочной артерии, неконтролируемому назначению кислорода и некоторых лекарственных средств (седативные, диуретики).
При хронической ДН (ХДН) нарушение газового состава крови развивается постепенно, в течение нескольких дней, месяцев или лет. При этой форме ДН происходит активация компенсаторных механизмов, нормализующих КОБ и улучшающих доставку кислорода к тканям, в частности изменение частоты и глубины дыхания, мобилизация почечных механизмов регуляции КОБ, ускорение периферического кровотока (тахикардия, увеличение сердечного выброса) и уровня гемоглобина крови (вторичная полицитемия), изменение диссоциации оксигемоглобина.
Недостаточность компенсаторных механизмов при ДН ведет к развитию тканевой (гипоксемической) гипоксии, наиболее чувствительными к которой являются клетки коры головного мозга и миокарда.
18.2. Оценка функций внешнего дыхания придыхательной недостаточности
Исследование функций внешнего дыхания (ФВД) наряду с изучением газового состава артериальной крови дает возможность объективно оценить тяжесть, а иногда и характер патологического процесса, лежащего в основе развития дыхательной недостаточности. Использование рутинных методов позволяет получить информацию о величине легочных объемов и емкостей, объемной скорости воздушных потоков и состоянии «диффузионной способности легких».
Легочные объемы и емкости1. При изучении легочных объемов и емкостей наиболее важной является оценка следующих показателей (их нормальные значения обычно находятся в пределах 80—120 % от должных величин):
• общая емкость легких — TLC (от англ. total lung capacity) — объем
воздуха в легких после завершения максимально глубокого вдоха.
Показатели даны в английской транскрипции в связи с широким использованием импортной аппаратуры.
ВеличинаТЮ определяется в основном силой инспираторных мышц, расширяющих грудную клетку, и противодействующей ей эластической отдачей респираторной системы (преимущественно легких),
• остаточный объем легких — RV (от англ. residual volume) — объем воздуха в легких после максимально глубокого выдоха. Его величина определяется силой экспираторных мышц, сжимающих грудную клетку, и противодействующей ей эластической отдачей респираторной системы (преимущественно грудной клетки), расправляющей легкие в этой позиции, ау лицпожилого возраста и при заболеваниях нижних дыхательных путей — также преждевременным (ранним) экспираторным закрытием мелких дыхательных путей, *
• жизненная емкость легких — VC (от англ. vital capacity) — объем выдыхаемого воздуха от уровня TLC до уровня RV;
• функциональная остаточная емкость легких — FRC (от англ. functional residual capacity) — объем воздуха в легких, находящихся в состоянии покоя, т.е при завершении спокойного выдоха. В состоянии покоя эластическая отдача легочной ткани полностью уравновешивается эластической отдачей грудной клетки.
Жизненная емкость легких (VC) может быть измерена с помощью обычного спирометра: пациент полностью выдыхает воздух после максимально глубокого вдоха. В связи с тем что другие объемы и емкости (TLC, RV и FRC) включают е^себя часть воздуха, остающуюся в легочной ткани даже после максимально глубокого выдоха, то для их оценки используются более сложные методы, в частности:
1) метод разведения гелия, при котором исследуемый вдыхает определенный объем воздуха, содержащего известную концентрацию инертного газа (чаще гелия). Степень уменьшения концентрации этого газа в выдыхаемом воздухе при этом отражает величину внут- рилегочного объема воздуха;
2) метод общей плетизмографии тела, при котором пациент внутри специальной воздухонепроницаемой камеры известного объема выполняет глубокие дыхательные движения, приводящие к сдавлению и разрежению воздуха внутри камеры и грудной клетки. Измерение колебания давлений и объемов позволяет, согласно закону Бойля- Мариотта, рассчитать величину объема воздуха, находящегося в легких, равного величине FRC.
Первый метод обычно используют более широко. Однако в том случае, когда у пациента имеются замкнутые внутрилегочные полости (например, буллы), воздух которых не контактируете воздухоносными путями и, следовательно, не может принять участия в разведении гелия, предпочтение отдают методу общей плетизмографии тела.
Скорость воздушных потоков. Измерение скорости воздушных потоков, как правило, производят при выполнении маневра форсированного выдоха, т.е. выдоха с максимально возможной силой и скоростью от уровня TLC до RV
Объем воздуха, полностью выдыхаемый во время этого маневра называется форсированной жизненной емкостью легких (FVC — от англ. forced vital capacity), а объем воздуха, выдыхаемый в первую секунду выдоха, — объемом форсированного выдоха за 1 с (FEV1 — от англ. forced expiratory volume in 1 second). Для оценки скорости воздушных потоков обычно исследуют отношение этих двух показателей (FEV/FVC), которое снижается при наличии бронхиальной обструкции и замедлении объем- ной скорости выдоха (в норме это отношение должно быть не ниже 95 % должных величин).
Другим параметром скорости воздушных потоков является показатель объемной скорости воздушного легких между 25 % и 75 % форсированной жизненной емкости выдоха (FEF — от англ. forced expiratory flow between 25 and 75 % of FVC). Он является несколько более чувствительным при оценке степени бронхиальной обструкции5 чем отношение FEV/FVC.
Диффузионная способность легких. Диффузионная способность легких отражает скорость переноса газа из альвеол в капиллярное русло легких в зависимости от парциального напряжения (давления) газа по обе стороны альвеолярно-капиллярной мембраны. Для оценки диффузной способности легких исследуется отношение скорости прохождения СО через альвеолянрно-капиллярную мембрану к градиенту альвеолярно- капиллярного напряжения этого газа. Определение разницы концентраций СО в выдыхаемом и вдыхаемом воздухе позволяет рассчитать скорость его поглощения, а альвеолярную концентрацию СО рассчитывают на основании определения его концентрации в выдыхаемом воздухе в конце выдоха (величиной концентрации СО в плазме легочных капилляров обычно пренебрегают). Оксид углерода сравнительно быстро и легко связывается гемоглобином крови (в 210 раз активнее, чем кислород), поэтому при вдыхании его перенос из альвеол в легочные капилляры будет определяться не только его движением через альвеолярно-капиллярную мембрану, но и уровнем гемоглобина крови.
Считается, что диффузионная способность легких лишь частично определяется физическими свойствами альвеолярно-капиллярной мембраны. В большей степени она зависит от количества функционирующих альвеолярно-капиллярных единиц, т.е. площади газообмена, а также объема крови (гемоглобина) в легочных капиллярах, связывающего оксид углерода. В связи с тем что диффузионная способность легких снижается при анемии (вследствие уменьшения количества гемоглобина, связывающего оксид углерода), полученные показатели обязательно должны корригироваться относительно уровня гемоглобина крови пациента.
Диффузионная способность легких снижается при патологических процессах, ведущих к уменьшению общей площади газообмена и/или объема крови в капиллярном русле легких, например при эмфиземе легких, интерстициальных заболеваниях легких, а также патологии легочных сосудов. При болезнях дыхательных путей, без вовлечения паренхимы легких (например, при бронхиальной астме, хроническом бронхите), диффузионная способность легких, как правило, не изменяется.
При анализе изменений показателей ФВД выделяется два основных варианта (или их комбинация): обструктивный вариант, характеризующийся снижением скорости воздушных потоков за счет обструкции дыхательных путей, и рестриктивный вариант, характеризующийся ограничением легочных объемов.
При обструктивном варианте (от лат. obstructio — преграда, помеха) нарушений ФВД (например, при бронхиальной астме, хроническом бронхите или эмфиземе легких) отмечается снижение показателей объемной скорости выдоха, в частности отношения FEV/FVC и FEF25_75. При этом возможно увеличение остаточного объема легких (RV) и отношения RV/ TLC (более 33 %) вследствие раннего экспираторного закрытия (коллапса) дыхательных путей. Увеличение показателей TLC и FRC, наблюдаемое при гипервоздушности легочной ткани, также нередко регистрируется при нарушении ФВД по обструктивному варианту. Диффузионная способность легких обычно снижается лишь при уменьшении общей площади газообмена, что характерно в основном для эмфиземы легких.
Основным признаком нарушений ФВД по рестриктивному варианту (от лат. «restrictio» — ограничение) ФВД является уменьшение легочных объемов и емкостей, главным образом TLC и VC, при сохранении показателей FEV/FVC и FEF25_75, Однако при некоторых формах рестриктивных нарушений и выраженном ограничении легочных объемов возможно некоторое снижение показателя FEF26_75 вследствие уменьшения объема воздуха, необходимого для генерации высоких скоростей воздушного потока.
Различные формы поражения паренхимы легких и грудной клетки, а также нер8но»мышвчная патология проявляются рестриктивным вариантом нарушения ФВД.
Особенности каждой из этих групп патологии облегчают определение причин дыхательной недостаточности при обнаружении рестриктивных изменений ФВД. Например, снижение диффузионной способности чаще отмечается при интерстициальных заболеваниях легких, а высокие значения RV могут отмечаться при слабости дыхательной мускулатуры или выраженных аномалиях (деформациях) грудной клетки.
18.3. Патофизиологические варианты дыхательной недостаточности
Дыхательная недостаточность может развиваться при нарушении функции любого звена аппарата внешнего дыхания и, следовательно, быть следствием поражения центральной нервной системы (ЦНС), нервно- мышечной патологии, деформаций грудной клетки (патологии «легочного каркаса»), заболеваний дыхательных путей или собственно паренхимы легких.
18.3.1. Центрогенная дыхательная недостаточность
Дыхательная недостаточность может быть следствием различных нарушений центральной регуляции дыхания.
В норме регуляция дыхания осуществляется сложной системой рецепторов, обеспечивающих нейрохимическую (по отклонению газового состава артериальной крови) и нейромеханическую (по возбуждению механорецепторов) активацию дыхательного центра (ДЦ), расположенного в продолговатом мозге. В нее входят центральные хеморецепторы продолговатого мозга, реагирующие на уровень рС02 и [Н+] — спинномозговой жидкости (гиперкапния), периферические хеморецепторы каротид- ных и аортальных телец, реагирующие на уровень оксигенации артериальной крови (на гипоксемию), рецепторы растяжения и иритантные рецепторы дыхательных путей, юкстакапиллярные или J-рецепторы легочного интерстиция, а также проприорецепторы дыхательных мышц, Кроме того, в осуществлении нормального (координированного) дыхания, особенно во время разговора, еды или плавания, важную роль играет связь ДЦ с определенными зонами коры и варолиевого моста (моста мозга).
В ответ на поступающую афферентную импульсацию ДЦ модулирует нервный импульс к мотонейронам дыхательных мышц — центральную респираторную посылку (ЦРП), или нейрореспираторный драйв (от англ. drive — побуждение, стимул), определяя основные варианты дыхания, в частности его ритмичность, частоту, глубину, длительность фаз вдоха и выдоха, распределение скорости потока воздуха внутри фаз.
При повышении порога возбудимости ДЦ (например, под воздействием седативных препаратов), органических повреждениях ДЦ (травма, опухоли головного мозга и т.д.), а также при нарушениях афферентной импульсации (например, перераздражении J-рецепторов при интерстициальном отеке легких) отмечается искажение ЦРП с развитием общей гипер- или гиповентиляции легких, а также нарушений ритма дыхания (дыхательные дисритмии).
Наиболее характерное проявление центрогеннрй ДН ~ гиповенти- ляция легких, характеризующаяся снижением альвеолярной вентиляции легких, не соответствующим продукции углекислого газа. В основе развития гиповентиляции лежат перенесенные заболевания ЦНС (например, энцефалит), хотя часто ее конкретную причину установить не удается. В этом случае говорят о идиопатических гиповентиляционных синдромах, которые обычно классифицируют в зависимости от массы тела пациентов и времени возникновения их в течение суток.
Дневную гиповентиляцию легких у больных ожирением называют гиповентиляционным синдромом тучных, или синдромом Пиквика, аналогичную патологию у худых — первичной альвеолярной гиповентиляцией,
Синдромы ночного апноэ-гипопноэ характеризуются периодическим возникновением эпизодов остановки (апноэ) или поверхностного дыхания во время сна (с частотой свыше 10 эпизодов в час и продолжи- тельностыо более 10 с каждый). Различают два основных варианта этого синдрома — центрального и обструктивного генеза. Считается, что при центральном ночном апноэ периодически прекращается ЦРП к дыхательным мышцам, а при обструктивном варианте ДЦ, посылая импульс на мышцы вдоха, предварительно (т.е. в первые 200 мс вдоха) не тонизирует или недостаточно тонизирует мышцы глотки (главным образом mm. genioglossus), обеспечивающие проходимость верхних дыхательных путей. Периоды апноэ обычно ведут к частым ночным пробуждениям (фрагментация сна), временно восстанавливающим нормальную ритмическую активность дыхательного центра, что является поводом для обращения за медицинской помощью по поводу выраженной дневной сонливости и/ или громкого ночного храпа.
Дата добавления: 2015-02-05; просмотров: 922;
