Бадмаев Б.Ц. 3 страница
Вентиляция легких — единственная функция, которая находится под непроизвольным и произвольным контролем, поэтому при центрогенной ДН возможны изолированные нарушения дыхательного автоматизма или произвольного контроля дыхания. Это наблюдается, например, при синдроме «проклятия Ундины», при котором нарушается автоматический контроль за дыханием. Название этого синдрома связано с древней легендой о нимфе Ундине, возлюбленный которой за свою неверность был проклят морским царем Нептуном, в результате чего оказался способным дышать лишь до тех пор, пока помнил об этом.
К основным дыхательным дисритмиям относятся апнейстическое дыхание (характеризующееся удлиненным судорожным вдохом с последующей задержкой выдоха), возникающее, как правило, при инфаркте моста мозга; атаксическое (нерегулярное) дыхание, или дыхание Биота, иногда появляющееся в претерминальном состоянии и обусловленное разобщением различных отделов дыхательного центра в продолговатом мозге. Однако более распространенным вариантом нарушений ритма дыхания является дыхание Чейн-Стокса, характеризующееся периодическим усилением дыхательных движений, после чего следует их ослабление и период апноэ, а затем — возобновлением дыхания.
Дыхание Чейн-Стокса нередко наблюдается при застойной сердечной недостаточности, а также при ряде заболеваний ЦНС и легких. Считается, что при сердечной недостаточности замедление кровотока задерживает реакцию центральных хеморецепторов на изменения газового состава артериальной крови. Непосредственное повреждение дыхательного центра лежит в основе развития дыхания Чейн-Стокса при заболеваниях ЦНС. Прихронических заболеваниях легких дыхание Чейн-Стокса обычно объясняется состоянием приобретенной или врожденной «гиперадаптации» ДЦ к повышенному парциальному напряжению С02 в крови. 3 этом случае основную роль в нейрохимической регуляции дыхания приобретает уровень оксигенации артериальной крови (гипоксемический драйв). В связи с тем что чувствительность ДЦ к уровню парциального напряжения кислорода в крови не является л и ней но-зависимой в отличие от его чувствительности к уровню рС02 крови, в этом случае возможны периодические «вспышки» активности ДЦ, сменяющиеся ее угнетением (дыхание Чейн-Стокса).
Для оценки функционального состояния ДЦ (нейрореспираторного стимула) на практике используются различные методы, в частности нагрузочные дыхательные тесты (гиперкапническое или гипоксическое тестирование), регистрация электронейрограммы диафрагмального нерва, длительный мониторинг дыхания во время сна пациентов (метод поли- сомнографии) Однако наиболее распространенным методом оценки его функции является измерение величины отрицательного давления в ротовой полости в самом начале фазы вдоха (в первые 100 мс) при окклюзии дыхательных путей, т.е. попытке сделать вдох через закрытый клапан, соединенный с манометром (индекс Р100). Этот метод основан на том, что в ответ на ЦРП в первые 100 мс происходит лишь изометрическое сокращение дыхательной мускулатуры, а их сила или слабость в этот момент не отражаются на величине измеряемого окклюзионного давления. Средняя величина индекса Р100 у здоровых людей составляет 1,3 см вод.ст. При угнетении дыхательного центра, например вследствие передозировки наркотических анальгетиков, наблюдается выраженное снижение этого показателя. Напротив, при ДН, обусловленной другими причинами, его значения, как правило, увеличиваются.
18.3.2. Нервно-мышечная дыхательная недостаточность
Дыхательная недостаточность может быть следствием нарушения передачи нервного импульса дыхательным мышцам или патологии собственно дыхательных мышц.
При этом, несмотря на адекватную посылку (ЦРП) из дыхательного центра, нарушается способность дыхательных мышц выполнять необхо димую работу по обеспечению дыхания. Условно дисфункцию дыхательной мускулатуры, ведущую к развитию ДН в этом случае, разделяют нг< слабость и утомление.
Под слабостью дыхательной мускулатуры понимают состояние, при котором мышечная сила стойко снижается и практически не восстанавливается в условиях ее относительного «отдыха», например при проведении искусственной вентиляции легких (ИВ/1).
Слабость дыхательной мускулатуры может отмечаться при повреждении передних мотонейронов шейного или грудного отдела спинного мозга (боковой амиотрофический склероз, полиомиелит), заболеваниях периферических нервных стволов (синдром Гийена—Барре), патологии нервно-мышечных синапсов (миастения) или непосредственно заболеваниях мышц (мышечные дистрофии, полимиозит).
При некоторых обструктивных заболеваниях легких возможна слабость дыхательной мускулатуры, в частности диафрагмы, вследствие ее невыгодной позиции. В основе невыгодной позиции диафрагмы при обструктивных заболеваниях легких лежит гипервоздушность легочной i к.* ни, характеризующаяся увеличением легочных объемов и емкостей (главным образом FRC).
Гипервоздушность может быть следствием снижения эластической тяги (отдачи) легочной ткани (например, при эмфиземе легких) или удлинения времени выдоха (более 6 с) вследствие обструкции бронхов (например, при приступе бронхиальной астмы). В последнем случае гипервоздушность легочной ткани будет отмечаться, как правило, при увеличении частоты дыхания (т.е, при относительном недостатке времени для завершения полного выдоха), а сам этот феномен носит название динамической гипервоздушности легких,
Неблагоприятное влияние гипервоздушности на диафрагму как основного генератора движущего давления в дыхательных путях заключается в том, что, во-первых, при гипервоздушности легких происходит укорочение длины мышц диафрагмы, в результате чего уменьшается сила их сокращения (закон Старлинга). Во-вторых, гипервоздушность значительно изменяет геометрию диафрагмы, в частности, ведет к ее уплощению и, следовательно, увеличению радиуса ее кривизны, При этом, согласно закону Лапласа (Pd( = 2Tdi/Rdi) при том же мышечном напряжении, развиваемом диафрагмой (Tdl), при увеличении ее радиуса (Rdi), величина трансдиафрагмального давления (Pdt), необходимого для возникновения воздушного потока в дыхательных путях, будет уменьшаться. В-третьих, при гипервоздушности легких практически исчезает зона аппозиции, или та часть диафрагмы, которая прилежит к внутренней поверхности грудной клетки и играет важную роль в расширении ее нижних отделов при дыхании.
Утомление дыхательных мышц — это состояние, при котором снижение силы и скорости сокращения дыхательных мышц развивается в результате их чрезмерной работы, т.е. дисбаланса между потребностью дыхательной мускулатуры в энергии (кислороде) и ее доставкой. Работа дыхательных мышц (диафрагмы) обычно возрастает при патологии легких или грудной стенки, а доставка энергии к ним может снижаться при снижении сердечного выброса, развитии анемии или стойкой гипоксемии,
Утомление в отличие от слабости — процесс обратимый, при нем возможно восстановление функции дыхательных мышц в условиях их относительного «отдыха», например при проведении ИВЛ, а также коррекции сопутствующих нарушений (например, анемии) или же под влиянием ряда лекарственных препаратов, например теофиллина или креатин- фосфата.
Основной детерминантой утомления являются давление, развиваемое во время спокойного вдоха (Ptidai)2, и его отношение к максимальному инспираторному давлению (MIP — от англ. maximal inspiratory pressure). Отношение Ptidai/MIP отражает баланс между дыхательной нагрузкой и силой, или силовым резервом, способным эту нагрузку преодолеть. Следует отметить, что отношение Ptidal/M!P может быть увеличено
2 Ptidal — (англ.) давление вдоха при спокойном дыхании.
436 двумя путями: увеличением показателя Ptidal, что обычно происходит при заболеваниях дыхательных путей и грудной клетки, или снижением MIP при слабости дыхательных мышц. При спокойном дыхании в норме отношение Ptidal/MIP приблизительно равно 0,05. Когда же это величина этого отношения превышает пороговый уровень, равный приблизительно 0,4, то дыхательная мускулатура характеризуется состоянием утомления. При этом явное утомление, определяемое как неспособность мышц (диафрагмы) выполнять заданную нагрузку или создавать необходимый уро- веньтрансдиафрагмального давления, развивается не сразу, а через некоторый промежуток времени. Например, если отношение Ptidal/MIP равно 0,4, с момента развития состояния утомления до явного утомления проходит около 90 мин, а при значении показателя 0,6 для этого требуется всего лишь 15 мин,
Способность длительно поддерживать вентиляцию зависит также и от времени сокращения дыхательных мышц во время каждого дыхательного цикла (T/Ttot), поэтому в качестве показателя выносливости диафрагмы при резистивных нагрузках был также предложен индекс напряжение — время (TTI — от англ, tention-tfme index):
где Pd/Pdlmax — отношение трансдиафрагмалыного давления при спокойном дыхании к максимальному трансдиафрагмальному давлению.
Для измерения трансдиафрагмального давления используют специальный пищеводный катетер с двумя резиновыми баллонами, один из которых помещают в желудок, а другой — в пищевод. Разница давления между ними характеризует величину развиваемого трансдиафрагмального давления (Pdl), Оценка максимальной функции диафрагмы (PdllTWX) может быть проведена аналогичным способом с помощью маневра Мюллера, заключающегося в попытке сделать максимальный вдох с закрытыми ртом и носом. Экспериментальным путем было установлено, что утомление дыхательных мышцу человека развивается при величине TTI > 0,15.
Для выявления состояния утомления предложен также более простой и удобный индекс «напряжение — время» дыхательной мускулатуры (TTmus), не требующий, в частности, проведения зондирования пищевода и желудка:
Ттш ~ Ptidal/MIP х Т(/Тtot,
При величине показателя более 0,33 происходит быстрое развитие утомления дыхательной мускулатуры.
Утомление дыхательной мускулатуры патогенетически тесно связано с понятием «работа дыхания».
Работа дыхания по осуществлению вдоха, представляет собой интегральную характеристику механических свойств респираторной системы (комплекса легкие — грудная клетка) и равна произведению величин прилагаемого (движущего) давления (Ptidal) и соответствующего дыхательного объема (Vt):
WB ~ Ptidal х \/т (кгм).
Суммарная величина работы дыхания (W, где W = Wb х f, где f — частота дыхания в 1 мин) при минутном объеме дыхания около 10 л/мин составляет в среднем 0,2—0,3 кгм/мин.
При возникновении инспираторного потока движущее давление (Ptidai) преодолевает:
• эластическое сопротивление респираторной системы;
• резистивное (аэродинамическое или фрикционное) сопротивление дыхательных путей;
• иннерционное сопротивление респираторной системы, которым обычно пренебрегают.
Следовательно, инспираторная работа дыхательных мышц может возрастать за счет эластического или резистивного компонента.
При заболеваниях рестриктивного типа работа дыхания возрастает вследствие снижения объемной растяжимости или податливости (CRS) респираторной системы (характеристики обратной ее эластичности), характеризующей изменение легочного объема на единицу внутрилегоч- ного(альвеолярного)давления:
CRS = VT/Palv (мл/см вод.ст).
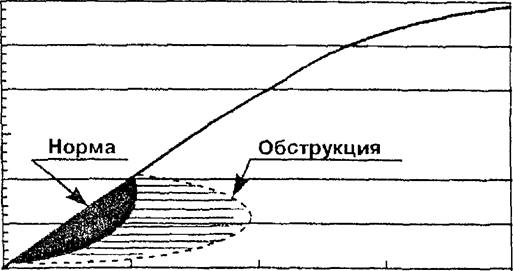
Взаимоотношение кривых давление — объем респираторной системы в статических условиях, т.е. ее податливости, показаны на рис. 18.2, А. На оси абсцисс — давление эластической отдачи респираторной
системы, измеренное в отсутствие потока воздуха, т.е. во время инспи- раторной паузы. Наклон кривой характеризует статическую податливость респираторной системы.

|

| 3 Г |
| ? : |
| Нормальная податливость |
| Сниженная податливость |
| ш О е я X о А Ю О |
| 10 20 30 Давление, см вод.ст. |
|
|
| Рис. 18.2. Работа дыхания при рестриктивных (А) и обструктивных (Б) нарушениях вентиляции [Lanken Р , 1982] |
| ш О в 03 X 5 о fi ю О |
| ? |
| О |
| zu 3D Давление, см вод.ст. |
| 4U |
| и |
В норме изменение внутрилегочного давления на 10 см вод.ст. сопровождается изменением легочного объема на 1 л, и величина CRS составляет 0,1 л/см вод.ст. Следовательно, для вдыхания объема, равного 1 л, усилие дыхательных
мышц пациента должно преодолеть давление эластической отдачи респираторной системы 10 см вод.ст.
При снижении податливости респираторной системы изменение альвеолярного давления на 10 см вод.ст. приведет к изменению объема легких, равному всего лишь 0,5 л, что будет соответствовать величине CRS 0,05 л/см вод.ст. В результате дыхательные мышцы для обеспечения прежнего уровня альвеолярной вентиляции должны будут генерировать значительно большее давление или работать с большей частотой (рис. 18.2).
Снижение податливости респираторной системы увеличивает эластическую работу дыхания (рис. 18.2, А, темный треугольник отражает эластическую работу при дыхательном объеме 1 л и нормальной величине податливости респираторной системы, а светлый треугольник отражает повышение эластической работы дыхания при том же дыхательном объеме, но меньшей податливости респираторной системы).
При заболеваниях по обструктивному варианту работа дыхания увеличивается за счет повышения резистивного сопротивления воздушному потоку (RaJ, характеризующего изменение давления по ходу дыхательных путей (трансбронхиального давления) на единицу объемной скорости воздушного потока:
Rdw = ДР/V (см вод.ст/л/с).
Если нормальное сопротивление дыхательных путей у взрослых обычно не превышает 15 см вод.ст/л/с, то при обструктивной патологии легких оно значительно возрастает. Например, во время тяжелого приступа бронхиальной астмы сопротивление дыхательных путей может увеличиваться в 20 раз. В результате возрастает резистивный компонент работы дыхания, что отражено на нижней части рис. 18.2, Б (заштрихованный сектор), где, кроме статической кривой давление—объем показаны динамические кривые для дыхательного объема 1 л при нормальном и повышенном сопротивлении воздушному потоку.
При выраженном сопротивлении дыхательных путей работа дыхания может возрастать дополнительно за счет появления активного выдоха, который в норме осуществляется пассивно, или в результате возникновения внутреннего положительного давления в конце выдоха (PEEP — от англ. positive end-expiratory pressure). PEEP представляет собой давление эластической отдачи респираторной системы вследствие неполного выдоха (например, при высокой частоте дыхания), т.е. в условиях динамической гипервоздушности легких. PEEP ведет к значительному увеличению нагрузки на респираторный аппарат, так как в этом случае начало сокращения дыхательных мышц не совпадает с появлением инспиратор- ного потока. Инспираторный поток возникает только тогда, когда давление, развиваемое инспираторными мышцами, превысит уровень PEEP.
В целом нервно-мышечная дыхательная недостаточность характеризуется рестриктивным вариантом нарушения ФВД. Дополнительным фактором развития рестриктивных нарушений ФВД при этом служит снижение податливости респираторной системы за счет формирования множественных ателектазов легочной ткани,
Общую силу дыхательных мышц можно оценить, измеряя максимальное давление в дыхательных путях на вдохе — максимальное инспи- раторное давление (MIP —от англ, maximal inspiratory pressure). В ходе исследования пациент делает форсированный вдох через закрытый мундштук, соединенный с датчиком давления.
Силу диафрагмы можно оценить изолированно по величине развиваемого ею трансдиафрагмального давления, Показателями утомления диафрагмы будут также снижение скорости релаксации (расслабления) диафрагмы при ее электростимуляции или же изменение частотного спектра ее электромиограммы. Клинически при этом отмечаются участие в дыхании вспомогательной мускулатуры (например, груди^оключично- сосцевидной мышцы), тахипноэ, тахикардия, периодическое или затрудненное дыхание (гаспинг), а также парадоксальные движения брюшной стенки, Последний феномен характеризуется втяжением передней брюшной стенки на вдохе, что обусловлено передачей отрицательного внутри- плеврального давления через «дряблую» мышцу диафрагмы на брюшную полость.
*
18.3.3. «Каркасная» дыхательная недостаточность
Основной механизм развития ДН при заболеваниях этой группы связан с уменьшением податливости грудной клетки (легочного каркаса). При этом дыхательные мышцы оказываются не в состоянии обеспечить полноценные экскурсии грудной клетки и соответственно легочной ткани.
Ограничение податливости грудной клетки может отмечаться при выраженном кифосколиозе и других аномалиях позвоночного столба или ребер, анкилозирующем спондилите (воспалительном заболевании межпозвоночных и реберно-позвоночных суставов), ожирении (при увеличении массы тела более 130 кг), а также в результате некоторых хирургических вмешательств (торакопластика) или травматических повреждений грудной клетки. При окончатом переломе ребер по нескольким линиям вероятность развития ДН особенно велика, поскольку при этом во время вдоха поврежденный участок грудной клетки обычно совершает парадоксальное движение внутрь (флотирующая грудная клетка),
Выраженный фиброз (заболевания плевры), скопление воздуха, жидкости в плевральных полостях, также могут приводить к развитию ДН. Податливость грудной клетки можеттакже уменьшаться при ограничении подвижности диафрагмы, обусловленной патологией брюшной полости (напряженный асцит, массивные опухоли, значительные увеличения печени и селезенки и т.д.).
Изменения функциональных показателей при этом характеризуются рестриктивным вариантом нарушения легочной вентиляции. Например, при выраженном кифосколиозе будет отмечаться снижение показателей TLC, VC и FRC.
18.3.4. Механизмы дыхательной недостаточности при патологии дыхательных путей
Развитие ДН при заболеваниях дыхательных путей обусловлено повышением резистивного сопротивления воздушному потоку (Rew). При этом нарушается вентиляция пораженных участков легкого, увеличивается резистивная работа дыхания, а утомление и слабость дыхательных мышц могут быть результатом неустранимой обструкции ДП.
В связи с тем что сопротивление дыхательных путей (согласно закону Пуазейля) изменяется обратно пропорционально четвертой степени радиуса их просвета, даже небольшое сужение дыхательных путей может значительно увеличить их сопротивление и, следовательно, работу дыхания в целом. Особенно это касается патологии верхних дыхательных путвй (расположенных выше бифуркации трахеи), на долю которых в норме приходится до 80 % сопротивления. Например, при сужении просвета трахеи новорожденного с 6 до 4 мм общее сопротивление дыхательных путей возрастает почти на 500 %,
Если дыхательные пути в месте сужения ригидны, воздушный поток уменьшается в равной степени как на вдохе, так и на выдохе. Такой вариант обструкции носит название фиксированной. Если же просвет дыхательных путей меняется во время дыхательного цикла, то воздушный поток будет возрастать в одну и уменьшаться — в другую фазу дыхания. В этом случае обструкция дыхательных путей называется вариабельной.
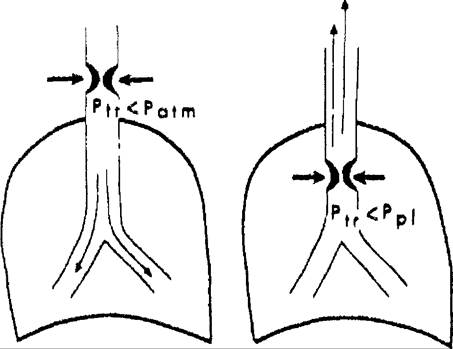
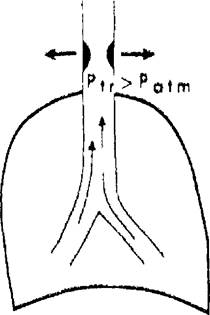
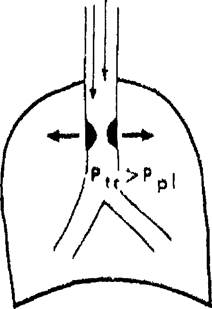
При патологии внутригрудных дыхательных путей положительное плевральное давление на выдохе будет уменьшать, а на вдохе — отрицательное внутриплевральное давление —- увеличивать их просвет (рис. 18.3).
При патологии внегрудных дыхательных путей на вдохе отрицательное давление, создаваемое в дыхательных путях, будет ниже окружающего (атмосферного) давления, что приведет к их сужению. Напротив, на
Выдох Вдох Выдох Вдох
|
|
|
Рис, /8.3. Влияние фаз дыхания на степень обструкции дыхательных путей, А — вариабельная внегрудная обструкция; Б — вариабельная внутригрудная
обструкция.
|
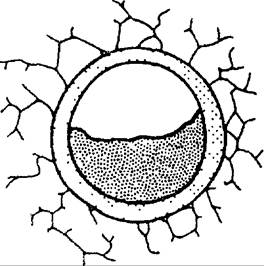
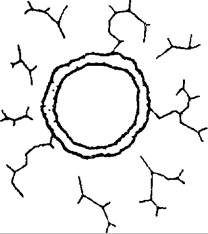
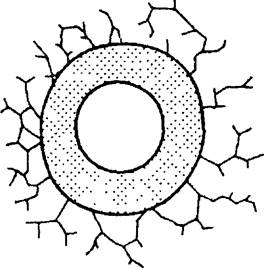 Рис. 18.4. Основные механизмы обструкции дыхательных путей.
Рис. 18.4. Основные механизмы обструкции дыхательных путей.
|
|
| А Б В |
А — внутрипросветная обструкция; Б — спазм бронхов; В — перибронхиальная
обструкция.
выдохе вследствие положительного давления, создаваемого в дыхательных путях, их просвет увеличится и степень обструкции уменьшится.
Повышение сопротивления дыхательных путей (или обструктивный вариант нарушения функций внешнего дыхания) может быть обусловлено различными механизмами.
Скопление большого количества секрета с измененными реологическими свойствами (мокроты) в просвете бронхов — нередкая причина обструкции при хронических воспалительных процессах в бронхах (хроническом бронхите). Уменьшение просвета бронхов может быть также вызвано аслирацией инородных тел, а также экзофитно растущими опухолями трахеи и бронхов.
В основе избыточного образования мокроты (гиперкринии) при хроническом бронхите лежит перестройка слизеобразующего аппарата бронхиального дерева (бокаловидных клеток и слизистых желез), вызываемая загрязнением окружающего воздуха или чаще курением. Кроме того, образование большого количества мокроты нарушает эффективность работы реснитчатого эпителия трахеи и бронхов (мукоцилиарного эскалатора), в норме эвакуирующего слизь из дыхательных путей со скоростью 6—20 мм/мин. При этом основным механизмом очистки дыхательных путей становится кашель.
Иногда избыточная задержка секрета вдыхательных путях является следствием нарушений, связанных с генетически обусловленной патологией, например при синдроме неподвижных ресничек (синдроме Карта- генера) или легочном муковисцидозе (кистозном фиброзе). При синдроме неподвижных ресничек различные генетические нарушения структуры (описано более 20) и функции реснитчатого аппарата эпителиальных клеток организма (например, отсутствие в структуре ресничек нитей особого белка динеина при синдроме Картагенера) ведут не только к нарушению мукоцилиарного транспорта, но и к частому развитию хронического синусита, образованию бронхоэктазов, бесплодию и обратному расположению внутренних органов (situs inversus).
При муковисцидозе к избыточному скоплению вязкой мокроты в дыхательных путях приводит нарушение процессов гидратации (разжи
жения) бронхиального секрета в связи с генетическим дефектом (их описано более 200) особого транспортного белка — трансмембранного регулятора муковисцидоза (CFTR — от англ. cystic fibrosis transmembrane regulator), который обеспечивает транспорт ионов хлора через апикальную часть мембраны эпителиальных клеток бронхов. Вследствие этого дефекта анионы хлора задерживаются в клетках, усиливают абсорбцию катионов натрия и воды, «высушивая» слизь, продуцируемую всеми эк- зокринными железами организма.
Повышение тонуса гладкой мускулатуры — бронхоспазм является основой обструкций дыхательных путей при бронхиальной астме, возникающей в ответ на воздействие аллергенов. Бронхоконстрикции, индуцированной выделение медиаторов (гистамин, лейкотриены), сопутствует также отек слизистой бронхов, связанный с привлечением клеток, способствующих воспалительной реакции.
Утолщение и фиброзные изменения бронхов, наблюдаемые при многолетных воспалительных процессах в бронхах или длительно и часто рецидивирующих бронхоспастических реакциях, также могут обусловить обструкцию дыхательных путей.
Перибронхиальная обструкция дыхательных путей может быть локализованной, например при сдавлении дыхательных путей извне увеличенным лимфатическим узлом, опухолью, расширенным сосудом или генерализованной. Генерализованная перибронхиальная обструкция дыхательных путей возможна при эмфиземе легких, характеризующейся деструкцией и расширением воздушных пространств, расположенны дис- тальнее терминальных бронхиол. В основе ее развития лежит дисбаланс протеазно-антипротеазной системы легочной ткани, при котором уменьшение антипротеазной (например, при врожденной недостаточности фермента альфа-1 -антитрипсина) или увеличение протеазной активности (например, активации фермента нейтрофильной эластазы в результате курения) ведет к разрушению эластических волокон соединительнотканного остова легких.
Основной механизм экспираторной обструкции при эмфиземе легких рассматривается на модели дыхательной системы, в которой легкие представлены эластическим шаром, а дыхательные пути — открытой в атмосферу трубкой, содержащей коллабируемый сегмент При этом легкие и дыхательные пути заключены в общую камеру — гоудную клетку (рис. 18.5).
В норме внешнее давление, оказываемое на дыхательные пути, в большой мере будет определяться плевральным давлением. Когда плевральное давление становится резко положительным, например при форсированном выдохе, дыхательные пути сдавливаются извне и только благодаря противодействующему давлению внутри дыхательных путей они не спадаются полностью. Два основных фактора определяют уровень внутреннего противодействующего давления в дыхательных путях: давление эластической отдачи легочной ткани и плевральное давление, сдавливающие альвеолы, порождающие экспираторный поток.
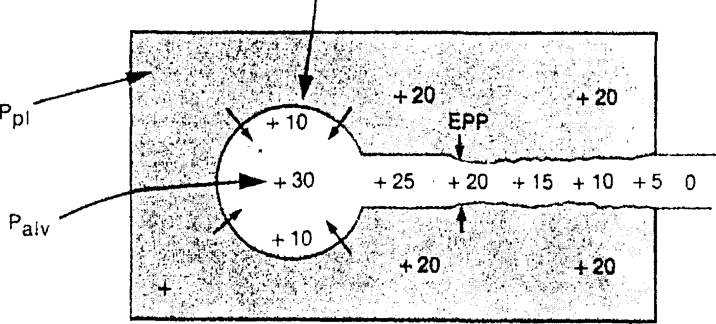 Рис. 18.5. Схематическое изображение легких, демонстрирующее механизм
Рис. 18.5. Схематическое изображение легких, демонстрирующее механизм
|
динамической компрессии дыхательных путей. Альвеолярное давление складывается из двух составляющих — плеврального давления (Рр! = 20 см вод. ст.) и давления эластической отдачи легочной ткани (Ре| - 10 см вод. ст.).
EPP (equal pressure point) — точка равного давления.
При возникновении воздушного потока отмечается постепенное падение давления внутри дыхательных путей (закон Бернулли), и по их ходу возникает некая точка (местоположение которой зависит от объема легких), в которой внутреннее давление равно внешнему, т.е. плевральному давлению (так называемая точка равного давления). При увеличении силы выдоха и, следовательно, величины плеврального давления последнее в равной степени будет влиять как на альвеолы, так и на дыхательные пути, заключенные внутри грудной клетки.
Движущим давлением в этом случае становится разница давления в альвеолах и точке равного давления, т.е. давление эластической отдачи легочной ткани. При большем усилии выдоха растущее альвеолярное (движущее) давление будет нивелироваться ростом внешнего давления, сдавливающего дыхательные пути. Следовательно, в норме давление эластической отдачи легких является важнейшей детерминантой экспираторного потока, в то время как плевральное давление, зависящее от экспираторного усилия дыхательных мышц, влияет на него в значительно меньшей степени, по крайней мере в конечной части экспираторного потока, где он практически перестает зависеть от усилия.
При эмфиземе легких, вследствие деструкции альвеолярных перегородок снижается давление эластической отдачи легочной ткани или ее эластичность, т.е. способность противодействовать растяжению. Следствием снижения эластичности является уменьшение движущего давления, которое способствует «выталкиванию» воздуха из альвеол во время выдоха. Кроме того, снижение эластической отдачи легочной ткани способствует усилению экспираторного сужения (коллапса) мелких бронхов. В норме легочная паренхима оказывает растягивающее воздействие на дыхательные пути, создавая для них своеобразный внешний каркас. При деструкции межальвеолярных перегородок уменьшается их радиальная тракция, поддерживающая просвет дыхательных путей. Во время выдоха положительное плевральное давление легко сдавливает мелкие бронхи, что ведет к их коллапсу и задержке воздуха в легочной ткани с развитием ее гипервоздушности («воздушная ловушка»).
Дата добавления: 2015-02-05; просмотров: 834;
