Предельные одноатомные спирты
Номенклатура.Для названия спиртов используют рациональную и систематическую номенклатуры.
По рациональной номенклатуре названия спиртов образуются от названия соответствующего радикала, связанного с гидроксильной группой и добавлением слова «спирт».
По систематической номенклатуре название дается от названия углеводорода с добавлением суффикса –ол.
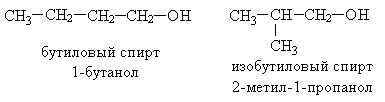
Изомерияв спиртах обусловлена изменениями в структуре углеводородного скелета и положением ОН- группы.
Способы получения спиртов.Существуют различныеспособы получения спиртов. Здесь приводятся лишь некоторые из них.
1. Ферментивный гидролиз и брожение углеводов. По этому способу этиловый спирт получают из продуктов, содержащих глюкозу или другие сахара. При брожении глюкозы под действием ферментов дрожжей образуется этанол:
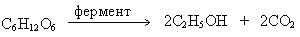
Брожение фруктовых соков, особенно виноградного, дает спиртовые растворы с содержанием этанола 10 – 15 %, которые называют винами.
Для получения этанола в больших количествах в качестве исходного вещества берется более дешевый углевод – крахмал. Образование спирта из крахмалсодержащих продуктов складывается из следующих стадий:
а) осахаривание крахмала:
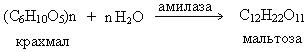
Процесс образования мальтозы протекает под действием фермента амилазы, содержащегося в солоде - проросших и высушенных зернах ячменя.
б) брожение осахаренного раствора. Этот процесс протекает под действием ферментов, которые содержатся в дрожжах:
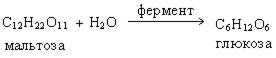
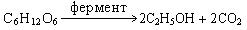
Обе стадии являются результатом совместного действия самых различных ферментов, содержащихся в дрожжах. Эти ферменты называют еще энзимы. Полученный в результате брожения раствор содержит 18 % этанола. Эту смесь подвергают перегонке и получают спирт-сырец с содержанием этанола 90 %. Дополнительная перегонка дает спирт-ректификат с содержанием этанола 95,5 %. Абсолютный спирт (100% этанола) можно получить путем азеотропной перегонки с бензолом.
В процессе брожения наряду с этанолом получаются сивушные масла, которые понижают качество спирта. Они представляют собой смесь изомерных спиртов с числом углеродных атомов С3 - С5.
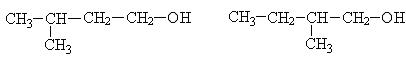
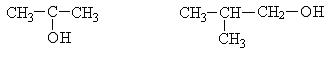
Сивушные масла получаются за счет разложения белковых компонентов входящих в состав исходного крахмалсодержащего сырья.
Этанол, полученный по этой технологии, после дополнительной очистки, используется для изготовления алкогольной продукции. Если в качестве исходного сырья, вместо крахмала, использовать целлюлозу, то получают «гидролизный» спирт, который используют только для технических нужд. Процесс получения этанола из целлюлозы складывается из следующих стадий:
а) гидролиз целлюлозы:
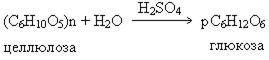
б) брожение под действием ферментов дрожжей:
С6Н12О6 ® 2С2Н5ОН + 2СО2
В качестве исходного сырья используются отходы деревоперерабатывающей промышленности и гидролиз проводят в жестких условиях в присутствии H2SO4.
2. Гидратация алкенов. В присутствии катализаторов олифины присоединяют воду, образуя спирты. Присоединение воды к несимметричным алкенам происходит по правилу Морковникова с образованием вторичных и третичных спиртов.
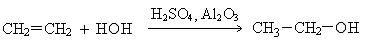
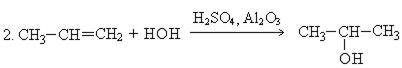
3. Гидролиз галогенпроизводных:
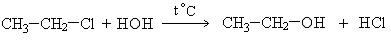
4. Восстановление альдегидов и кетонов:
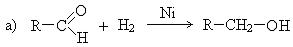
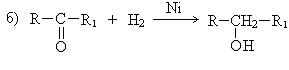
Восстановление альдегидов дает первичные спирты, восстановление кетонов – вторичные.
5. Восстановление сложных эфиров:
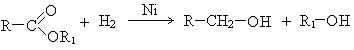
6. Гидролиз сложных эфиров. Реакция обратима и требует регулирования для повышения выхода спиртов:
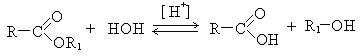
7. Синтез альдегидов через металлоорганические соединения:
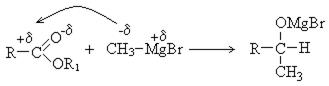
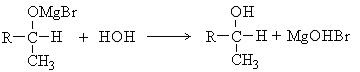
Химические свойства спиртов.Основным структурным элементом, определяющим реакционную способность спиртов является гидроксогруппа. Основными направлениями реакционной способности являются реакции с разрывом связей по направлениям I и II. Акцепторные свойства кислорода обеспечивают высокую полярность связей по этим направлениям.
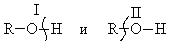
I направление.
За счет полярности связи О-Н спирты обладают определенной кислотностью и диссоциируют по схеме:
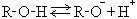
Большей кислотностью обладают первичные спирты, меньшей – третичные и соблюдается последовательность:
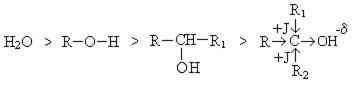
Меньшая кислотность третичных спиртов обясняется положительными индукционными эффектами алкильных групп, которые увеличивают электронную плотность на углероде и кислороде.
1. Взаимодействие с металлами:
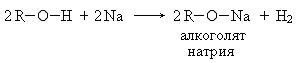
2. Реакция этерификации:
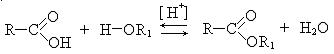
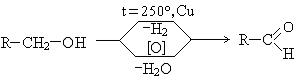
3. Реакции окисления. В зависимости от природы спирта реакции окисления протекают по-разному. Эти реакции могут проходить как реакции дегидрирования и как реакции окисления. Окисление первичных спиртов дает альдегиды:
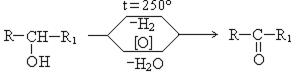
Окисление вторичных спиртов дает кетоны:
Третичные спирты окисляются с разрывом углеводородной цепочки и образованием смеси кислот и кетонов:
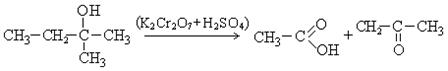
II направление.
1. Гидрогалогенирование спиртов. Реакцию проводят в присутствии водоотнимающих веществ:
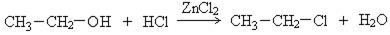
Реакционная способность спиртов изменяется в последовательности:
третичный > вторичный > первичный
2. Взаимодействие с галогенидами фосфора:
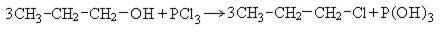
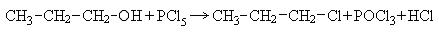
3. Внутримолекулярная и межмолекулярная дегидратация спиртов. В жестких условиях, при t > 180 0С, проходит внутримолекулярная дегидратация в соответствии с правилом Зайцева:
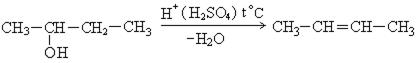
В мягких условиях идет межмолекулярная дегидратация с образованием эфиров:
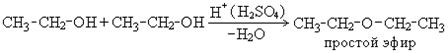
Физические свойства спиртов и их применение.Спирты с числом углеродных атомов С1 – С10 – жидкости, выше – твердые вещества. Растворимость спиртов с увеличением молекулярной массы понижается, температура кипения увеличивается. Аномально высокие температуры кипения для спиртов объясняяются возможностью образования ассоциатов за счет водородных связей
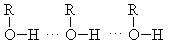
Спирты изостроения имеют более высокие температуры кипения, чем спирты нормального строения.
Метанол. Основное его количество получали путем сухой перегонки древесины. В настоящее время в промышленности метанол получают по следующей схеме:
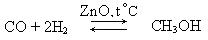
Метанол имеет широкое и разностороннее применение. Значительные количества его потребляются для получения формальдегида, метиламина, красителей, фармакологических препаратов. Метанол – хороший растворитель и используется для растворения щелочи, употребляется для очистки бензинов, в лакокрасочной промышленности и др. Надо помнить, что метанол – сильнейший яд, вызывающий слепоту и паралич.
Коварность метилового спирта состоит в том, что он очень похож на этанол.
Этанол. Используется в пищевой промышленности для изготовления ликеро-водочной продукции, для получения сложных эфиров, применяемых в кондитерском производстве. В парфюмерии этанол используют как растворитель. Его содержание в кремах – 5-10 %, лосьонах – 10 – 60%, дезодорантах – до 80%).
Высокомолекулярные первичные спирты.
Цетиловый спирт (С15Н31СН2ОН) в составе сложного эфира входит в состав спермацета, выделяемого из черепных костей китов. Спермацет используется в парфюмерии и получении синтетических моющих средств.
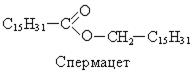
Мирициловый спирт (С30Н61-СН-ОН) в связанном состоянии входит в состав пчелиного воска:
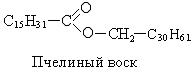
Двухатомные спирты (гликоли)
Двухатомные спирты содержат в своем составе две гидроксильные группы. Общая формула гликолей СnH2n(OH)2.
По систематической номенклатуре названия двухатомных спиртов образуются от названия соответствующих алканов с прибавлением окончания «диол», положение -ОН групп указывается цифрами
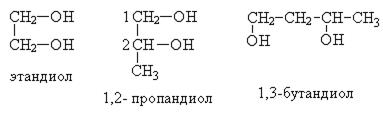
По рациональной номенклатуре сохраняются названия от соответствующих алкенов с прибавлением слова «гликоль»
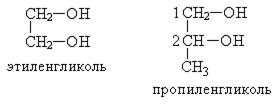
Способы получения гликолей.Двухатомные спирты можно получить теми же способами, что и одноатомные спирты, или другими. Важнейшие из них – следующие:
1. Гидролиз дигалогенопроизводных:
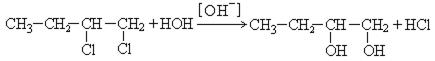
2. Гипохлорирование алкенов:
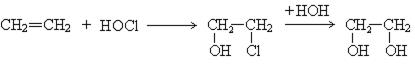
3. Гидролиз окиси этилена:
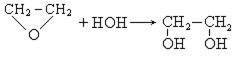
4. Окисление алкенов.
Химические свойства.За счет взаимного влияния атомов подвижность водорода в гидроксильных группах этиленгликоля значительно больше, чем в спиртах. Гликоли обладают большими кислыми свойствами, чем спирты, и взаимодействуют не только с активными металлами, но и с гидроксидами металлов, образуюя комплексные структуры.
1. Взаимодействие с Cu(OH)2 (качественная реакция на гликоли):
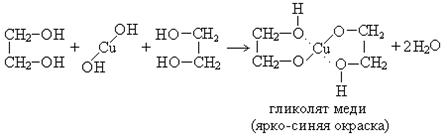
2. Взаимодействие со спиртами:
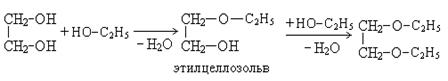
При этом происходит образование моно- и дипроизводных.
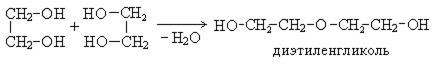
3. Межмолекулярная дегидратация гликолей:
4. Взаимодействие с минеральными кислотами:
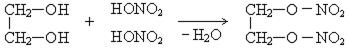
Нитроэфиры обладают взрывчатыми свойствами.
5. Гидрогалогенирование этиленгликоля:
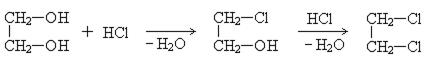
Применение.Этиленгликоль – вязкая бесцветная жидкость, значительно уменьшает температуру замерзания воды и поэтому используется как антифриз, 60% водный раствор этиленгликоля замерзает при -50°С. Этиленгликоль применяется в органическом синтезе для получения полиэфиров, смол, волокна ловсан.
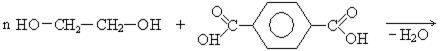
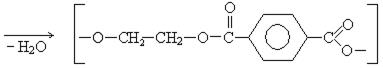
лавсан
Применяется также при изготовлении печатных красок, нанесении рисунка на ткань.
Дата добавления: 2015-03-19; просмотров: 4627;
