Способы получения.
1. Гидролиз галогенпроизводных:
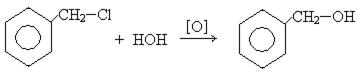
бензиловый спирт
2. Восстановление ароматических альдегидов:
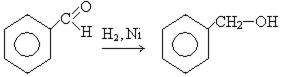
3. Реакция Конниццаро. При действии на смесь двух альдегидов концентрированным раствором щелочи получают спирт и кислоту:
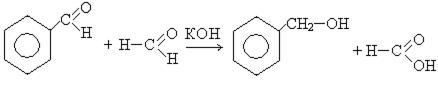
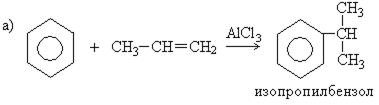
4. Синтез из ароматических углеводородов и окисей с применением в качестве катализатора хлорида алюминия:
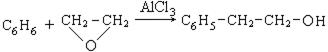
Химические свойства и применение. Спирты с гидроксильной группой в α- положении легко вступают в реакцию гидрогалогенирования (SN):
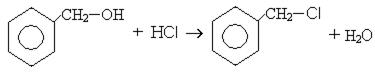
Спирты с гидроксильной группой в β- положении легко дегидратируются (Е):
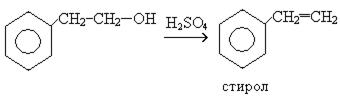
Бензиловый спирт в виде сложных эфиров уксусной и бензойной кислот используется в парфюмерии. Сложные эфиры бензилового спирта и коричной и бензойной кислот входят в состав природных масел, бальзамов, обуславливают запах жасмина, гиацинта, туберозы.
β-фенилэтиловый спирт содержится в розовом масле, применяется в парфюмерии, как стабилизатор запахов.
Фенолы
Фенолы – гидроксисоединения, в молекулах которых гидроксильные группы связаны непосредственно с бензольным кольцом.
Фенолы в зависимости от количества гидроксильных групп делятся на одно-, двух-, трехатомные и многоатомные:
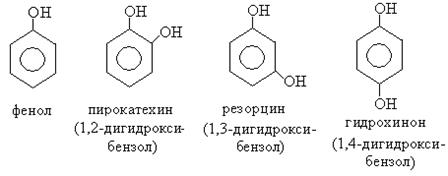
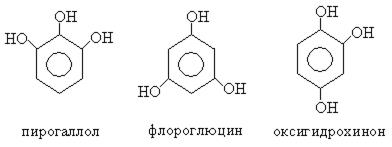
Фенолы имеют либо тривиальные названия, либо их называют как замещенные бензола.
Фенольные структуры в виде глюкозидов входят в состав растительных тканей.
Способы получения.Существует несколько методов введения гидроксильной группы в ароматическое кольцо. Некоторые из них имеют промышленное применение:
1. Сплавление натриевых солей сульфокислот со щелочами:
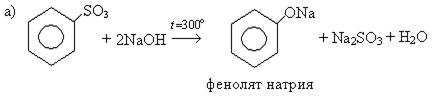
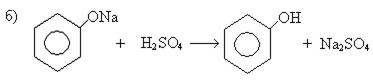
2. Из подсмольной жидкости коксохимических производств.
3. Гидролиз галогенпроизводных. В технике фенол получают с хорошим выходом из хлобензола. Процесс проходит в жестких условиях, так как хлор, связанный с ядром, малоподвижен:
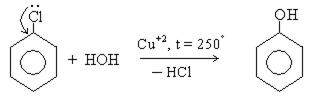
4. Окислительное декарбоксилирование карбоновых кислот:
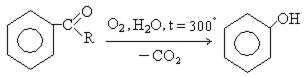
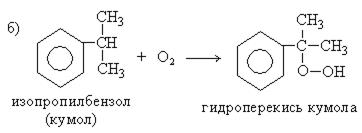
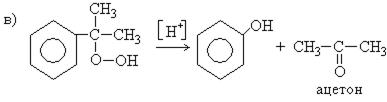
5. Совместный способ получения фенола и ацетона ( способ Сергеева, Кружалова-Немцова):
6. Получение фенола из аминов через реакцию диазотирования (реакция Зандмейера):
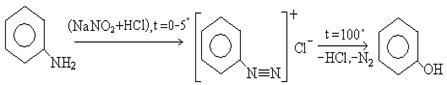
диазосоли
7. Производные фенолов входят в состав эфирных масел:
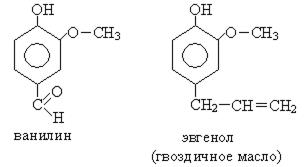
Химические свойства.Основными реакционными центрами в феноле является гидроксильная группа и ароматическое бензольное кольцо. Отсюда типичными реакциями являются:
– реакции гидроксильной группы;
– реакции электрофильного замещения в бензольном кольце.
I. Реакции гидроксильной группы.
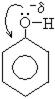
1. Кислотно-основные свойства фенола. Кислотные свойства фенола (то есть способность отдавать протон) выражены значительно сильнее, чем в спиртах. Это обусловлено эффектом сопряжения электронной пары кислорода в феноле с ароматическим бензольным кольцом. В результате чего отрицательный заряд на кислороде значительно меньше и протон легко отрывается. В спиртах такого не наблюдается, поэтому фенол называют еще карболовой кислотой.
Высокая кислотность фенола позволяет ему взаимодействуют не только с активными металлами, но и с гидроксидами щелочных металлов.
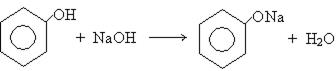
фенолят натрия
2. Взаимодействие с галогидными алкинами:
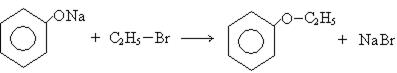
фенилэтиловый
эфир
3. Взаимодействие с хлоруксусной кислотой:
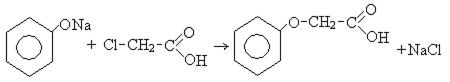
фениловый эфир
уксусной кислоты
4. Взаимодействие с хлорангидридами кислот:
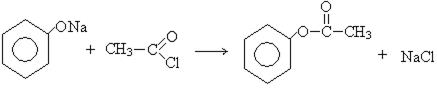
хлорангидрид
уксусной кислоты
5. Взаимодействие с ангидридами карбоновых кислот:
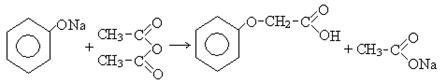
уксусный
ангидрид
II. Реакции электрофильного замещения в бензольном кольце.
Взаимное влияние атомов в молекуле фенола проявляется не только в особенностях поведения гидроксигруппы, но и в большей реакционной способности бензольного ядра. Гидроксильная группа повышает электронную плотность в бензольном кольце, особенно, в орто- и пара-положениях (+М-эффект ОН-группы);
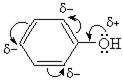
поэтому фенол значительно активнее бензола вступает в реакции электрофильного замещения (SE) в ароматическом кольце.
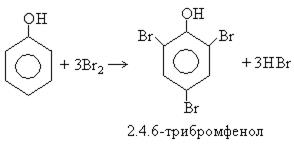
1. Галоидирование. Фенол легко при комнатной температуре взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол):
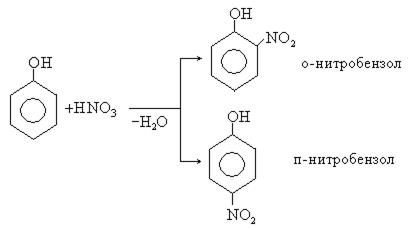
2. Реакция нитрования. Под действием 20% азотной кислоты фенол легко превращается в смесь орто- и пара-нитрофенолов. Изомерные нитрофенолы легко разделяются благодаря тому, что только орто-изомер обладает летучестью с водяным паром. Высокая летучесть орто-нитрофенолов объясняется образованием внутримолекулярной водородной связи.
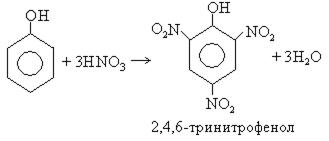
При использовании концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота):
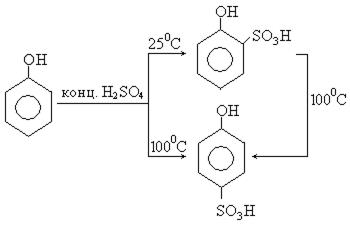
3. При сульфировании фенолов получаются о- и п-фенолсульфокислоты. При комнатной температуре концентрированная серная кислота дает главным образом о-изомер, в то время как при 100 0С преобладает п-изомер. Изомеры разделяют благодаря различной растворимости их бариевых солей:
Применение фенола и его производных. Фенол – кристаллическое вещество, обладает бактерицидными, дезинфицирующими свойствами и под названием карболовая кислота используется в медицине. Фенол делает глубокие и сильные ожоги на теле. Используется для получения фенолформальдегидных смол:
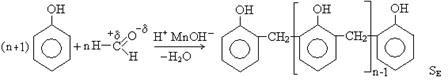
Фенолформальдегидные смолы называют еще бакелиты. При проведении полимеризации в кислой среде получают новолочные смолы, которые характеризуются линейной структурой, при этом конденсация происходит в орто- положения фенола. В щелочной среде получаются резолы, характеризующиеся сшивкой молекулы по орто- и пара- положениям. Эта реакция конденсации является реакцией электрофильного замещения, электрофилом выступает углерод карбонильной группы альдегида.
Фенольные соединения в виде гликозидов широко распространены в природе, к примеру, арбутин, который содержится в листьях и семенах груши. При ферментативном гидролизе арбутина образуется гидрохинон, который при окислении дает специфическую черную окраску. Этим объясняется почернение листьев груши осенью.
Фенольные соединения являются составной частью лигнина и содержатся почти во всех растениях. В коре дуба содержится до 20% фенольных соединений. В честь этого растения, являющегося одним из первых и довольно богатым источником получения фенольных соединений, они были названы дубильными веществами. Букет выдержанного коньяка обусловлен окислением фенольного производного – кониферилового спирта в ванилин, который и сообщает характерный аромат.
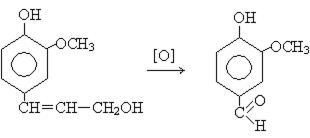
конифериловый ванилин
спирт
Фенольный фрагмент входит и в состав антоцианов – структур, обуславливающих богатую цветовую гамму различных цветов. В зависимости от природы радикалов R1 и R2 цвета могут быть самые различные.
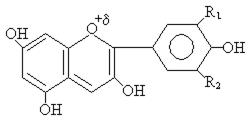
R1 = H
- Цианидин (цвет василька)
R2 = OH
Фенольные структуры входят в состав дубильных веществ (галловая кислота содержится в коре ивы и дуба). Терпкость чая обусловлена присутствием катехинов.
Двухатомные фенолы используются как антиоксиданты. Механизм действия следующий:
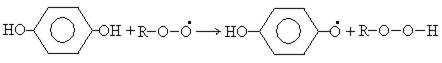
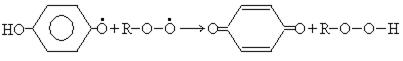
Фенольные антиоксиданты широко используются в пищевой промышленности для предотвращения порчи жиров, масел, кремов. Наиболее распространенные среди них:
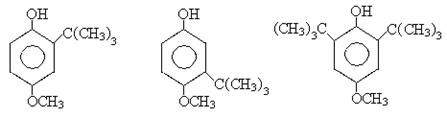
2- трет-бутил 3- трет-бутил 2, 6- дитрет-бутил
4- метоксифенол 4- метоксифенол 4 – метоксифенол
Дата добавления: 2015-03-19; просмотров: 3290;
