РАЗДЕЛ 5. Галогенпроизводные углеводородов
Галогенпроизводные – это соединения, полученные замещением одного или нескольких атомов водорода в углеводороде на галогены F, Br, J, Cl.
Различают галогенпроизводные предельных, непредельных, ароматических углеводородов и циклопарафинов.
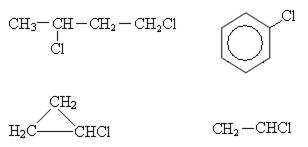
Изомерия в ряду галогенпроизводных предельных и непредельных углеводородов обусловлена: изменением структуры самого углеродного скелета и положением галогена.
Номенклатура.В ряду галогенпроизводныхразличают рациональную и систематическую номенклатуры. По рациональной номенклатуре название дается от названия радикала, связанного с галогеном с добавлением слова «хлористый» или «хлорид».

По систематической номенклатуре ― нумеруют углеводородную цепочку, цифрой указывают положение галогена и называют углеводород в зависимости от класса.
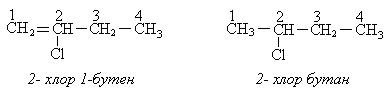
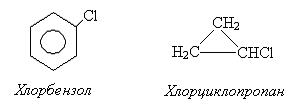
Способы получения.Существует несколько способов получения галогенпроизводных.
I. Прямое галоидирование различных углеводородов:
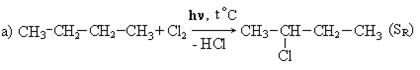
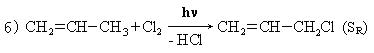
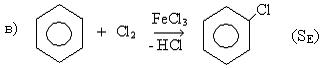
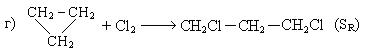
II. Гидрогалогенирование углеводородов:
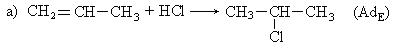
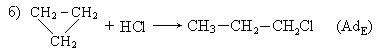
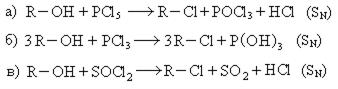
III. Взаимодействие спиртов с галогенидами фосфора и хлористым тионилом:
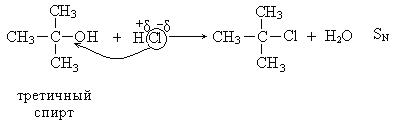
IV. Гидрогалогенирование спиртов.
1. Третичные спирты в этой реакции взаимодействуют по механизму нуклеофильного замещения и реакция является мономолекулярной (SN1), так как общая скорость реакции зависит только от концентрации спирта.
Механизм реакции:
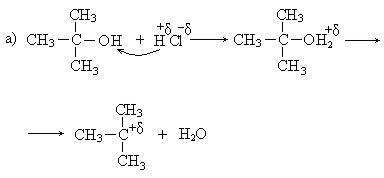
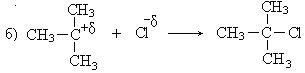
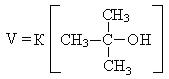
Реакционная способность спиртов в реакции гидрогалогенирования изменяется в следующей последовательности:
трет. > втор. > перв.
2. Первичные спирты взаимодействуют в этой реакции по механизму нуклеофильного замещения, бимолекулярному (SN2):
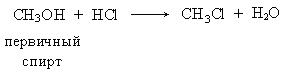
Механизм реакции:
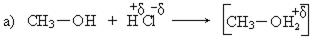
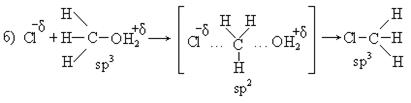
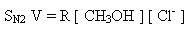
V. Фторхлоргалогенпроизводные можно получить по схеме:
3CCl4 + 2SbF3 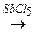 3CCl2F2 + 2SCl3,
3CCl2F2 + 2SCl3,
Фреон-12
Химические свойства галогенпроизводных.Галогенпроизводные – это один из наиболее реакционноспособных классов органических соединений. Связь углерод-галоген достаточно полярна и легко разрывается.
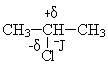
Типичными реакциями галогенпроизводных являются реакции нуклеофильного замещения SN1 и SN2, а также реакции элиминирования Е1 и Е2.
1. Реакции нуклеофильного замещения (SN). Гидролиз третичных галогенпроизводных проходит по механизму нуклеофильного замещения (SN1):
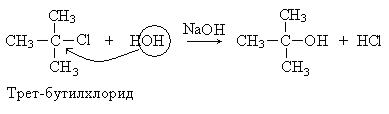
Механизм реакции:
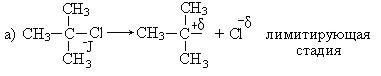
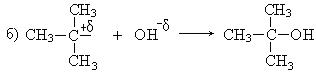
Общая скорость реакции определяется скоростью лимитирующей стадии и зависит только от концентрации галогенпроизводного.
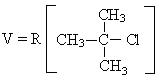
Гидролиз первичных галогенпроизводных происходит по механизму нуклеофильного замещения (SN2):

Механизм реакции:
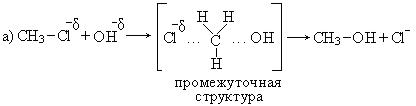
Общая скорость реакции зависит от концентрации галогенпроизводного и от концентрации воды.
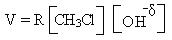
2. Реакции элиминирования (Е). Галогенпроизводные способны отщеплять галогенводороды с образованием алкенов. Реакции элиминирования также могут проходить по мономолекулярному Е1 и бимолекулярному Е2 механизмам. Третичные галогенпроизводные взаимодействуют по Е1-механизму:
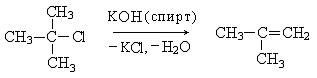
Механизм реакции:
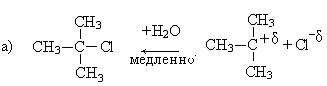
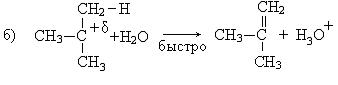
Реакции элиминирования и реакции нуклеофильного замещения являются конкурирующими реакциями и в мягких условиях (водные растворы щелочей) образуются спирты (SN), в жестких условиях (спиртовой раствор КОН, температура) образуются алкены (Е).
В отличие от галогеналкилов простые галогенарилы очень нереакционные вещества по отношению к нуклеофильным реагентам.
К примеру, в хлорбензоле подвижность галогена значительно меньше, чем в галогеналкилах, так как эффект сопряжения (+М) значительно больше отрицательного индукционного эффекта (-I), вызванного галогеном. Галоген сильнее удерживается ядром и реакции гидролиза (SN) протекают в очень жестких условиях.
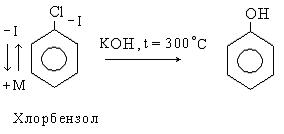
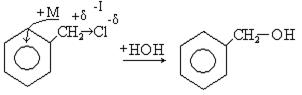
В случае бензилхлорида подвижность галогена увеличивается, он практически не удерживается ядром, так как положительный заряд (+δ) на атоме углерода входит в сопряжение с бензольным кольцом. Реакции гидролиза протекают в мягких условиях и очень легко.
Реакционная способность непредельных галогенпроизводных в реакциях нуклеофильного замещения зависит от положения галогена по отношению к двойной связи.
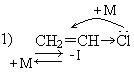
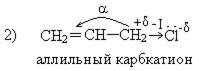
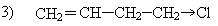
В первом случае реакции нуклеофильного замещения(SN) протекают с большим трудом за счет противоположного действия индукционного(-I) и мезомерного эффекта (+М).
Во втором случае подвижность галогена значительно увеличивается, реакции нуклеофильного замещения протекают легко. В этом случае образуется очень стабильный аллильный карбкатион, стабилизированный сопряжением. По устойчивости карбкатионы можно расположить в следующий ряд:
аллильный > бензильный > третичный > вторичный > первичный
В третьем случае подвижность галогена соответствует подвижности галогенпроизводных в алканах.
3. Взаимодействие галогенпроизводных с алкоголятами щелочных металлов позволяет получить простые эфиры:
С2H5Br + NaOC2H5 ® С2H5-O-C2H5 + NaBr
4. Взаимодействие галогенпроизводных с солями синильной кислоты. В результате реакции образуются нитрилы, последующий гидролиз которых дает карбоновые кислоты:
С2H5Br + KCN ®СН3-СН2-CN + KBr
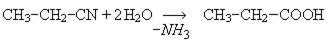
5. Реакция Финкельштейна. При действии солей галогенводородных кислот на галогенпроизводные можно заменить один галоген другим:
R-Cl + NaI ® R-I + NaCl
R-I + AgCl ® R-Cl + AgI
6. Взаимодействие галогенпроизводных с аммиаком. Происходит алкилирование с образованием солей аммониевых оснований:
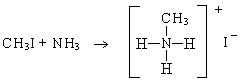
четвертичные соли
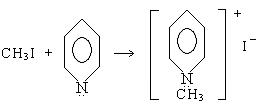
пиридин
Применение галогенпроизводных.Присутствие галогена в органическом соединении приводит к тому, что эти структуры обладают отрицательным воздействием на биологические объекты. Среди галогенпроизводных инсектициды, гербициды, боевые отравляющие вещества, средства наркоза.
К инсектицидам относятся: гексахлоран, гексахлорэтан, дихлордифенилтрихлорметилметан (ДДТ, дуст):
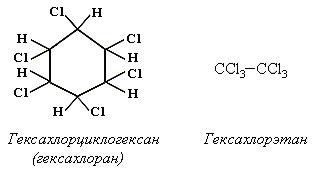
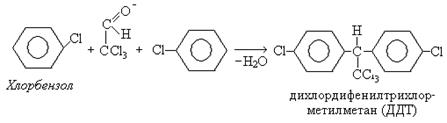
Последствия использования ДДТ сказываются до сих пор, поскольку ДДТ растворяется в глицеридах и концентрируется в подкожном жире рыб, животных, человека и не выводится организмом.
К галогенпроизводным относится и слезоточивый газ «черемуха», основу которого составляет хлорацетофенон (ХАВ, СN):
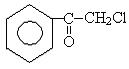
Галогенпроизводные углеводородов являются негорючими растворителями. Используются в тушении электроустановок. Хлороформ используется для наркоза, трихлорэтилен при химической чистке одежды.
Фтор-, хлор- производные углеводородов, известные как фреоны, используются в качестве хладагентов.
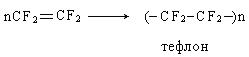
Пиролизом фреона-22 образуется тетрафторэтилен, полимеризацией которого получают политетрафторэтилен («тефлон»), который используется для футеровки емкостей, хозяйственной посуды.
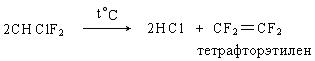
Контрольные вопросы
1. Напишите структурные формулы всех изомерных соединений состава С4Н9Cl и назовите их по рациональной и международной номенклатурам.
2. Напишите уравнения реакций получения всеми возможными способами: а) бромэтана; б) 2-йодпропана; в) хлорметана.
3. Напишите формулы всех хлорпроизводных метана. Укажите, какие из этих веществ поляризован. Приведите объяснения.
4. Какие соединения называются фреонами? Приведите уравнение реакции получения фреонов.
5. Приведите реакции, характеризующие свойства галогенпроизводных ароматических углеводородов.
Дата добавления: 2015-03-19; просмотров: 3734;
