Раздел 2. ОСНОВЫ ТЕОРИИ ФОРМИРОВАНИЯ КРИСТАЛЛИЧЕСКОЙ СТРУКТУРЫ ОТЛИВОК 1 страница
Среди литейных процессов центральное место занимает переход сплава из жидкого в твердое кристаллическое состояние. Этот процесс является фазовым переходом первого рода, связанным с изменением объема, теплосодержания и энтропии. При рассмотрении данного процесса можно выделить два аспекта: количественный и качественный. Количественный аспект составляет содержание теории затвердевания, главной задачей которой является разработка методов расчета кинетики выделения твердой фазы в объеме расплава. Качественный аспект направлен на рассмотрение вопросов формирования кристаллической структуры отливок и методов управления ею.
ГЛАВА 2.1. ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ САМОПРОИЗВОЛЬНОЙ КРИСТАЛЛИЗАЦИИ МЕТАЛЛОВ И СПЛАВОВ
Современная теория формирования кристаллической структуры отливок .создана за последние 20 лет на основе творческого распространения элементарной теории кристаллизации металлов и сплавов на большие объемы неизотермически затвердевающих расплавов.
Жидкий металл переходит в твердое состояние в соответствии с общими законами термодинамики. Как известно, самопроизвольно протекают те процессы, в которых уменьшается свободная энергия и энергия Гиббса G. На рис. 2.1 приведены кривые изменения энергии Гиббса твердого и жидкого металла в зависимости от изменения температуры. Видно, что при температуре, большей Тпл, Gж < Gтв и устойчивым является жидкое состояние металла. При T < Tпл Gтв < Gж, поэтому устойчивым является твердое состояние. Температура Т = Tпл, при которой Gтв = Gж, называется температурой плавления. При равновесном процессе перехода из жидкого состояния в твердое эта температура соответствует равновесной температуре кристаллизации сплава Tкр. "При снижении температуры ниже Ткр возникает переохлаждение ΔT = Tкр — Т. Так как при этом Gж > Gтв, то создаются термодинамические предпосылки для перехода из жидкого состояния в твердое, т. е. для кристаллизации. Движущей силой этого процесса будет разность энергий Гиббса ΔG = Gж — Gтв. Преобразуем это выражение, прибавив и отняв энергии Гиббса жидкой и твердой фаз при T = Ткр.
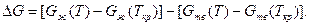
Так как Gж(Ткp) = Gтв(Ткр), то равенство при этой операции не нарушится. Поскольку реальные переохлаждения металлов не велики, то для стоящих в квадратных скобках выра-
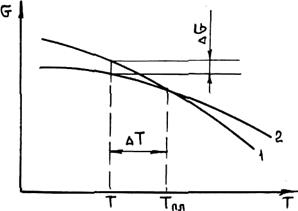
Рис. 2.1. Зависимость энергии Гиббса жидкого (/) и твердого (2) металла от температуры
жений можно написать следующие приближенные равенства:
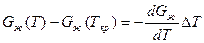 ,
,
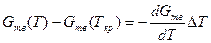 .
.
С учетом этого ΔG = —ΔТ(dGж/dТ — dGтв/dТ). Так как dG/dТ = —S, то ΔG = +ΔT×ΔS, где ΔS — изменение энтропии при плавлении металла. Как известно, ΔS = L/Tпл, где L— молярная теплота плавления, следовательно, ΔG = L×ΔT/Гкр. Из этого выражения видно, что с ростом переохлаждения движущая сила кристаллизации увеличивается.
Следует отметить, что при кристаллизации возникает новая фаза, имеющая физическую поверхность раздела с жидкостью. Поэтому кристаллизация связана с затратами энергии на образование и рост данной поверхности раздела фаз. Величина этой энергии равна Es = sк-ж×S, где sк-ж — межфазная энергия на границе раздела фаз; S — поверхность растущего кристалла. В результате образования кристалла объемом V с поверхностью S энергия системы уменьшится на величину ΔGv и увеличится на величину Es. Поэтому изменение суммарной энергии Гиббса будет равно
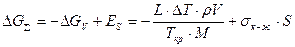 ,
,
где r и М—плотность твердого металла и его молярная масса. Анализ характера зависимости ΔGå от объема кристалла V показывает, что она имеет экстремальный характер. Характер зависимостиΔGå от радиуса зародыша показан на рис. 2.2.

Кис. 2.2. Зависимость ΔGå от радиуса зародыша r при разных температурах (T1>T2>Tкр>Т3>Т4)
В курсе металловедения получено следующее выражение для критического размера сферического зародыша, обеспечивающего максимум ΔGå (читателю предлагается вывести его самостоятельно) :
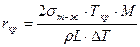 .
.
Из рис. 2.2 видно, что с понижением температуры, т. е. с увеличением переохлаждения, радиус критического зародыша становится меньше (rкр2 < rкр1). При этом уменьшается и энергия образования критического зародыша.
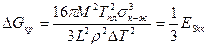 ,
,
где Esкр — поверхностная энергия зародыша критических размеров.
Пусть по каким-либо причинам в расплаве при данном переохлаждении возник зародыш радиуса r < rкр. Рост такого зародыша (увеличение r), как видно из рис. 2.2, сопровождается ростом ΔGå. Поэтому данный зародыш не способен к росту и будет расплавляться. Если радиус зародыша r ³ rкр, то при присоединении к нему даже одного атома, т. е. с ростом его размеров, ΔGå будет убывать. Поэтому данный зародыш сможет расти.
Центром кристаллизации будет называться зародыш, обязательно способный к росту. Критический зародыш (r = rкр) еще не является центром кристаллизации: он может потерять хотя бы одну частицу, т. е. стать дозародышем (r < rкр) и исчезнуть, или
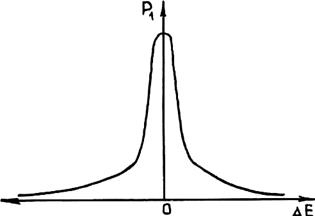
Рис. 2.3. Зависимость вероятности Р1 флуктуации энергии Е от величины флуктуационного отклонения ΔЕ
присоединить хотя бы одну частицу (r > rкр) и получить возможность для роста, т. е. стать центром кристаллизации. Поэтому вероятность образования центра кристаллизации равна произведению вероятностей образования зародыша критических размеров p1 и присоединения к нему частицы р2, т. е. p = p1× p2.
Вероятность образования центра кристаллизации равна отношению числа возникших в единицу времени в единице объема расплава центров кристаллизации п к общему числу частиц в расплаве N, т. е. p = n/N. Величина п, называемая скоростью возникновения центров кристаллизации (СВЦК), является важнейшей кристаллизационной характеристикой металлического расплава. Очевидно, n = p× N = p1× p2× N. Размерность [п] — м-3× c-1.
Для того чтобы определить вероятность p1, рассмотрим вопрос о причинах появления зародышей в условиях возрастания суммарной энергии Гиббса ΔGå. С точки зрения статистической физики характерные для равновесия значения термодинамических величин представляют собой лишь наиболее их вероятные при данных условиях значения. Практически отдельные микрообъемы жидкости в течение некоторых малых промежутков времени могут обладать значениями термодинамических величин, отличными от отвечающих данному равновесному состоянию. При этом большую часть времени система обладает равновесными термодинамическими характеристиками. Случайные отклонения какой-либо величины от ее равновесного значения называются флуктуациями. Вероятность обнаружения флуктуации зависит от ее величины. Чем больше флуктуация, т. е. отклонение от соответствующего равновесного значения, тем она менее вероятна и тем меньшее время система обладает соответствующим отличным от равновесного значением той или иной величины. Следует отметить, что кривая зависимости вероятности флуктуации от ее величины отличается острым максимумом в области нулевых флуктуаций (рис. 2.3). Поэтому с увеличением флуктуации вероятность ее появления резко снижается до нуля.
Благодаря наличию флуктуации энергии в расплаве будет находиться то или иное количество микрообъемов, обладающее избытком энергии, необходимым для совершения работы образования зародыша критических размеров ΔGкр. Вероятность такой энергетической флуктуации равна pl = nк/N = exp(—ΔGкр/kТ), где nк — число зародышей критического размера; N—общее число частиц в единице объема. Вероятность p1 и будет вероятностью возникновения зародыша критического размера в единице объема в единицу времени. Очевидно, что, чем больше ΔGкр, тем большая требуется энергетическая флуктуация и меньше вероятность р1. Так как с увеличением переохлаждения ΔT ΔGкр уменьшается, то с ростом ΔТ повышается р1. Вероятность присоединения к зародышу хотя бы одной частицы равна p2 = nsen× exp(—U/kT), где ns—число атомов в жидкости, находящихся в контакте с поверхностью зародыша; e = l/6 — вероятность скачка атомов в данном направлении; n — частота колебаний атомов в жидкости (n = 1013•c-l); U—энергия активации диффузии атомов в жидкости, определяющая подвижность атомов.
Таким образом, вероятность образования центра кристаллизации равна
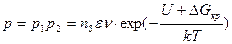 . (2.1)
. (2.1)
С учетом формулы (2.1) для вычисления скорости возникновения центров кристаллизации можно записать выражение
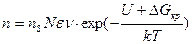 . (2.2)
. (2.2)
С увеличением переохлаждения ΔGкр уменьшается, а U возрастает (снижается подвижность атомов). Поэтому зависимость п от ΔТ носит экстремальный характер (рис. 2.4). Подобную кривую получил впервые в начале века Г. А. Тамман при кристаллизации органических прозрачных жидкостей. Для чистых гомогенных металлических расплавов зависимость п от ΔT показана на рис. 2.5. Видно, что при переохлаждениях, меньших величины ΔТ1, называемой интервалом метастабильности по зарождению, зарождение центров кристаллизации практически не происходит. Для металлов ниспадающая ветвь кривой (см. рис. 2.4) не реализуется, так как подвижность атомов в металлах очень велика.
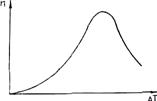
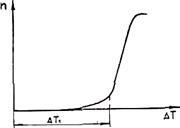
Рис. 2.4. Зависимость СВЦК " от переохлаждения ΔТ Рис. 2.5. Зависимость СВЦК от переохлаждения
для очистки гомогенных металлических расплавов
Для чистых гомогенных металлических расплавов величина интервала метастабильности очень велика. Расчеты показывают, что ΔT1 » 0,2Ткр. Реально подобная переохлаждаемость расплавов не наблюдается, так как в расплаве всегда находится достаточное количество примесей, инициирующих зародышеобразование.
Обычно самопроизвольную гомогенную кристаллизацию изучают на мельчайших каплях чистого металла. При этом считается, что при измельчении металла вероятность нахождения примеси в капле уменьшается. Зависимость n от ΔT для металлов можно аппроксимировать следующей степенной зависимостью: n = n0(ΔT — ΔT1)s, где показатель степени s находится в интервале от 1 до 3.
Выше речь шла о самопроизвольном зарождении кристаллов при затвердевании однокомпонентных расплавов (чистых металлов). Большинство литейных расплавов являются сплавами, т. е. высокотемпературными жидкими растворами. При этом продуктами кристаллизации чаще всего являются твердые растворы. При охлаждении до температуры ликвидуса жидкий сплав оказывается насыщенным по отношению к легирующему компоненту. Поэтому при дальнейшем снижении температуры наступает пересыщение и из расплава должны выделяться твердые кристаллы.
Свойства, не зависящие от количества вещества, называются интенсивными. К ним относятся температура и давление. Применительно к растворам Г. Н. Льюис ввел еще одну интенсивную величину, называемую парциально-молярной величиной компонента. Она представляет собой частную производную от какого-либо экстенсивного свойства W по числу молей этого компонента при постоянных давлении, температуре и числе молей остальных компонентов в растворе, т. е. qi = (дW/дni}p,T,n j¹i Например, парциально-молярная энергия Гиббса для (i-го компонента равна Gi = (дG/дпi)р,T, j¹i. Легко понять, что парциально-молярные свойства чистых веществ совпадают со значением этих свойств одного моля
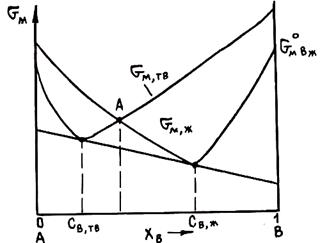
Рис. 2.6. Схема графического определения состава фаз, находящихся в равновесии при заданной температуре
вещества для заданных условий (G0A и G0B). Действительно, для вещества A G = nG0A и дG/дп = G0A. Величина дG/дпi называется химическим потенциалом mi, т. е. mI = (дG/дпi)P,T, j¹i Химический потенциал характеризует тенденцию вещества покинуть данную фазу и перейти в другую. Физически химический потенциал равен работе, которую нужно совершить, присоединяя к раствору одну частицу данного компонента. Интенсивные величины Т, Р и mI характеризуют условия термического, механического и химического равновесия. Для равновесия необходимо, чтобы во всех фазах были одинаковые температуры, давления и химические потенциалы компонентов.
Приравняв величины mI для каждого компонента во всех фазах, получим систему уравнений, которая совместно с уравнениями материального баланса позволяет найти составы находящихся в равновесии фаз. Для двойных сплавов этот подход хорошо реализуется графически. На рис. 2.6 показан пример графического метода определения состава твердого раствора и находящейся с ним в равновесии при некоторой температуре Т жидкой фазы. При равновесии должны выполняться условия mтвА = mжА и mтвВ = mжВ, а если mВ = дG/дпв, то составы фаз должны обеспечивать выполнение равенства
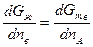 или
или 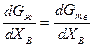
Геометрически это означает, что составы определяются общей касательной к кривым зависимости энергий Гиббса твердой и жидкой фаз при данной температуре. Эти равновесные составы GтвВ и GжВ показаны на рис. 2.6. Иногда считают, что искомые составы отвечают точкам пересечения кривых мольных энергий фаз, например точке А, т. е. точкам, где равны энергии фаз. Однако равновесные фазы обеспечивают минимум суммарной энергии обеих фаз, а он достигается только при mжА = mтвА и mжВ = mтвВ.
Таким образом, при достижении пересыщения из раствора могут выделяться твердые растворы, концентрации которых отличаются от исходной. При этом для начала процесса кристаллизации необходимо пересыщение раствора, достигаемое его переохлаждением относительно температуры ликвидуса.
Движущая сила, создающая условия для выделения твердой фазы в сплавах, определяется так же, как и для металлов, по изменению энергии Гиббса системы.
При кристаллизации сплавов вместо справедливого для однокомпонентного металла выражения ΔGм = L×ΔT'/Tпл следует применять выражение ΔGж-a С учетом этого для критического размера зародыша получим выражение rкр = 2sМ/(r×ΔGмж-а). Работа образования критического сферического зародыша равна 16pМ2s3/[Зr2(ΔGж-а)2].
Следует отметить, что зарождение центров кристаллизации сплавов, как показали исследования, качественно описывается той же зависимостью от переохлаждения, что и у металлов. При этом переохлаждение отсчитывается от температуры ликвидуса. Величину ΔGмж-a можно также вычислить по формуле LΔT/Тл, где L — теплота кристаллизации, выделившаяся при кристаллизации единицы массы сплава при данной температуре.
Для образования зародышей твердых растворов необходимы не только рассмотренные выше энергетические флуктуации, но и флуктуации концентрации. Концентрационные флуктуации представляют собой участки растворов, состав которых отличается от среднего. Например, в жидком чугуне при средней концентрации углерода 3,4 % обнаруживаются участки размером 10-8 см, состоящие из одного углерода. По-видимому, именно эти участки являются основой возникновения зародышей графита при кристаллизации чугуна.
Рассмотренный выше процесс кристаллизации сплавов называется диффузионным, так как при кристаллизации в этих случаях происходит перераспределение компонентов между фазами путем диффузии.
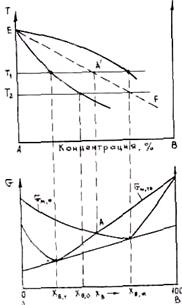
Рис. 2.7. Схема бездиффузионной кристаллизации
Возможен бездиффузионный процесс кристаллизации сплавов, когда состав выделяющейся твердой фазы строго совпадает с составом исходного жидкого сплава. На рис. 2.7 представлена диаграмма состояния и зависимость G от состава для жидкого сплава и сплава в твердом состоянии. Зависимость G приведена при T = T1. Точка A` отвечает равенству мольных энергий Гиббса твердой и жидкой фаз. На диаграмме состояния ей соответствует точка А`. Если аналогичные точки перенести на диаграмму при других температурах, то получим линию EF, отвечающую равенству Gт = Gж. Если сплав резко переохладить ниже этой линии (например до T = T2), то Gт станет меньше Gж и произойдет бездиффузионная кристаллизация с выделением твердой фазы концентрации С0. Анализ показывает, что для этого нужны очень большие переохлаждения (порядка нескольких десятков и даже сотен .градусов) В обычной литейной практике они не достигаются, так как требуют очень больших скоростей охлаждения при малых объемах сплава.
ГЛАВА 2.2. ТЕОРИЯ ГЕТЕРОГЕННОГО ЗАРОДЫШЕОБРАЗОВАНИЯ
Большинство металлов затвердевает при значительно меньшем переохлаждении, чем максимальное переохлаждение ΔTmах = 0,2Tкр предсказываемое теорией гомогенного образования зародышей. Это обусловлено наличием в расплаве инородных твердых частиц которые облегчают возникновение зародышей, Рассмотрим простейший случай образования зародыша на плоской поверхности включения.
Пусть зародыш ограничен частью сферической поверхности радиуса R (рис. 2.8). Изменение полной мольной энергии сплава при образовании зародыша в данном случае имеет вид
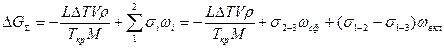 ,
,
где s2-3 и s1-2 — межфазные энергии на границах сплав — зародыш и зародыш — включение; wсф и wвкл — площади поверхностей зародыша на границе со сплавом и на границе с включением; s1-3 — межфазная энергия на границе между включением и сплавом. Выполнив геометрические преобразования (предлагаем читателю выполнить их самостоятельно), получаем следующие формулы для вычисления V, wсф и wвкл:
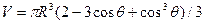 ;
;
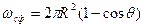 ;
; 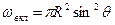 .
.
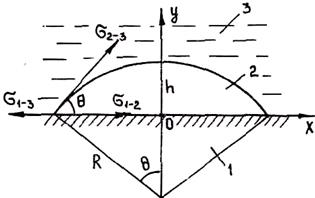
Рис. 2.8. Схема зарождения кристалла на плоской поверхности включения:
/ — включение; 2 — зародыш; 3 — сплав
Подставив эти выражения в формулу для ΔGå и выполнив исследования на максимум, получаем следующие выражения для вычисления энергии образования критического зародыша на включении и соответствующего ему размера Rкр:
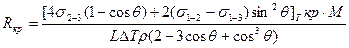 ;
;
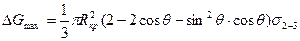 .
.
Предлагаем читателю получить эти формулы самостоятельно.
При полном несмачивании включения сплавом (q = p) имеем сферический зародыш. При этом ΔGmах = 4p(R*)2/3s2-3. При полном смачивании (q = 0) ΔGmах = 0. Сравним работу образования зародыша на включении при 0 < q < 180° с работой гомогенного образования сферического зародыша:
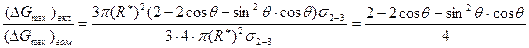 <1 при 0 < q < p.
<1 при 0 < q < p.
Таким образом, работа образования критического зародыша на включении меньше, чем в гомогенном расплаве. СВЦК при этом вычисляется по ранее приведенным формулам, если вместо ΔGmах в них подставлять полученное выше выражение для расчета максимального изменения энергии Гиббса при образовании зародыша на включении. Так как ΔGmах при этом меньше, чем при гомогенном зарождении, то СВЦК при наличии включений увеличивается. Очевидно, что ΔGmах становится меньше с уменьшением q, т. е. с усилением смачиваемости включения сплавом. Поэтому СВЦК увеличивается с уменьшением q.
Следует отметить, что не любые твердые включения резко увеличивают СВЦК. Из приведенных выражений видно, что это произойдет, если малы значения q и s2-3. Очевидно, что s2-3 будет тем меньше, чем ближе кристаллическая структура включения к кристаллической структуре зародыша. По правилу ориентационно-размерного соответствия, предложенного П. Д. Данковым и С. Т. Конобеевским, необходимо, чтобы включения имели один тип кристаллической решетки со сплавом. При этом параметры решеток не должны сильно отличаться. Такие включения называют изоморфными. Указанное правило было обосновано П.Д. Данковым следующим образом. На подкладке может образоваться ориентированный относительно ее решетки зародыш (он является как бы продолжением решетки включения) или произвольно ориентированный зародыш (как при гомогенной кристаллизации). Если параметры решеток различаются, то решетка зародыша, взаимодействуя с атомами решетки включения, упруго деформируется (расширяется или сжимается со сдвигом).
Если работа деформации меньше энергии образования трехмерного неориентированного зародыша, то зародышеобразования на включении не произойдет. Выполнив соответствующие расчеты для хлористого натрия, П. Д. Данков нашел, что ориентированное зарождение прекращается при различии в параметрах решеток соли и включения, равном 9 %. Практическая проверка формулы Данкова показала, что она дает завышение предельно допустимого отклонения параметров решеток. Практически при кристаллизации соли хлористого натрия на галените ориентированное зарождение прекращалось при Δа/а = 5,7 %. В качестве примеров ориентированного зарождения центров кристаллизации металлических расплавов можно привести рост медных кристаллов (а = 3,6Å) на никелевых включениях (а = 3,52Å), кристаллов a-латуни (а = 3,68Å) на серебре (а = 4,08Å). Измельчение кристаллического зерна в отливках вследствие увеличения СВЦК путем введения в расплав изоморфных
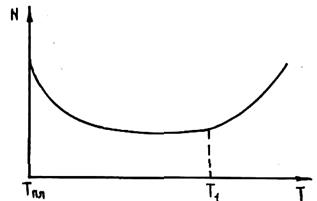
Рис. 2.9. Зависимость числа кристаллических зерен на единице площади шлифа от перегрева металла
примесей широко применяется на практике и называется модифицированием первого рода. Например, при введении в жидкий алюминий титана или циркония образуются тугоплавкие интерметаллические соединения TiAl3 и ZrА13, имеющие изоморфную с алюминием кристаллическую решетку. Достаточно ввести в сплав десятые доли процента титана или циркония, как размер кристаллического зерна уменьшается в десятки и сотни раз.
Затравочное действие твердых включений зависит от термовременной обработки расплава. На рис. 2.9 приведена зависимость числа кристаллических зерен N на единицу площади шлифа от температуры обработки жидкого сплава. Видно, что с ростом температуры перегрева сплава N уменьшается. Начиная с некоторой, хотя и очень высокой, температуры, ниспадающая кривая переходит в восходящую. Увеличение СВЦК при высоких перегревах объясняется тем, что при этом дезактивированы все включения и сплав кристаллизуется по гомогенному механизму в условиях очень больших переохлаждении.
Очевидно, что если в расплаве содержится большое число истинно изоморфных примесей, то их дезактивация при перегреве не происходит.
При увеличении перегрева сплава кроме отмеченных выше явлений может происходить растворение включений в расплаве или, наоборот, выделение их из расплава. В зависимости от характера выделяющихся или растворяющихся включений изменяется кристаллическая структура сплава. Например, при перегреве магниевых сплавов, легированных алюминием, марганцем и железом, при некоторой температуре происходит растворение алюминиево-железистых соединений в расплаве. При охлаждении сплава в процессе кристаллизации эти соединения выделяются из расплава в виде компактных изоморфных частиц, что увеличивает СВЦК и измельчает структуру. Этот прием широко применяется в практике магниевого литья и носит название модифицирования перегревом. При перегреве чугуна происходит полное растворение углерода, что по аналогичным перегреву магниевых сплавов причинам приводит к резкому увеличению дисперсности выделяющихся при кристаллизации чугуна включений графита.
В заключение отметим, что при кристаллизации на примесях сохраняется характер изменения СВЦК с уменьшением переохлаждения. Однако при этом резко сокращается интервал метастабильности и повышается количественный уровень СВЦК. Это объясняется не только непосредственным влиянием переохлаждения на работу образования и размер критического зародыша, но и увеличением числа неизоморфных включений, удовлетворяющих сформулированному выше условию ориентированного роста.
Действительно, по данным Д. Тернбала и Б. Воннегута, энергия упругого деформирования кристалла на подкладке может
быть оценена по формуле ΔG = (авкл + aм)2/a2м, а движущая процесс разность энергий Гиббса при увеличении переохлаждения возрастает. Поэтому при увеличении переохлаждения все большее число включений удовлетворяет условию ориентированного зарождения.
ГЛАВА 2.3. МЕХАНИЗМ И КИНЕТИКА РОСТА КРИСТАЛЛИЧЕСКИХ ЗАРОДЫШЕЙ
Образовавшиеся центры кристаллизации самопроизвольно увеличивают свои размеры. Кристалл растет путем присоединения к нему атомов из окружающего расплава. Способ присоединения атомов к поверхности растущего зародыша определяется строением поверхности раздела фаз, распределением и количеством дефектов на этой поверхности. В соответствии с современной теорией кристаллизации механизм роста кристаллов определяется состоянием поверхности их граней. В зависимости от этого фактора можно выделить следующие механизмы роста кристаллов.
1. Рост кристаллов на атомно-гладких поверхностях кристалла. В этом случае все атомы поверхности раздела кристалл — расплав расположены на одной плоскости, на которой нет образований адсорбированных атомов типа уступов, ступеней и т. п. Образование уступов, ступеней, выступов из групп атомов называется процессом огранки поверхности, которая при этом называется ограненной.
Дата добавления: 2014-12-09; просмотров: 1728;
