Раздел 1. СТРОЕНИЕ И СВОЙСТВА ЖИДКИХ МЕТАЛЛОВ И СПЛАВОВ 4 страница
Изменение деформации в координатах деформация g — время t показано на рис. 1.33. Видно, что тело Гука обладает только мгновенно развиваемой обратимой, т. е. исчезающей после снятия напряжения, деформацией, равной gH = ts. Сравнивая приведенные кривые для сплава, можно заключить, что при t < tS нет остаточной деформации, а при t > tS появляется остаточная деформация. Поэтому можно сделать вывод, что искомое тело содержит тело Бингама. Кривые изменения деформации тела Бингама при нагрузке и разгрузке для t < ts и для t > ts приведены на рис. 1.33. Видно, что от экспериментальной кривой их отличает линейный характер зависимости. С целью придания зависимости нелинейного характера в тело нужно включить так называемое тело Кельвина, представляющее собой параллельно соединенные тела Гука и Ньютона (рис. 1.34).
Приложенное к телу напряжение вычисляется по формуле t = tH + tN, где tH—напряжение тела Гука, а tN—напряжение тела Ньютона. Деформации параллельно соединенных тел равны gH = gN = g, gH = t/s, g = t/h и t = gg + hg. Приняв t = const и преобразовав уравнение, получаем дифференциальное уравнение с разделяющимися переменными. Решаем его при начальном условии t = 0, g = 0.
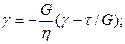
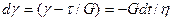 ;
;
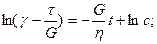
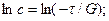
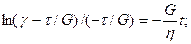
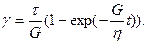
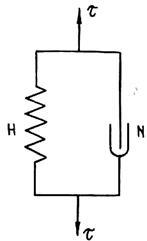
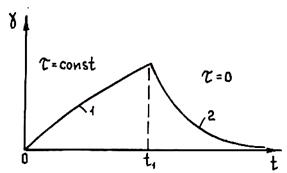
Рис. 1.34. Схема тела Кельвина (K-тела) Рис. 1.35. Поведение .К-тела при t-const (/) и при разгрузке (2)
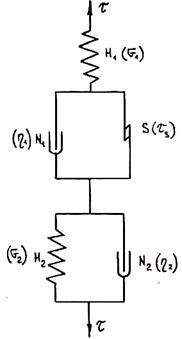
Рис. 1.36. Реологическая модель сплава
Аналогично можно получить формулу для изменения деформации при разгрузке (рис. 1.35). Видно, что в отличие от тела Гука в К-теле упругая деформация развивается не мгновенно. Легко убедиться, что экспериментальная форма кривой получится, если сложить кривые тел Гука, Бингама и Кельвина. Деформации складываются при последовательном соединении тел. Таким образом, модель сплава имеет вид, показанный на рис. 1.36. Эта модель впервые была получена Г. Ф. Баландиным и Л. П. Каширцевым. Она описывает поведение сплава во всем интервале температур. При этом основные реологические характеристики сплава (модуль сдвига G1, модуль упругого последействия G2, пластическая вязкость h1, псевдовязкость Кельвина h2 и предельное напряжение сдвига tS) зависят от температуры. Характер некоторых из них приведен на рис. 1.31. Таким образом, деформация сплава складывается из гуковской упругой деформации g1, деформации упругого последействия g2 и пластической деформации g3, т. е. g = g1 + g2 + g Для вычисления слагаемых можно написать следующие формулы:
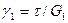 ;
; 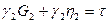 ;
;
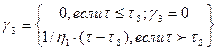
Относительный вклад указанных деформаций в общую деформацию сплава зависит от температуры. В дальнейшем мы рассмотрим более подробно влияние реологической природы сплава на трещиноустойчивость сплавов в отливках.
ГЛАВА 1.3. ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ В МЕТАЛЛАХ И СПЛАВАХ
В различных технологических процессах плавки сплавов и получения отливок имеют место явления, происходящие на границах раздела жидких сплавов со шлаками, с газовой фазой и вакуумом, поверхностями песчаных и металлических форм, рафинировочными и защитными флюсами, газовыми включениями и т. п. Поверхностные явления оказывают большое воздействие на качество выплавляемых сплавов, процесс кристаллизации и формирование кристаллической структуры, химическую неоднородность отливок, заполняемость форм, особенно для тонкостенных отливок, качество поверхности отливок и другие стороны литейного процесса. В основе этого влияния лежит факт, что состояние атомов в поверхностных слоях жидких сплавов существенно отличается от состояния атомов в объеме жидкости.
1.3.1. ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ ЖИДКИХ МЕТАЛЛОВ
Частицы, находящиеся во внутренних слоях жидкости, окружены другими частицами и поэтому испытывают симметричные воздействия со всех сторон, которые компенсируют друг друга. В поверхностных слоях частицы испытывают нескомпенсированные силовые воздействия притяжения со стороны ближайших «соседей», находящихся внутри жидкости.
Каждая частица, расположенная на поверхности жидкости, испытывает притяжение со стороны соседних внутренних частиц, направленное внутрь жидкости перпендикулярно ее поверхности. В связи с этим, для того чтобы перевести частицу из объема на поверхность, нужно совершить работу против сил притяжения. В результате энергия Гиббса поверхностных частиц больше, чем объемных, на величину указанной работы. Эта избыточная энергия Гиббса, отнесенная к единице поверхности жидкости на границе с насыщенным паром или инертным газом, называется удельной свободной энергией (Дж/м2) или поверхностным натяжением s. При изотермическом процессе работа по увеличению поверхности на dS равна dА = —sdS (знак «—» показывает, что работа при этом совершается не системой, а внешними силами над ней). Так как увеличение поверхности связано с возрастанием свободной энергии, то оно не может происходить самопроизвольно. С другой стороны, уменьшение поверхности снижает свободную энергию и может протекать самопроизвольно. Поэтому жидкость стремится принять конфигурацию с минимальной в данных условиях поверхностью.
Силы поверхностного натяжения F направлены по нормали к любому элементу dl периметра поверхности жидкости и являются касательными к ней. Численно поверхностное натяжение равно s = dF/dl. Его величину можно оценить по работе, затрачиваемой против сил межчастичного взаимодействия при обратимом изотермическом разрыве столба жидкости сечением в единицу площади, называемой когезией WK. Очевидно, что в этом случае вместо одной фазы образуются две со своими поверхностями. Значит, WK = 2s. Для большинства металлов характерно уменьшение поверхностного натяжения с увеличением молярного объема. Металлы отличаются большим по сравнению с неметаллическими жидкостями поверхностным натяжением. Так, поверхностное натяжение калия — 102 мДж/м2, цинка — 760, алюминия — 860, меди — 1350, магния — 560 и железа — 1860 мДж/м2. Для сравнения у воды s = 75,5 мДж/м2. Характерно увеличениеsс ростом температуры плавления металла. Обобщенно зависимость а от мольного объема и температуры плавления описывается формулой Шитила s = КТпл/Vж2/3 . Более точно ее можно вычислить по формуле s = 3,7×Тпл/Vж2/3 + 140. Например, для железа s = 3,7×1 801×7,1/55,85 + 140 = 1 820 мДж/м2 (здесь Тпл имеет размерность К).
Большую величину поверхностного натяжения у металлов объясняют наличием в них свободных электронов. Значительную часть избыточной поверхностной энергии металлов составляет электростатическая энергия двойного электрического слоя, возникающего за счет выхода электронного газа за пределы металла.
С увеличением температуры поверхностное натяжение металлов убывает, стремясь к нулю при температуре абсолютного кипения. Коэффициент температурной зависимости s невелик и составляет 0,07 мДж/(м2К) для калия, 0,65 — для цинка, 0,35 — для железа и 0,15 — для алюминия.
1.3.2. ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ СПЛАВОВ
Сплавы представляют собой высокотемпературные растворы. В растворах силы взаимодействия между различными частицами неодинаковы, атомы и молекулы с более слабыми силовыми полями вытесняются в поверхностный слой, так как это соответствует минимуму свободной энергии. Если добавляемый компонент понижает поверхностное натяжение растворителя, то он вытесняется в поверхностный слой, так как при этом уменьшается избыточная свободная энергия поверхностного слоя. Концентрация такого компонента на поверхности будет больше, чем в объеме. Этому будет препятствовать диффузия, стремящаяся выравнять концентрации. В результате устанавливаются некоторые равновесные значения концентраций на поверхности и в объеме.
Превышение поверхностной концентрации над объемной выражает уравнение Гиббса Г = -с/RT×(ds/dc)Т. Видно, что; если ds/dc < 0 (поверхностное натяжение при увеличении концентрации компонента уменьшается), то Г > 0, т. е. концентрация в поверхностном слое больше, чем в объеме. Такие вещества называются поверхностно-активными. В противном случае (поверхностное натяжение при увеличении концентрации компонента увеличивается, дs/дс > 0) компонент вытесняется с поверхности в объем. Такие вещества называются поверхностно-инактивными йо многих случаях поверхностная активность связана с различи^ ем атомных объемов растворителя и растворенного компонента ьсли атомные объемы сильно различаются, то растворенное вещество является поверхностно-активным. В случае, если атомные объемы компонентов близки, растворенное вещество является по-верхностно-инактивным.
Поверхностная активность играет большую роль в процессах кристаллизации. Кроме того, управление поверхностным натяжением растворов в формовочных смесях позволяет воздействовать на такое их важное свойство, как текучесть.
Теория поверхностного натяжения растворов очень сложна и ее изложение выходит за рамки курса. Поэтому в заключение приведем фактические данные о влиянии легирующих компонентов на поверхностное натяжение сплавов на основе железа, алюминия и магния. Углерод, кремний, марганец, хром, фосфор, сера кислород, азот снижают поверхностное натяжение железа. При этом их поверхностная активность убывает в направлении S > O > Р > Mn > Si > C. Поверхностно-активными в железоуглеродистых сплавах являются следующие элементы, часто используемые как модификаторы, измельчающие зерно и управляющие его морфологией: цезий, кальций, натрий, цирконий, бор, алюминий. В чистых по сере сплавах магний является поверхностно-активным веществом. Однако если в сплаве есть кислород и сера, то магнии, раскисляя сплав (FeO + Mg = MgO + Fe) и переводя серу из раствора в сульфид магния (S + Mg = MgS), увеличивает s, так как кислород и сера — сильные поверхностно-активные примеси. Если магния в сплаве больше, чем нужно для раскисления и десульфурации, то избыточный магний растворяется в сплаве и понижает его поверхностное натяжение как поверхностно-активное вещество. В качестве поверхностно-инактивных веществ можно привести титан, ванадий и молибден.
В алюминиевых сплавах поверхностно-активными добавками являются кремний, цинк, магний, натрий, литий. Введение даже сотых долей процента этих элементов приводит к сильному понижению s. Так, например, введение 0,1 % натрия снижает поверхностное натяжение с 849 до 619 мДж/м2.
В магниевых сплавах поверхностно-активными являются висмут, свинец, сурьма, а поверхностно-инактивными — марганец, цинк, никель, германий.
1.3.3. КАПИЛЛЯРНЫЕ ЯВЛЕНИЯ. СМАЧИВАЕМОСТЬ
Форма, которую принимает свободная поверхность жидкости, зависит от сил поверхностного натяжения, от взаимодействия с ограничивающими поверхностями, а также от действующей на жидкость силы земного тяготения. Наблюдающиеся в этих случаях явления получили название капиллярных. Они обусловлены тем, что благодаря действию сил поверхностного натяжения давление внутри жидкости может отличаться от внешнего давления пара или газа на некоторую величину Рк.
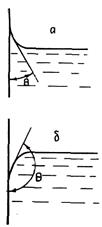
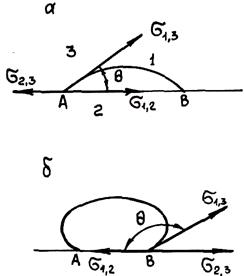
Рис. 1.37. Форма поверхности жидкости у Рис. 1.38. Форма капли жидкости на горизонтальной
вертикальной стенки при смачивании (а) поверхности при смачивании (а) и при несмачивании (б)
и при несмачивании (б)
Из физики известно, что Pк = s (1/R1 + 1/R2), где R1 и R2— главные радиусы поверхности. Если поверхность сферическая, то R1 = R2 = R и Рк = 2s/R. Необходимо также учесть, что R > 0, когда поверхность выпуклая и R < 0, когда она вогнутая. Если молекула жидкости находится на границе с твердой стенкой сосуда, то она взаимодействует со своими ближайшими соседями как в жидкости, так и в стенке. Если молекула сильнее взаимодействует с молекулами твердой стенки, чем с молекулами той же жидкости, то молекулы будут самопроизвольно переходить из объема на поверхность. При этом поверхность жидкости увеличится, жидкость растечется по стенке, образуя каплю. На горизонтальной поверхности жидкость растечется, на вертикальной поверхности молекулы будут «вползать» на стенку, образуя вогнутый мениск. Так как при этом будет затрачиваться энергия на увеличение поверхности, то при некотором угле q, называемом краевым углом, наступит равновесие. Угол q зависит от соотношения сил взаимодействия молекул жидкости с молекулами стенки и между собой. При смачивании 0 £ q £ p/2 (рис. 1.37, а). При q = 0 имеем полное смачивание.
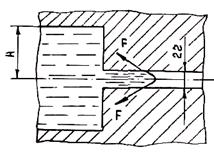
Рис. 1.39. Схема движения сплава в капилляре формы
Если силы взаимодействия между молекулами жидкости больше, чем между жидкостью и твердым телом, то частицы будут переходить с поверхности в объем. Поверхность будет сокращаться, и картина контакта жидкости с вертикальной поверхностью будет иметь вид, показанный на рис. 1.37, б. При этом будем иметь дело с несмачиванием. Краевой угол при несмачивании p/2 £ q £ p.
Следует отметить, что одно и то же тело может смачиваться одними жидкостями и не смачиваться другими. Например, стекло смачивается водой и не смачивается ртутью.
До сих пор мы рассматривали явления на границе двух тел — жидкости и твердого тела. Практически же мы всегда имеем взаимодействие трех тел: жидкости, твердого тела и газа. На рис. 1.38 приведены схемы капель, лежащих на твердой подкладке в газовой атмосфере. Кривая контакта этих трех тел в простейшем случае — окружность, обозначенная точками A и В. Приложим к точке А по касательным к поверхностям раздела соответствующих фаз силы поверхностного натяжения: s12 — между жидкостью и подложкой, s13 — между жидкостью и газом, s23 — между газом и подложкой. Нетрудно видеть, что условие равновесия имеет вид s23 = s12 + s13 × cosq, отсюда cosq = (s23 — s12)/ s13.
С учетом смачивания и несмачивания рассмотренные выше явления могут приводить к поднятию или опусканию жидкости в капиллярах. Для иллюстрации рассмотрим капилляр в песчаной форме, для простоты считая его цилиндрическим. Обычно неокисленный металл не смачивает форму, т. е. образует в капилляре выпуклый мениск. На рис. 1.3.9 показан капилляр на расстоянии H от уровня металла в форме. При этом со стороны сплава в направлении капилляра действует давление Pг = rgH. Капиллярное давление Рк = 2s×соs q/r в случае несмачивания действует в противоположном направлении, т. е. препятствует проникновению металла в поры формы. Если металл окислен, то в зависимости от материала формы он может ее смачивать. При этом капиллярное давление направлено в ту же сторону, что и гидростатическое. Металл будет проникать в поры формы. Это приведет к пригару — образованию прочно сцепленного с поверхностью отливки пригарного слоя.
Для железоуглеродистых сплавов углы q имеют следующие значения: с кварцевым песком — 103°, с магнезитом — 113—126°, с хромомагнезитом — 102—112°, с хромистым железняком — 81—88°, с окисью алюминия — 141°. Видно, что в нейтральной атмосфере железоуглеродистые сплавы не смачивают основные формовочные материалы. Исключение составляет хромистый железняк. Повышение содержания кислорода в железе резко увеличивает смачивание. При увеличении содержания кислорода с 0,031 до 0,192% краевой угол q падает со 105,5 до 52°. Добавка к сплаву поверхностно-активных веществ (например серы к сталям и чугунам) вызывает уменьшение не только поверхностного натяжения, но и краевого угла. При этом эффект уменьшения q превышает эффект снижения s так, что капиллярное проникновение увеличивается.
Пористость формовочных смесей после уплотнения в форме составляет 15—45 %. При этом большая часть пор может быть отнесена к капиллярам. Капилляры в форме образуют сложную разветвленную пространственную систему неправильной геометрической формы. Поэтому строгое описание капиллярного движения сплава наталкивается на большие трудности. Из рассмотренной выше схемы следует, что в случае смачивания сплавом формы проникновение будет происходить при любой величине гидростатического давления, при этом тем интенсивней, чем больше эффективный диаметр капилляра 2rЭ. Под эффективным диаметром капилляра будем понимать диаметр такого цилиндрического канала, у которого высота капиллярного подъема сплава в данных условиях такая же, как в реальной форме. В случае несмачивания проникновение начнется только при Рг > Рк. Отсюда видно, что с ростом rэ давление проникновения Ргп уменьшается.
Рассмотрим изотермическое проникновение сплава в капилляр в случае смачивания под действием только капиллярного давления.
Как известно из гидравлики, скорость капиллярного поднятия может быть описана формулой
vср = dl/dt = Pкr2/(8hl),
где Рк = 2s cos q /r; r — радиус капилляра.
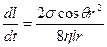 или
или 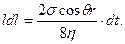
Интегрируя это уравнение при начальном условии t = 0, I = 0, находим формулу для вычисления зависимости глубины проникновения сплава в форму от времени под действием капиллярного давления:
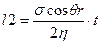 или
или 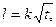
где k = 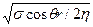 .
.
Из формулы видно, что глубина изотермического проникновения сплава пропорциональна V~ t. Величина k для окисленной стали имеет порядок 0,1—0,3 мм2/с. В реальных условиях проникновение сплава неизотермическое. Установлено, что длина пропитанного слоя фактически определяется не гидравлическими условиями, а условиями прогрева слоя формовочных материалов. Для течения необходимо, чтобы смесь перед головой капиллярного потока успевала прогреться до температуры ликвидуса сплава. Следует, однако, отметить, что в реальной форме чисто капиллярной пропитки не происходит, так как гидростатическое давление сплава в форме даже для ее верхних участков имеет тот же порядок, что и капиллярное давление.
1.3.4. СИЛЫ АДГЕЗИИ И КОГЕЗИИ
Рассмотрим контакт двух фаз (жидкой и твердой или двух твердых). Поверхностные натяжения фаз обозначим s1 и s2, а межфазную энергию фаз на границе их раздела — s12. Работу их изотермического обратимого разделения можно вычислить по формуле WA = s1 + s2 - s12. Эта работа называется адгезией. Поверхностное натяжение твердых фаз определить трудно. Поэтому используем данные о смачивании этих поверхностей жидкостями. Рассматривая адгезию жидкой 1 и твердой 2 фаз, найдем экспериментально краевой угол смачивания твердой фазы данной жидкостью. Он равен cos q = (s2 — s12)/s1. Поэтому wa = s1(1 + cos q). Адгезия является характеристикой прочности сцепления фаз. Она тем больше, чем выше поверхностное натяжение контактирующих фаз и меньше их межфазное натяжение. Из полученного выше выражения следует, что, чем выше (s1 и чем лучше жидкость смачивает твердое тело, тем прочнее их сцепление. Адгезия чистого жидкого железа к магнезии — 360 мДж/м2. С увеличением окисленности железа (q уменьшается) адгезия резко возрастает (до 1235 мДж/м2). Величина адгезии определяет энергетические затраты на удаление приставшего к отливке пригарного слоя.
Как было сказано выше, работа по разрыву фазы с образованием двух новых поверхностей раздела, равная 2s, называется когезией. Соотношение между адгезией воды, содержащейся в смеси, к поверхности модели или стержневого ящика и когезией смеси определяет прилипаемость смеси к модельной оснастке. Если смесь прилипает к поверхностям модели или ящика, то качественную форму или стержень приготовить невозможно. Для исключения прилипания необходимо, чтобы когезия превышала адгезию. Основные меры борьбы с прилипаемостью рассматриваются в курсе «Технология литейного производства».
1.3.5. РОЛЬ ПОВЕРХНОСТНЫХ ЯВЛЕНИЙ В ПРИГАРООБРАЗОВАНИИ НА ОТЛИВКАХ
Процесс затвердевания отливки в литейной форме связан с формированием ее поверхности, контактирующей с поверхностью формы. Как было сказано выше, форма представляет собой капиллярно-пористое тело, имеющее сложные по конфигурации капилляры, более или менее открытые для проникновения в них жидкого металла из полости формы. При этом на проникающий в капилляры жидкий металл действуют следующие силы:
а) гидростатическое давление столба жидкого металла в форме Рг;
б) капиллярное давление, приложенное к свободной поверхности жидкого сплава в капилляре, Рк;
в) избыточное давление газов в порах смеси, образующееся при окислении, испарении и деструкции ее составляющих в процессе прогрева формы при заливке и охлаждении сплава, Ргф.
Схема приложения сил к расплаву в капилляре при смачивании формы металлом показана на рис. 1.40. Очевидно, что для проникновения сплава в форму необходимо выполнение неравенства Рг + Рк > Ргф. При этом следует иметь в виду, что в целях борьбы с газовыми дефектами в отливках состав смеси подбирают так, чтобы она была наименее газотворна, т. е. добиваются мннимального уровня давления Ргф. Таким образом, смачивание жидким сплавом формы, как правило, ведет к его проникновению в межзеренные капилляры смеси. В случаях несмачивания сплавом формы Рг > Рк + Ргф. Условия, исключающие его проникновение, выполнить проще, но также не всегда возможно.
Если указанные условия проникновения выполнены, то при изотермическом процессе расплав в капилляре под действием перепада давлений будет двигаться как угодно долго. При этом длина заполненного капилляра будет увеличиваться, как было показано выше, пропорционально V~ t.
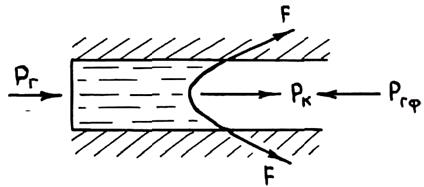
Рис. 1.40.Распределение давлений при смачивании сплавом формы
В условиях реальной песчаной формы проникновение сплава в капилляры происходит в неизотермических условиях. В песчаной форме после заливки сплава температура распределена неравномерно, по мере удаления от границы с отливкой она быстро убывает. Поэтому голова потока расплава в капилляре все время набегает на холодные, непрогретые поверхности зерен песка, что приводит к затвердеванию прожилок расплава и прекращению его проникновения. Обычно глубина проникновения расплава ограничивается одним или несколькими слоями зерен смеси. Однако в некоторых случаях, особенно в тонких центральных, со всех сторон омываемых сплавом стержнях, металл может заполнить капилляры на всю толщину стержня. В этих случаях происходит, как говорят, сквозная металлизация стержня. Такой стержень практически невозможно выбить из отливки.
В результате поверхностного проникновения металла в поры смеси на поверхности отливки образуется и удерживается после выбивки более или менее толстый слой пропитанной металлом формовочной смеси, иногда очень трудноудалимый. Этот поверхностный дефект отливок называют пригаром. Пригар, образуемый по описанному механизму, называется механическим пригаром.
Однако на практике чисто механический пригар образуется редко. В условиях окислительной атмосферы формы поверхность металла часто покрыта пленками окислов. Например, при литье железоуглеродистых сплавов важную роль играют окислы железа и марганца FeO и МпО. С кремнеземом песка эти окислы вступают во взаимодействие с образованием легкоплавких соединений типа файялита (2FeO×SiO2), родонита (MnO×SiO2), тефроита (2MnO×Si02) и др. С возникновением окисных или силикатных легкоплавких фаз проникновение сплава в поры смеси существенно облегчается. Окислы хорошо смачивают смесь и сами хорошо смачиваются металлом. Расплав идет за ними в капилляр как нитка за иголкой. Следует заметить, что окисные расплавы легко пропитывают поверхностный слой смеси, химически разрушая зерна песка. Иногда вместо зерен песка в пригарном слое обнаруживают монолитную массу, состоящую из указанных выше соединений. При этом образуется наиболее тяжелый вид пригара — химический. Из изложенного следует, что необходимой стадией химического пригара являются процессы, связанные с механическим пригаром. Схема образования пригарного слоя показана на рис. 1.41. К описанным выше процессам следует добавить процессы плавления наиболее легкоплавких составляющих смеси (окислы щелочных металлов, зерна полевого шпата, алюмосиликаты глины и т. п.) и их последующего спекания. Эти процессы характерны для так называемого термического пригара.
Все указанные виды пригара, как правило, сосуществуют. Пригарный слой представляет собой самостоятельную фазу, имеющую свою структуру. Этот слой удерживается на поверхности отливки не только за счет действия проникших в смесь прожилок металла, но и за счет адгезии, чему способствуют спекание слоя и структурные превращения в нем. Для уменьшения адгезии необходимо повысить межфазное натяжение на границе поверхность отливки — пригарный слой. В тех случаях, когда межфазное натяжение на этой границе мало, что имеет место при близких структурах металла и слоя, пригарный слой прочно удерживается на поверхности отливки силами адгезии.
Для примера можно привести неожиданный результат, полученный при освоении жидкостекольных смесей на УЗТМ в начале 50-х гг. Данные смеси, связующим в которых является силикат натрия или калия, содержат большое количество легкоплавких окислов щелочных металлов и поэтому отличаются большой пригораемостью. К удивлению технологов, смеси относительно легко были внедрены на стальном литье. При этом образовывался достаточно толстый слой пригара, который легко отскакивал от поверхности отливок при их очистке. В то же время на чугунном литье, несмотря на значительно меньшую, чем при стальном литье, температуру заливки, при применении жидкостекольных смесей образуется трудноудалимый от поверхности отливки пригарный слой. Минералогический и рентгеноструктурный анализ пригарного слоя показали, что при температурах, характерных' для литья чугуна, он имеет кристаллическую структуру, близкую к структуре металла. Это приводит к снижению межфазного натяжения на границе отливка — пригарный слой и, как следствие, к увеличению адгезии. При литье стали пригарный слой имеет вид аморфно-стекловидной массы, что приводит к увеличению межфазного натяжения и снижению адгезии.
Таким образом, поверхностные явления играют важную роль в пригарообразовании. Естественно, такой сложный процесс не исчерпывается только поверхностными явлениями. Комплексное рассмотрение пригарообразования — предмет технологических разделов спецкурса. С точки же зрения поверхностных явлений борьба с пригаром должна быть направлена на уменьшение как смачиваемости металлом материала формы, так и адгезии слоя к сплаву. Это может достигаться соответствующим подбором формовочных материалов, противопригарных покрытий, раскислением металла, предотвращением его окисления в форме, соответствующим легированием сплава и т. п.
Дата добавления: 2014-12-09; просмотров: 2574;
