Раздел 1. СТРОЕНИЕ И СВОЙСТВА ЖИДКИХ МЕТАЛЛОВ И СПЛАВОВ 2 страница
Разрешение этого противоречия осуществляется путем потери дальнего порядка. Новые вакансии могут образовываться только лишь в пустотах плотной упаковки СД (рис. 1.10, б). Скопления и перемещения вакансий по границам СД приводят к тому, что решетка дробится на отдельные блоки, равные по размерам диаметру СД. Эти блоки называются кластерами. Таким образом, в пределах кластера сохраняется порядок в расположении атомов (ближний порядок), но за пределами кластера порядок нарушается (нет дальнего порядка).
Для дробления решетки на кластеры необходимо затратить энергию на разрыв связей кластеров друг с другом. Эта энергия и представляет собой теплоту плавления. Температура Гц, при которой смыкаются СД, равна температуре плавления. При плавлении происходит изменение объема, вызванное двумя следующими эффектами. Вследствие отталкивания друг от друга образовавшихся кластеров происходит увеличение объема. С другой стороны, так как при плавлении силы связи между кластерами резко уменьшаются, увеличивается их подвижность. До перехода в жидкое состояние зоны СД связаны между собой и сохраняют упаковку, характерную для кристалла. После плавления связи между кластерами разрушаются, они получают возможность смещаться относительно друг друга.
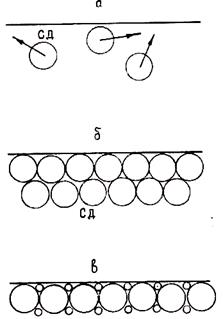
Рис. 1.10. Схема плавления по И. В. Гаврилину и Г. С. Ершову: а – Т<<Tпл; б – T » Тпл; в – Т = Тпл
Известно, что минимуму энергии отвечает более плотная упаковка (минимальная поверхность). Поэтому в жидкости кластеры принимают более плотную упаковку, чем та, которая была в кристалле. Благодаря этому эффекту объем жидкости должен быть меньше объема кристалла. Результирующее изменение объема при плавлении равно алгебраической сумме этих эффектов. Для большинства металлов превалирует первый эффект и объем при плавлении увеличивается примерно на 3%. Для таких аномальных веществ, как висмут, галлий, сурьма, кремний, превалирует эффект переупаковки кластеров и объем при плавлении уменьшается. Кластеры в жидкости находятся в сложном тепловом движении. При этом происходят процессы их воссоединения (восстановления связей) и последующего дробления, но уже по другим поверхностям разрыва.
Следует отметить, что теплота плавления значительно меньше теплоты испарения, а изменения объема невелики. Поэтому силы связи между частицами в жидкости остаются практически на том же уровне, что и в кристалле. Однако возрастает энергия теплового движения. Это позволяет считать, что при температурах, близких к температуре плавления, жидкости ближе к кристаллам, чем к газам.
В заключение необходимо отметить, что теория плавления в настоящее время еще не создана. Приведенная теория может рассматриваться как некоторое приближение.
1.1.3. МОДЕЛИ ЖИДКОГО СОСТОЯНИЯ
До сих пор не созданы такие эффективные модели жидкого состояния, какими являются модель идеального газа для газов и идеального кристалла для кристаллических тел. Все существующие модели жидкого состояния можно разделить на две большие группы: квазигазовые модели и квазикристаллические модели.
Общим для псевдогазовых моделей является игнорирование межчастичного притяжения. Взаимодействие частиц сводится только к их упругим столкновениям. Простейшей является модель «твердых шаров». Частицы жидкости уподобляются твердым взаимно непроникающим шарам. Потенциал их взаимодействия задается в следующем виде:
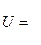 ^ f0, если г > 2R^, ~ [со, если г < 27?щ.
^ f0, если г > 2R^, ~ [со, если г < 27?щ.
Смысл формул сводится к тому, что частицы не взаимодействуют друг с другом, пока не столкнутся. При столкновении возникают упругие силы отталкивания. Радиус шаров принимают или равным радиусу первой координационной сферы кристалла, или на основании рентгенографического исследования жидкости (расстояние до первого максимума интенсивности рассеивания излучения). Так как под действием сил отталкивания при отсутствии притяжения частицы разлетятся, то вводится некоторый коэффициент их упаковки h = pd3N0/6V0, где Vo—мольный объем жидкости; No—число Авогадро. Коэффициент упаковки выбирают для конкретной жидкости.
На основании выбранных значений h и d, а также принятого для твердых сфер указанного выше потенциала можно математически определить радиальную функцию распределения частиц, т. е. число частиц, окружающих данную частицу, как функцию расстояния от нее. При этом расчетные значения функции распределения неплохо согласуются с экспериментальными данными для некоторых металлов с плотными структурами кристаллов, т.е. для гексагональной решетки и гранецентрированного куба. Вместе с тем для большинства металлов расчетные и экспериментальные данные расходятся.
С целью улучшения этой модели в 60-е гг. Дж. Бернал вместо твердых шаров предложил другие конфигурации частиц. Он провел эксперименты с пластилиновыми шарами, подвергнув конструкцию из этих шаров всестороннему сжатию. После сжатия частицы принимали форму многогранников с гранями от треугольных до 12-угольных. Однако значительная часть (больше 30%) частиц принимали вид многогранника с пятиугольными гранями. На основании этого Дж. Бернал сделал вывод, что в жидкости вокруг атома может образовываться кольцо из 5 «соседей». В кристаллах такого координационного числа нет. В остальном модель Бернала остается моделью твердых сфер, отличие состоит в том, что взаимодействуют не отдельные шары, а некоторые их конфигурации, имеющие вид рассмотренных выше фигур, в вершинах которых расположены частицы. Теория Бернала дает неплохие результаты для ряда сжиженных газов (аргон, гелий и т. д.).
Общим недостатком псевдогазовых моделей является игнорирование фактических данных о наличии в жидкости достаточно сильных сил связи. Практически эти модели никак не объясняют, почему жидкость сохраняет свой объем и ее частицы не разлетаются, занимая весь предоставленный объем, как в газах. Чем вызывается плотность упаковки?
Общим для всех квазикристаллических моделей является попытка при описании жидкого состояния учесть специфику сил межчастичного взаимодействия, установить связь структуры жидкости с предшествующим плавлению кристаллическим строением вещества.
Согласно сиботаксической модели Стюарта жидкость состоит из множества хаотически ориентированных микрокристаллических областей — сиботаксисов. Эту модель можно считать частным случаем квазиполикристаллических моделей. В современном виде идеи этих моделей сформулированы В. И. Архаровым и И. А. Новохатским. Жидкость состоит из двух структурных составляющих: кластеров и разупорядоченной зоны. В разупорядоченной зоне структура и тепловое движение соответствуют сильно сжатым реальным газам. В кластерах структура и тепловое движение соответствуют кристаллам. Между кластерами и разупорядоченной зоной нет четко выраженной границы раздела. Эта точка зрения в том или ином виде развивается в других квазикристаллических моделях. Отличия состоят в толковании кластера, характера его движения и межкластерного взаимодействия. Выше мы описали подход к понятию кластера как коллектива частиц кристалла, находящегося внутри сферы деформации около вакансии. Следует заметить, что внутри кластера исходная структура кристалла не повторяется, сохраняется только ближний порядок, т. е. конфигурации первых координационных сфер решетки кристалла.
Все квазикристаллические модели трудно поддаются количественному математическому описанию.
1.1.4. МАТЕМАТИЧЕСКИЕ И ЭКСПЕРИМЕНТАЛЬНЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ ЖИДКОГО СОСТОЯНИЯ
Выделим в среде частицу и проведем сферический слой толщиной dR на расстоянии R от этой частицы. Пусть в этом слое находится dN частиц. Число частиц в единице объема вещества на расстоянии R выразится формулой r(R) = dN/(4pR2dR). Эта величина в общем случае зависит от расстояния R. Она называется радиальной функцией распределения частиц и полностью характеризует структуру вещества. Для идеальных газов характерно хаотическое распределение молекул. Поэтому в среднем в каждой точке газа содержится одинаковое число молекул. В этом случае r(R) не зависит от координаты R и совпадает с объемной плотностью частиц. В идеальных кристаллах частицы расположены только на координационных сферах. Поэтому r(R) между сферами равна нулю. Графически функция радиального распределения частиц в гранецентрированной решетке показана на рис. 1.11 (R—атомный радиус).
Жидкость—динамическая система. Поэтому распределение частиц в ней носит случайный характер. Для описания r(R) следует поэтому использовать аппарат теории вероятностей.
Вероятность того, что в сферическом слое около молекулы 1 можно обнаружить частицу 2, равна dP(R) = W(R)• 4pR2dR/N. Смысл этого выражения сводится к следующему. Представим, что на бумаге начерчен круг радиуса R1, внутри которого находится круг меньшего радиуса R2. Мы с закрытыми глазами ставим внутри большого круга точку. Как оценить вероятность того,
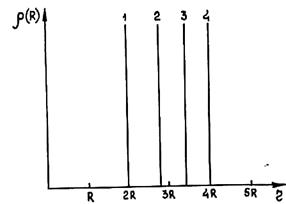
Рис. 1.11. Радиальная функция распределения для гранецентрированного кубического кристалла
что точка попадет внутрь малого круга? Если R2 = R1, то очевидно, что вероятность равна 1. Будем уменьшать радиус малого круга. Ясно, что вероятность будет уменьшаться. Если R2 = 0, то вероятность равна нулю. Поэтому вероятность (отношение числа положительных исходов к общему числу испытаний) можно вычислить как отношение площади малого круга к площади большого круга. Это будет справедливо, если положение частицы 2 не зависит от положения частицы 1.
Если между частицами есть силы взаимодействия, то очевидно, что вероятность нахождения частицы 2 на расстоянии R зависит от того, находится или нет частица / в начале координат. Этот факт учитывается множителем W(R), который называется корреляционной функцией распределения. Если частицы не взаимодействуют, ясно, что W{R} = 1. В случае взаимодействующих частиц W{R) ¹ 1. Так как вероятность нахождения частицы в бесконечной области около данной частицы равна 1, то для корреляционной функции можно написать следующее нормировочное соотношение: 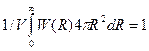 . Выразим число частиц в сферическом слое толщиной dR через радиальную функцию распределения: dN = r(R)4pR2dR. Проинтегрировав это выражение по всему объему среды, получим соотношение
. Выразим число частиц в сферическом слое толщиной dR через радиальную функцию распределения: dN = r(R)4pR2dR. Проинтегрировав это выражение по всему объему среды, получим соотношение 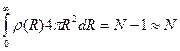 . Сравнивая его с нормировочным соотношением находим, что W(R)=V/N×r(R)=r(R)/r0, где r0 = N/V — среднее число частиц в единице объема. Значит, функция W(R) представляет собой относительную вероятность нахождения частиц на заданном расстоянии R от фиксированной молекулы. Из последней формулы находим p(R) = r0W(R), т. е. для определения радиальной функции распределения нужно знать корреляционную функцию.
. Сравнивая его с нормировочным соотношением находим, что W(R)=V/N×r(R)=r(R)/r0, где r0 = N/V — среднее число частиц в единице объема. Значит, функция W(R) представляет собой относительную вероятность нахождения частиц на заданном расстоянии R от фиксированной молекулы. Из последней формулы находим p(R) = r0W(R), т. е. для определения радиальной функции распределения нужно знать корреляционную функцию.
Рис. 1.12. Зависимость корреляционной функции от расстояния для идеального газа (а), реального газа (б), жидкостей (б) и кристалла ГЦК, (г)
Выясним, какой вид имеет функция W(R) для газов, кристаллов и жидкостей. Для газов, как было сказано выше, W(R) = 1, если R > 2r, где r — радиус частицы; W(R) = 0, если R £ 2r, так как r(R) = rо на всех расстояниях, превышающих диаметр частицы. Для кристаллов характер изменения корреляционной функции в зависимости от расстояния совпадает с приведенным выше графиком изменения радиальной функции распределения r(R).
Амплитуды колебаний частиц в жидкостях гораздо больше, чем в кристалле. При этом молекулы жидкости, участвуя в тепловом движении, беспрерывно обмениваются ближайшими «соседями». Если проследить за поведением какой-либо частицы, то можно убедиться, что за время наблюдения она окажется на разных расстояниях от данной частицы. Вследствие этого корреляционная функция W непрерывна. Она испытывает несколько затухающих колебаний относительно единицы. При расстоянии, превышающем некоторое значение, корреляционная функция практически равна 1, т. е. при этом исчезает порядок в размещении частиц. Это подтверждает факт, что в жидкостях нет дальнего порядка. Максимумы на кривой соответствуют более вероятным межмолекулярным расстояниям, минимумы — расстояниям, на которых частицы бывают очень редко. Последовательность максимумов соответствует последовательности равновесных межмолекулярных расстояний в жидкости и поэтому определяет характер ближней упорядоченности. Кривые W(R) для газов (идеальный и реальный), жидкостей и соответствующих кристаллов приведены на рис. 1.12.
Сопоставляя функции W(R} для жидкости и кристалла, видим, что в кристалле максимумы этой функции разделены промежутками, где W(R) = 0, тогда как в жидкости кривая непрерывна.
Для экспериментального исследования строения жидкостей применяют облучение их рентгеновскими лучами, электронами или нейтронами. При этом рентгеновские лучи рассеиваются электронами атомов, электроны — ядрами атомов и нейтроны — магнитным полем атомов. Этими методами изучают зависимость интенсивности рассеянного излучения от угла, под которым производится облучение. Теория методов, на которой мы не останавливаемся, позволяет связать интенсивность рассеивания с корреляционной функцией, т. е. по кривым интенсивности рассеивания излучения, направляемого под разными углами, можно экспериментально определить изменение корреляционной функции с увеличением расстояния.
Экспериментальные данные по изменению коррелятивных функций металлов показали, что для плотноупакованных металлов в твердом состоянии характерно сохранение ближнего порядка, имеющего место в кристалле, и уменьшение координационного числа. Первый максимум на кривой радиального распределения находится практически на том же расстоянии, что и радиус первой координационной сферы кристалла. Так, для меди в кристалле r1 = 2,55 Å; первый максимум на корреляционной кривой находится на расстоянии 2,55 Å; для алюминия расстояния равны 2,86 и 2,94; для железа — 2,52 и 2,52; для цинка — 2,9 и 2,71 Å. Второй максимум на корреляционной кривой охватывает интервал расстояний, в который попадают радиусы второй, третьей и четвертой координационных сфер кристалла золота. Уменьшение координационного числа при плавлении плотноупакованных металлов (например у алюминия с 12 до 10,8) связано с увеличением объема при плавлении и возрастанием числа вакансий.
Для рыхлых, некомпактноупакованных в твердом состоянии металлов (висмут, олово, сурьма, галлий, кремний, германий и т. п.) также характерно малое отличие расстояния первого максимума на корреляционной кривой от радиуса первых координационных сфер кристаллов (у висмута эти расстояния равны соответственно 3,25 и 3,09, у олова — 3,25 и 3,15, у сурьмы — 3,30 и 2,9 Å). Координационное число у этих металлов при плавлении увеличивается, что связано с уменьшением их объема (у висмута, например, координационное число увеличивается с 3 до 7,5 Å).
Таким образом, экспериментальные исследования подтверждают теоретические выводы о сохранении ближнего порядка кристаллов в жидких металлах и связи их строения со строением исходного кристалла.
Как следует из сказанного выше, для определения радиальной функции распределения необходимо знать корреляционную функцию. Об ее экспериментальном определении мы уже говорили. Математическое ее вычисление составляет предмет статистической физики жидкого состояния, одним из основателей которой можно признать выдающегося советского ученого академика Н. Н. Боголюбова. Рассмотрение этого вопроса выходит за пределы нашего курса.
1.1.5. ОСОБЕННОСТИ СТРОЕНИЯ ЖИДКИХ СПЛАВОВ
В отличие от чистых металлов, которые плавятся при фиксированной температуре, плавление и затвердевание сплавов осуществляется в некотором интервале температур. Температура, при которой начинается плавление или заканчивается затвердевание сплава, называется температурой солидуса Тс. Температура, при которой заканчивается плавление или начинается затвердевание,. называется температурой ликвидуса Тл. Выше температуры ликвидуса существует жидкий сплав, ниже температуры солидуса — твердый сплав. В интервале ликвидус — солидус, который может составлять более 100 °С и называется интервалом кристаллизации имеется двухфазное состояние, т. е. твердая и жидкая фазы сосуществуют. Температура ликвидуса определяется условиями равновесия жидкого сплава данного состава с выделяющейся из него твердой фазой. Аналогично температура солидуса определяется условиями равновесия твердой фазы, отвечающей составу сплава, с жидкой фазой.
В процессе плавления сплава изменяется не только его температура, но и химический состав находящихся в равновесии фаз. Как известно из курса «Металловедение», равновесие различных фаз в сплавах характеризуется диаграммами состояния, связывающими концентрации фаз с температурой и давлением. Известно много типов диаграмм состояния, зависящих от растворимости компонентов в жидком и твердом состояниях.
Вводимые в сплав компоненты могут растворяться в основном металле, образуя твердые растворы. При этом если область растворимости примыкает к чистому металлу, т. е. начинается с нулевой концентрации (на диаграмме «сигара» или ее участок начинается от чистого компонента), то при образовании раствора сохраняется тип кристаллической решетки основного металла (рис. 1.13, а). Если же область твердого раствора не примыкает к чистым металлам, то, как правило, образуется новая, более сложная, решетка (рис. 1.13, б). Если в этом случае интервал растворимости невелик, то образуются так называемые интерметаллические соединения, представляющие собой также твердые растворы со специфической решеткой.
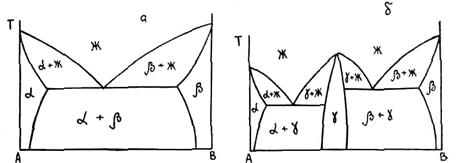
Рис. 1.13. Диаграммы состояния сплавов эвтектического типа без интерметаллидов (а) и с интерметаллидами (б)
Примеров интерметаллидов очень много, и часто именно они определяют механические и технологические свойства сплавов. Например, металлографию алюминиевых сплавов очень часто называют металлографией интерметаллидов. В качестве примера можно привести бинарные интерметаллиды CuAl2, Mg2Si, Mg2Al3 и т. д. Во многих случаях интерметаллиды могут быть многокомпонентными. Необходимо отметить, что часто и интерметаллиды могут образовывать твердые растворы с основным металлом.
Различают два типа твердых растворов: растворы замещения и растворы внедрения. В растворах замещения ионы легирующего компонента размещаются в узлах кристаллической решетки, замещая ионы основного металла-растворителя. Это имеет место тогда, когда размеры атомов компонентов близки друг к другу. Примерами растворов замещения являются растворы никеля в меди, цинка в меди и многие другие. Если размеры атомов сильно различаются и атомы имеют разные строения электронных оболочек, например у металлов и неметаллов, то образуются растворы, внедрения (растворы бора, кислорода, азота). В них атомы растворенного вещества располагаются внутри кристаллической ячейки (в междоузлиях).
Введение легирующего компонента в раствор как при замещении, так и при внедрении искажает кристаллическую решетку, изменяет ее параметр и вызывает упругое напряженное состояние. Кроме того, легирующие компоненты оказывают влияние на скорость перемещения дислокаций.
Растворимость в твердом состоянии зависит от близости атомных диаметров компонентов, однотипности их кристаллических решеток и сходства строения внешних электронных оболочек. В соответствии с правилом Юма — Розери для образования непрерывной растворимости различие в размерах атомов не должно превышать 15%. При больших различиях деформация решетки столь велика, что образование раствора становится термодинамически невыгодным.
При плавлении сплавов и металлов сохраняется ближний порядок (распределение атомов в первых координационных сферах). Исследования показывают, что в жидком и твердом состояниях число атомов каждого сорта в первых координационных сферах пропорционально их концентрации. Кривые интенсивности рассеяния излучений и радиальной функции распределения для сплавов напоминают аналогичные кривые для компонентов, отличаясь лишь координатами расположения максимумов. Максимумы располагаются между максимумами, характерными для чистых компонентов, и по мере увеличения компонента смещаются от одного компонента к другому. Если в твердом растворе атомы расположены статистически, т. е. неупорядоченно, то и в жидком сплаве сохраняется неупорядоченность, и наоборот, упорядоченность в расположении атомов в твердом растворе при плавлении сохраняется.
Статистическое распределение атомов в растворе имеет место, когда энергии парного взаимодействия атомов А и В связаны соотношением Uaa = Ubb = Uab. В этом случае конфигурации А — А, А — В, В — В энергетически равноценны. В этих сплавах расстояние первого максимума на кривой радиального распределения и координационное число линейно изменяются с увеличением концентрации от значений этих величин для компонента А к их значениям для компонента В. При плавлении интерметаллидов, если между компонентами существует сильное взаимодействие, сохраняется ближний порядок в расположении атомов, характерный для твердых интерметаллидов.
Эвтектические сплавы образуются из компонентов, различающихся кристаллической решеткой и имеющих ограниченную растворимость в твердом состоянии. Этот тип сплавов чаще всего образуют металлы и неметаллы (например алюминий — кремний) и металлы с сильно различающимися параметрами решетки (например медь с серебром). В этом случае силы взаимодействия между одноименными атомами больше, чем между разноименными, т. е. Uaa > Uab, Ubb > Uab. Как показали исследования, при плавлении эвтектики расплав состоит из конфигураций, характерных для фаз a-твердого раствора и b-твердого раствора, составляющих эвтектику. При повышении температуры происходит постепенное перемешивание атомов и образование однородного раствора. Квазиэвтектическая структура в расплаве может сохраняться при перегревах на 200—300°С.
Микронеоднородность жидких сплавов вызывается не только наличием кластеров, но и их различным составом, строением, устойчивостью. Самые устойчивые кластеры образуются наиболее сильно взаимодействующими между собой компонентами. Как показали исследования Б. А. Баума, в бинарных железоуглеродистых сплавах возможно наличие следую-
Рис. 1.14. Схема, иллюстрирующая микрунеоднородность железоуглеродистого сплава
щих кластеров. В расплаве существуют межатомные связи Fe — Fe и Fe — С, при этом наиболее сильные — в сплаве Fe — С. Расплав представляет собой неоднородную систему, в которой межатомные связи Fe — Fe в микрообластях, удаленных от атомов примеси, и в непосредственной близости от них отличаются, так как атом углерода вызывает сильные искажения электронной плотности близко расположенных атомов железной матрицы. На рис. 1.14 показана схема микронеоднородной структуры железа, легированного углеродом. Темный кружок обозначает атом углерода; светлый кружок — атом железа; сплошные линии — межатомные связи, номер и длина которых обратно пропорциональны их прочности; заштрихованные области — кластеры типа объемно центрированного куба; окружностью К. ограничен кластер, содержащий углерод.
В системе можно выделить четыре типа межатомных связей, которые в порядке убывания прочности обозначены цифрами 1 — 4. 1 — связь Fe — С внутри кластера, 2 — связь Fe — Fe вблизи атома С, 4 — связь между атомами железа в разных кластерах, 3 — связь между атомами железа в кластере, удаленном от атомов С.
Эта схема характерна для еще не расплавленного сплава. При повышении температуры прежде всего разрываются межкластерные связи 4. Происходит предсолидусное плавление, разнотипные кластеры получают повышенную подвижность. При достижении температуры солидуса начинают разрываться связи 3. Однако эти связи разрываются не все одновременно, процесс разрыва одних связей сопровождается восстановлением других. При этом образуются кластеры, характерные для расплавов чистого железа (заштрихованные области). Этот кластер имеет ближний порядок, характерный для ОЦК. Вместе с этим кластером в расплаве имеется кластер, ограниченный окружностью К. Он имеет структуру ГЦК. Этот кластер обладает повышенной устойчивостью, так как образован более сильными связями. При повышении температуры разрываются сначала связи 2, а затем связи 1.
Реальные железоуглеродистые сплавы многокомпонентны. Поэтому их микронеоднородность носит еще более сложный характер.
1.1.6. ВЗАИМОСВЯЗЬ ЖИДКОГО И ТВЕРДОГО СОСТОЯНИЙ СПЛАВА
Свойства литого сплава в твердом состоянии определяются •свойствами жидкого сплава и условиями его охлаждения в форме. Связь с жидким состоянием сложна и многопланова. Поэтому в данном курсе мы не будем рассматривать ее всесторонне, передав эту задачу технологическим курсам. Рассмотрим основные принципы, определяющие эту связь. Прежде всего, механические и другие свойства сплава в твердом состоянии в значительной мере определяются его кристаллической структурой. Процесс кристаллизации предполагает возникновение в жидком расплаве зародышей новой кристаллической фазы и ее рост. Зародышеобразование непосредственно связано с наличием в жидкости кластеров и их характеристиками. Кроме того, большое значение имеет наличие в расплаве микроскопических включений различного химического состава и строения. Определить их наличие невозможно никаким химическим анализом. Поэтому очень часто при смене поставщика шихтовых материалов при том же химсоставе выплавляемых сплавов существенно изменяются их свойства.
Зависимость свойств сплава от природы шихтовых материалов получила название «наследственность». Кроме неконтролируемого изменения содержания микропримесей наследственность можно объяснить неравновесностью жидкого состояния. Переход системы, является самопроизвольно в течение времени релаксации. При плавлении металла расплав может находиться в неравновесном состоянии, т. е. состав и конфигурация образовавшихся кластеров не обладают минимумом энергии при данных условиях. Если выдержать сплав при данной температуре достаточно долго, то в нем в конце концов установится равновесное состояние. О том, что время релаксации может быть достаточно большим, говорит хотя бы такой факт, что при вводе в расплав металлического феррохрома он не распределяется равномерно в нем даже через 20 мин.
Одним из доказательств неравновесности жидкого расплава является гистерезис свойств при нагреве и последующем охлаждении. Суть гистерезиса состоит в том, что значения свойств, полученные в измерениях в ходе нагрева сплава, не совпадают с соответствующими значениями, полученными при последующем его охлаждении. Повторные циклы измерений дают результаты, совпадающие с теми, которые получены при охлаждении сплава в первом цикле. На рис. 1.15 показан характер гистерезиса кинематической вязкости сплава. Явление гистерезиса не обнаруживается, если сплав перед измерениями подвергнуть достаточной по длительности выдержке. Гистерезис свойств можно объяснить также какими-нибудь превращениями в сплаве при нагреве, связанными с выделением из него включений или продуктов взаимодействия компонентов газовой среды или футеровки. Дискуссии по вопросу, что здесь является главным, продолжаются. Однако можно несомненно признать, что неравновесность состояния сплавов имеет место и ее надо учитывать при организации технологического процесса.
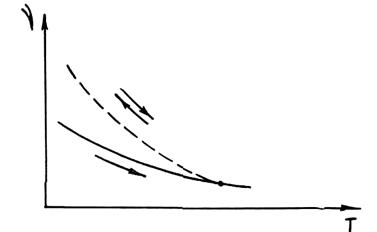
Рис. 1.15. Гистерезис кинематической вязкости
Для управления уровнем неравновесности состояния расплавов сейчас широко применяют термовременную обработку.Приэтом расплав перед разливкой подвергается длительной выдержке при температуре, несколько превышающей температуру заливки. Экспериментальные данные показывают, что при этом устраняется гистерезис свойств и существенно повышаются механические свойства литого сплава.
ГЛАВА 1.2. РЕОЛОГИЧЕСКИЕ СВОЙСТВА ЖИДКИХ И ТВЕРДЫХ СПЛАВОВ
Реология — наука, которая изучает деформации тел. Следует напомнить, что деформация—это изменение размеров и формы тела. Реология устанавливает связь между напряжениями, создаваемыми приложенными к телу силами, и вызываемыми ими деформациями. В теории литейных процессов идеи реологии начали использоваться не более 10—15 лет назад. Для реальных физических объектов связь между напряжениями и деформациями можно выразить в виде следующего уравнения: F(t, e, e, en, t, t, ..., tm) = 0.
Дата добавления: 2014-12-09; просмотров: 2930;
