Длительная почечная колика может сопровождаться повышением артериального давления, а при пиелонефрите - повышением температуры. 4 страница
Диффузный токсический зоб в ряде случаев отмечается у новорожденных детей. Это возможно в том случае, если данное заболевание наблюдается у их матерей.
Диагностика
Для подтверждения диагноза диффузного токсического зоба необходимо провести исследование крови на тиреоидные гормоны. При этом отмечается уменьшение количества тиреотропного гормона и одновременное увеличение количества тироксина (Т4) и трийодтиронина (Т3). Проводится УЗИ щитовидной железы с целью определения наличия диффузного процесса и определения ее размеров. В случае, если общий объем щитовидной железы превышает 45 см3, необходимо провести оперативное лечение данного заболевания.
По показаниям проводят сцинтиграфию щитовидной железы.
При постановке диагноза необходимо учитывать размер зоба, степень его тяжести, наличие сопутствующих заболеваний.
Выделяют три степени тяжести диффузного токсического зоба: легкую, среднюю и тяжелую.
Диагноз легкой степени тяжести ставится при наличии следующих симптомов: частота сердечных сокращений – 80-120 ударов в мин., резко выраженное похудение больного, тремор рук выражен слабо, незначительное снижение работоспособности.
Средняя степень тяжести характеризуется следующими критериями: число сердечных сокращений – 100-120 ударов в минуту, пульсовое давление повышено, снижение массы тела более 10 кг, снижение работоспособности.
Тяжелая степень тиреотоксикоза: частота сердечных сокращений - более 120 ударов в минуту, отмечается присоединение мерцательной аритмии, выражены психические нарушения, выявляется дистрофия внутренних органов, резко снижена масса тела (более 10 кг), утрата трудоспособности.
Осложнениями течения диффузного токсического зоба могут быть тиреотоксический криз, эндокринная офтальмопатия.
1. Тиреотоксический криз
Тиреотоксический криз является очень тяжелым состоянием, осложняющим диффузный токсический зоб, и может представлять достаточно серьезную угрозу для жизни пациента.
Патогенез
При развитии данного осложнения происходит повышение количества свободных форм тироксина и трийодтиронина вследствие нарушения процесса их связывания и повышение чувствительности организма к катехоламинам.
Провоцирующим фактором в данном случае является инфекционное заболевание, стрессовое состояние организма и иное, развивается характерная клиническая симптоматика.
Состояние больного резко ухудшается, что связано с усилением проявлений всех симптомов, характерных для состояния тиреотоксикоза.
Больной становится чрезмерно подвижным, отмечается его возбуждение. При осмотре наблюдается вынужденное положение больного, характерное для тиреотоксического криза: ноги согнуты в коленях и разведены в стороны («поза лягушки»). Характерна гипотония мышц, что клинически проявляется нарушением речи. Повышается температура тела, при этом кожа на ощупь горячая и влажная. Отмечается увеличение числа сердечных сокращений до 130 ударов в минуту. Может нарушаться сердечный ритм. Необходимо срочное проведение лечебных мероприятий.
2. Эндокринная офтальмопатия
Данное осложнение представляет собой поражение периорбиитальных тканей аутоиммунного генеза.
Патогенез развития данного осложнения заключается в том, что образующиеся в организме под влиянием аутоимммунных процессов антитела способствуют развитию воспалительных изменений в ретробульбарной клетчатке. Это приводит к развитию экзофтальма и дистрофии глазодвигательных мышц.
Клиническая симптоматика эндокринной офтальмопатии развивается постепенно. Сначала изменения наблюдаются только со стороны одного глаза. При прогрессировании патологии поражается второй глаз. Больных начинает беспокоить чувство давления, локализующееся за глазными яблоками. С течением времени развивается экзофтальм, что обычно приводит к неполному смыканию век. Прогрессирование процесса приводит к сдавливанию зрительного нерва, что клинически проявляется нарушениями цветовосприятия, сужением полей зрения и отеком зрительного нерва, что выявляется при осмотре окулистом.
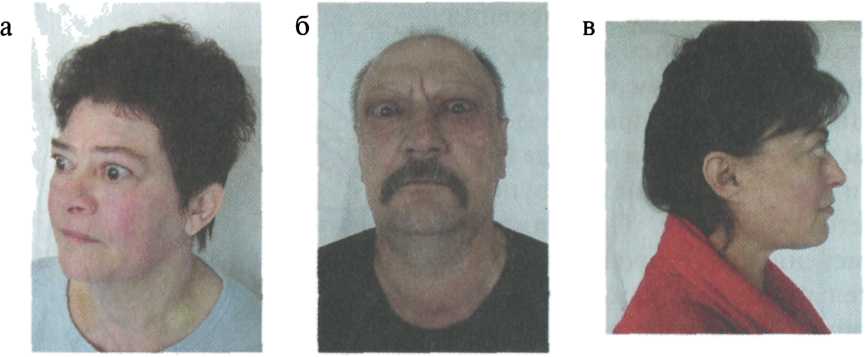
| Рис. 3.16. Пациенты с эндокринной офтальмопатией (а, б, в) |
Йоддефицитные состояния. Эндемический зоб.
К йоддефицитным состояниям относятся все патологические состояния, развивающиеся в популяции вследствие йодного дефицита, которые могут быть предотвращены при нормализации потребления йода.
Плодородная почва, а так же растительная и животная пища содержат очень мало этого микроэлемента. Согласно данным ВОЗ, около 30% населения земного шара имеют риск развития йододефицитных заболеваний.
К основным йододефицитным заболеваниям относится диффузный эутиреоидный эндемический зоб.
Диффузный эутиреоидный эндемический зоб – диффузное увеличение щитовидной железы без изменения ее функции, связанное с дефицитом йода. Зоб выявляется в регионах йодного дефицита, обозначается термином эндемический. Такими регионами является Сибирь, Урал, Среднее Поволжье.
В сутки взрослый человек должен получать с пищей и водой от 100 до 200 микрограмм йода. Если количество йода снижается до 50 микрограмм, происходит компенсаторное увеличение размеров щитовидной железы, и развивается эндемический зоб.
Патогенез.
При йодном дефиците тиреоциты выделяют ростовые факторы, которые вызывают их гиперплазию и способствует увеличению щитовидной железы.
Эпидемиология
Распространенность зависит от выраженности йодного дефицита. Так в регионах легкого йодного дефицита распространенность эутиреоидного зоба составляет 10% населения, при тяжелом йодном дефиците она может достигать 100%.
Клинические проявления
Как правило отсутствуют за исключением относительно редких случаев значительного увеличения щитовидной железы. Иногда пациенты предъявляют жалобы на неприятные ощущения в области шеи, видимый зоб может стать косметической проблемой, что заставляет обратиться пациента к эндокринологу.
Дианостика
Пациентам, у которых при пальпации щитовидной железы обнаружен зоб, показано УЗИ щитовидной железы для оценки ее объема, а так же определение уровня ТТГ для исключения нарушения ее функции. В норме объем щитовидной железы у женщин не превышает 18 мл3, а у мужчин – 25 мл3.
При диффузном эутиреоидном зобе отмечается увеличение обеих долей щитовидной железы и нормальная ее функция.
В настоящее время наиболее распространена классификация, предложенная ВОЗ для оценки размеров эндемического зоба при эпидемиологических исследованиях (табл.).
Табл. Классификация зоба (ВОЗ, 2001)
| Степень | Характеристика |
| Зоба нет (объем долей не превышают размер дистальной фаланги большого пальца обследуемого) | |
| I | Пальпируются увеличенные доли ЩЖ, но сама она не видна при нормальном положении шеи. Сюда же относятся узловые образования, которые не приводят к увеличению самой ЩЖ. |
| II | Увеличенная ЩЖ видна при нормальном положении шеи |
ТИРЕОИДИТЫ
Термин «тиреоидит» объединяет группу воспалительных заболеваний ЩЖ. Наиболее часто встречаются различные варианты аутоиммунного тиреоидита.
Выделяют несколько видов тиреоидита: острый гнойный, острый негнойный, подострый, аутоиммунный, послеродовой, хронический фиброзный инвазивный тиреоидит Риделя, хронические специфические формы.
1. Острый гнойный тиреоидит
Этиологическими факторами развития острого гнойного тиреоидита могут являться стафилококки, стрептококки, пневмококки и кишечная палочка.
Характерными жалобами больных при остром гнойном тиреоидите являются боль и затруднения, возникающие во время акта глотания, а также ощущение неприятного характера в области шеи. При прогрессировании процесса в области расположения щитовидной железы наблюдается припухлость и гиперемия. При пальпации данной области отмечается резкая болезненность.
В патологический процесс вовлекаются близко расположенные лимфатические узлы, такие как шейные и подключичные. Боль с течением времени может распространяться до уха. Отмечается повышение температуры тела до 38,5 °С и выше. Продолжительность заболевания колеблется от 44хнедель до 44х месяцев. В случае поздней диагностики заболевания, а также отсутствия лечения или неправильной его тактики могут развиваться различные осложнения острого гнойного тиреоидита, такие как гнойный медиастинит, сепсис, абсцесс, флегмона шеи, пневмония аспирационного генеза.
При исследовании крови отмечается повышение СОЭ, нейтрофильный лейкоцитоз. При УЗИ щитовидной железы определяется наличие гипоэхогенного участка в ее толще. В запущенных случаях при проведении пробной пункции щитовидной железы определяется гнойное отделяемое. Основной метод лечения данной патологии - хирургический. В послеоперационном периоде проводится активная антибактериальная терапия. В случае развития абсцесса необходимо произвести дренирование.
2. Острый негнойный тиреоидит
Правильная постановка диагноза при данном заболевании встречается в крайне редких случаях, так как в большинстве случаев состояние больного расценивается как ОРВИ или обострение хронического тонзиллита. Обычными жалобами больных при остром негнойном тиреодите являются повышение температуры тела, а также боль в горле, появляющаяся при глотании. Также нередкой жалобой является появление чувства давления в области щитовидной железы и болезненность при пальпации данной области. Причинами развития острого негнойного тиреоидита могут быть различные травмы щитовидной железы, кровоизлияния в ее ткань. При этом возникает асептическое воспаление в щитовидной железе.
3. Подострый тиреоидит
Данное заболевание примерно в 5 раз чаще встречается у женщин, чем у мужчин. В большинстве случаев заболевание возникает в возрасте 30—60 лет в осеннееезимний период. Как правило, подострый тиреоидит развивается на фоне перенесенного гриппа, эпидемического паротита, кори, а также заболеваний верхних дыхательных путей, т. е. имеет вирусную этиологию. Кроме этого, прослеживается наличие генетической предрасположенности к данному заболеванию. Вирусный агент, попадая в кровоток, проникает в ткань щитовидной железы. Там он внедряется в ее клетки — тиреоциты, приводя к выходу содержимого фолликулов железы в кровоток. Обычно симптомы подострого тиреоидита начинают проявляться спустя 5-6 недель после какой - либо вирусной инфекции.
Больные в типичных случаях предъявляют жалобы на внезапно возникшие боли в области щитовидной железы, усиливающиеся при глотании и совершении каких-либо движений шеей. При этом может отмечаться иррадиация боли в нижнюю челюсть и уши. Боль может быть различной интенсивности, а также может изменяться. Больные могут отмечать «летучий» характер боли, т. е. постоянный переход ее из одной области шеи в другую. Помимо этого, при объективном обследовании отмечается тахикардия, снижение массы тела, носящее прогрессирующий характер. Данные общие симптомы объясняются как наличием в организме инфекционного агента, так и возникновением состояния тиреотоксикоза.
При пальпации щитовидной железы можно отметить ее болезненность. Щитовидная железа обычно увеличена в размерах, ее консистенция становится плотной. В зависимости от объема пораженной ткани железы болезненность при пальпации может носить как локальный, так и диффузный характер. В анализах крови отмечается повышение СОЭ, небольшой лейкоцитоз, повышение уровня тиреоглобулина и гормонов щитовидной железы.
Под острый тиреоидит протекает в несколько стадий: такие как начальная, или тиреотоксическая, гипотиреоидная, нормализация тиреоидного статуса.
Существует ряд критериев для постановки диагноза подострого тиреоидита. Одним из них является повышение СОЭ при одновременном небольшом лейкоцитозе, который в ряде случаев может отсутствовать вовсе. Кроме этого, отмечается пониженное поглощение тканью щитовидной железы радиоактивного йода при одновременном повышении уровня сывороточного тиреоглобулина и гормонов щитовидной железы.
Прогноз при подостром тиреоидите в подавляющем большинстве случаев является положительным.
4. Аутоиммунный (лимфоцитарный) тиреоидит
В большинстве случаев заболевание поражает женщин. Аутоиммунный тиреоидит является заболеванием с наследственной предрасположенностью. Причиной развития патологии является наличие генетического дефекта, приводящего к нарушению иммунного ответа организма. При этом образуются Т-лимфоциты, оказывающие разрушающее воздействие на клетки щитовидной железы. Довольно часто аутоиммунный тиреоидит сочетается с другими заболеваниями аутоиммунной природы, такими как сахарный диабет I типа, пернициозная анемия, хронический аутоиммунный гепатит, аутоиммунный первичный гипокортицизм, витилиго, ревматоидный артрит и т. д.
При развитии аутоиммунного тиреоидита щитовидная железа проходит ряд морфологических изменений. Почти в 100% случаев процесс заканчивается формирование состояния гипотиреоза.
В начале заболевания, как правило, отмечается тиреотоксикоз, который может являться следствием повреждения тиреоцитов при аутоиммунных процессах и поступления при этом в кровоток большого количества уже синтезированных гормонов щитовидной железы.
В конечном итоге у большинства больных формируется состояние гипотиреоза, которое расценивается как необратимое.
К методам диагностики аутоиммунного тиреоидита относятся УЗИ щитовидной железы, лабораторное исследование крови, пункционная биопсия.
При исследовании крови определяется наличие антител к тиреоглобулину.
При УЗИ щитовидной железы отмечается диффузное снижение ее эхогенности, что может также свидетельствовать в пользу диффузного токсического зоба. Показанием для проведения пункционной биопсии щитовидной железы обычно является наличие в ее ткани узлового образования. В данном случае исследование проводится с целью исключения наличия опухолевого образования в ткани железы. Диагноз аутоиммунного тиреоидита устанавливается только при наличии нее скольких признаков, характерных для него.
ДИАГНОСТИКА ЗАБОЛЕВАНИЙ ГИПОФИЗА И НАДПОЧЕЧНИКОВ
АФО строения гипоталамо-гипофизарной системы.
Акромегалия. Несахарный диабет. Этиология. Патогенез. Клиника. Диагностика.
АФО надпочечников. Болезнь Иценго-Кушинга. Хроническая надпочечниковая недостаточность. Этиология. Патогенез. Клиника. Диагностика.
Гипофиз — железа внутренней секреции, расположенная в гипофизарной ямке турецкого седла клиновидной кости.
В гипофизе различают две доли: переднюю (аденогипофиз) и заднюю (нейрогипофиз). В аденогипофизе вырабатывают тиреотропный гормон (ТТГ), адренокортикотропный гормон (АКТГ), гонадотропный гормон (ФСГ и ЛГ), а также гормон роста (соматотропин), пролактин, меланоцитстимулирующий гормон.
В нейрогипофизе оканчиваются волокна гипоталамо-гипофизарного тракта, по которым поступают секретируемые в ядрах гипоталамуса вазопрессин (антидиуретический гормон) и окситоцин.
Аденогипофиз является ключевым регулятором эндокринной системы. Секретируемые им гормоны (ЛГ, ФСГ, ТТГ, АКТГ) регулируют функцию периферических эндокринных желез: щитовидной, коры надпочечников, гонад. Другие гормоны (ГР, пролактин) оказывают прямое действие на органы и ткани-мишени.
Гипоталамус расположен на основании мозга и выделяет гормоны, усиливающие (рилизинг-гормоны, либерины) и тормозящие (статины) выделение соответствующих тропных гормонов, а так же нейрогормоны – вазопрессин и окситоцин.
Гормон роста (ГР, соматотропин) — полипептидный гормон эффекты которого на органы и ткани реализуются инсулиноподобным ростовым фактором-1 (ИРФ-1), синтезирующимися в печени под влиянием ГР. Основным эффектом ГР у детей и подростков является стимуляция продольного роста костей (преимущественно длинных трубчатых и в меньшей степени губчатых). Кроме того, ГР стимулирует синтез белка и задержку азота, оказывает липолитическое и антинатрийуретическое действие. Введение физиологических доз ГР дает кратковременный инсулиноподобный (снижение гликемии), а затем контринсулярный эффект.
Адренокортикотропный гормон (АКТГ, кортикотропин) является стимулятором продукции кортизола и андрогенов в коре надпочечников.
Самостоятельной и во многом автономной системой является нейрогипофиз, состоящий из аксонов супраоптического и паравентрикулярного ядер гипоталамуса.
Вазопрессин (аргинин-вазопрессин, антидиуретический гормон, АДГ). Рецепторы АДГ находятся в дистальных извитых канальцах нефрона; их активация приводит к усилению реабсорбции воды.
АКРОМЕГАЛИЯ И ГИГАНТИЗМ
Акромегалия и гигантизм — тяжелые заболевания, возникающие вследствие избыточной продукции гормона роста (ГР) аденомой гипофиза (соматотропиномой). Эти два заболевания являются возрастными вариациями одного и того же патологического процесса, конкретные клинические проявления которого определяются степенью завершенности остеогенеза.
Этиология
Причиной в 99% случаев является аденомы гипофиза (макроаденомы), секретирующие ГР и нередко другие гормоны (пролактин, ТТГ, ФСГ).
Патогенез
Изменения в органах при акромегалии сводятся к их истинной гипертрофии и гиперплазии (спланхномегалии). Разрастается паренхима и строма всех внутренних органов: легких, сердца, печени, поджелудочной железы, кишечника, селезенки. С прогрессированием заболевания в связи с пролиферацией соединительной ткани во всех органах происходят склеротические изменения, сопровождающиеся прогрессирующим развитием их недостаточности. Параллельно отмечается повышение риска возникновения доброкачественных и злокачественных новообразований во всех тканях и органах, включая эндокринные. У детей и подростков с продолжающимся ростом хроническая гиперпродукция гормона роста проявляется гигантизмом, характеризующимся чрезмерным, превышающим физиологические границы сравнительно пропорциональным эпифизарным и периостальным ростом костей, увеличением мягких тканей и органов. У взрослых, поскольку после окостенения эпифизарных хрящей дальнейший рост невозможен, развивается акромегалия (от akros — крайний, megas — большой). При этой патологии также отмечается ускоренный рост тела, но не в длину, а в ширину за счет мягких тканей, что проявляется диспропорциональным периостальным ростом костей скелета, увеличением массы внутренних органов и характерным нарушением обмена веществ.
Эпидемиология
Распространенность акромегалии составляет около 40—60 случаев на миллион населения. Встречается с одинаковой частотой у мужчин и женщин, как правило, в возрасте 40—60 лет. Гигантизм является казуистически редкой патологией.
Клинические проявления
Акромегалия, как правило, характеризуется постепенным началом с медленным нарастанием симптоматики и изменением внешности. Диагноз акромегалии в среднем устанавливается примерно через 7 лет после реального начала заболевания. Основными симптомами являются:
♦ Изменения внешности весьма характерны и в подавляющем большинстве случаев именно они позволяют заподозрить акромегалию. Характерно огрубение черт лица, связанное с увеличением надбровных дуг, скуловых костей, нижней челюсти. Отмечается гипертрофия мягких тканей лица: носа, губ, ушей. Увеличение нижней челюсти ведет к изменению прикуса (прогнатизм) за счет расхождения межзубных промежутков (диастема). Язык увеличен (макроглоссия), на нем часто видны отпечатки зубов. Изменение внешности развивается достаточно медленно, так что пациент сам его не замечает. Кроме того, происходит увеличение размеров кистей и стоп (пациенты часто указывают на увеличение размера обуви, порой значительное). При гигантизме, в отличие от акромегалии, происходит увеличение линейного роста.
Выраженная гипертрофия хрящевой ткани суставов обусловливает артралгии. Увеличение количества и повышение функциональной активности потовых желез ведут к значительной потливости (при осмотре можно иногда увидеть ручейки пота, стекающие по телу больного). Активация и гипертрофия сальных желез, утолщение кожи приводят к ее характерному виду (плотная, утолщенная, с глубокими складками, более выраженными на волосистой части головы).

| Рис. 2.6. Динамика внешности пациента с акромегалией: а - 1972 г.; б - 1979 г.; в - 1991 г. |
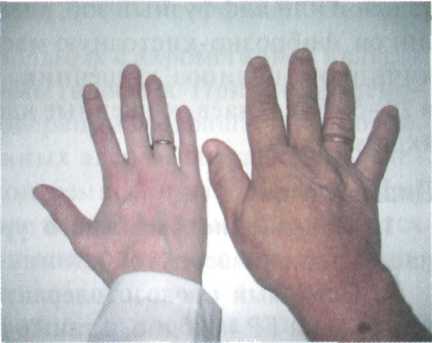
| Рис. 2.7. Увеличение кисти, утолщение пальцев при акромегалии (рядом кисть здорового человека) |
Спланхномегалия с последующим развитием органной недостаточности.
Влияние ГР на мышцы и внутренние органы на начальных этапах заболевания малозаметно, а порой, особенно у спортсменов и лиц физического труда воспринимается позитивно, поскольку увеличиваются работоспособность и физическая активность, но по мере прогрессирования заболевания мышечные волокна дегенерируют, обусловливая нарастающую слабость, прогрессирующее снижение работоспособности. Некомпенсированная длительная гиперпродукция ГР ведет к развитию прогрессирующей сердечной недостаточности, являющаяся причиной гибели больных.
У 30 % пациентов с акромегалией выявляется артериальная гипертензия.
♦ Головные боли, связанные с деструкцией турецкого седла, его диафрагмы и внутричерепной гипертензией.
♦ Синдром апноэ во сне развивается у 90 % больных с акромегалией. Это связано с разрастанием мягких тканей верхних дыхательных путей и поражением дыхательных центров.
♦ Гипофизарная недостаточность связана с разрушением и сдавлением гипофиза опухолью. Возникают нарушения менструального цикла, бесплодием.
♦ Хиазмальный синдром – сдавление зрительного нерва разрастающейся опухолью с нарушением полей зрения.
♦ Симптоматический сахарный диабет (до 50 % пациентов), т.к. ГР является контринсулярным гормоном.
♦Развитие доброкачественных и злокачественных опухолей различной локализации вследствие хронической гиперподукции ростовых факторов. При акромегалии нередко выявляют узловой или диффузный зоб, аденоматозную гиперплазию надпочечников, фиброзно-кистозную мастопатию, миому матки, поликистоз яичников, полипоз кишечника.
Диагностика
1. Повышение базального уровня ГР выявляют у большинства пациентов с развернутой клинической картиной акромегалии.
2.Оральный глюкозотолерантный тест- подразумевает исследование уровня ГР исходно, а также в пробах крови через 30, 60, 90 и 120 минут после приема внутрь 75 г глюкозы. В норме при нагрузке глюкозой уровень ГР снижается. В активной фазе акромегалии уровень ГР не уменьшается или выявляется парадоксальное повышение уровня ГР.
3.Весьма информативным исследованием является определение уровня ИРФ-1- инсулиноподбный ростовой фактор (соматомедина С). У взрослых единственной причиной повышения уровня ИРФ-1 является акромегалия, а выявление нормального уровня ИРФ-1 практически исключает этот диагноз.
4.МРТ гипофиза для визуализации аденомы.
5.Обследование на предмет возможных осложнений (полипоз кишечника, сахарный диабет, многоузловой зоб и др.).
Несахарный диабет — клинический синдром, возникающий в результате нарушения концентрационной функции почек, что связано с дефицитом антидиуретического гормона или с нарушением чувствительности почечных канальцев к его действиям.
Эпидемиология
НД относительно редкое заболевание (0,5-0,7 % всех эндокринопатий), которое возникает с одинаковой частотой улиц обоего пола, чаще в возрасте 20—40 лет; известны случаи заболевания в любом возрасте. Каждый 5-й случай НД обусловлен нейрохирургическим вмешательством. Почечный НД — казуистически редкие заболевания, которые относительно чаще встречаются у детей, но иногда выявляются значительно позднее.
Классификация
Существует следующая классификация.
1. Центральный (гипоталамоогипофизарный) несахарный диабет:
1) идиопатический;
2) симптоматический.
2. Почечный несахарный диабет.
Этиология
Этиология центрального несахарного диабета неизвестна, т. е. это идиопатический несахарный диабет. У части пациентов выявлялись антитела к вазопрессин-продуцирующим клеткам аденогипофиза.
В большинстве случаев центральный несахарный диабет является симптоматическим, т. е. развивается при каких-либо заболеваниях.
В подавляющем большинстве случаев НД чаще всего связан с деструктивными процессами в области гипофиза (первично гипофизарные или метастатические опухоли, оперативные вмешательства и прочее). Могут провоцировать развитие НС такие заболевания как грипп, ангина, скарлатина, коклюш, туберкулез, сифилис, ревматизм.
Патогенез
Врезультате дефицита антидиуретического гормона нарушается концентрационная функция почек, что проявляется выделением большого количества мочи низкой плотности. В результате стимуляции центра жажды в головном мозге развивается полидипсия.
Почечный несахарный диабет может являться следствием анатомической неполноценности почечного нефрона или дефектом ферментов, что препятствует воздействию вазопрессина на проницаемость мембраны почечных канальцев для воды.
Клиника
Клиника зависит от степени недостаточности антидиуретического гормона. Количество жидкости, которое больной поглощает в течение суток, может колебаться от 33х до 40 л и более.
Первым признаком несахарного диабета у детей является никтурия, при этом моча является обесцвеченной.
Заболевание может начинаться как остро, так и постепенно, отмечается снижение аппетита, массы тела, кожные покровы и слизистые становятся сухими, пото- и слюноотделение снижено.
Кроме того, постоянная перегрузка жидкостью приводит к опущению и увеличению размеров желудка, расширению мочевого пузыря, мочеточников и почечных лоханок.
При снижении чувствительности центра жажды развивается обезвоживание организма. Это состояние проявляется слабостью, тахикардией, гипотензией, головной болью, тошнотой и рвотой, нарушением реологических свойств крови.
В результате дегидратации в крови повышается уровень натрия, эритроцитов, гемоглобина и остаточного азота. При прогрессировании патологического процесса появляются судороги и психомоторное возбуждение.
В случае несахарного диабета в результате патологического процесса в головном мозге развивается неврологическая симптоматика, которая зависит от локализации патологического очага.
Диагностика
· Полиурия (не менее 3 литров вдень).
· Нормогликемия (исключение сахарного диабета).
· Низкая относительная плотность мочи (при показателе более
1005 диагноз может быть надежно исключен).
· Гипоосмолярность мочи (< 300 мОсм/кг).
· Отсутствие патологии почек, гиперкальциемии и гипокалиемии.
· Тест с сухоядением: воздержание от жидкости на протяжении 8—12 часов; в случае НД происходит снижение веса более чем на 5 % и не происходит повышения относительной плотности и осмолярнос-ти мочи (<300 мОсм/кг).
· МРТ для исключения объемного образования гипоталамо-гипофизарной области.
Анатомия надпочечников
Надпочечник — парная железа внутренней секреции, расположенная в забрюшинном пространстве над верхним полюсом почки.
Надпочечники состоят из мозгового и коркового веществ.
Гистологически в коре надпочечника, на долю которой приходится 80 - 90 % ткани всего органа, выделяют 3 зоны. Непосредственно под капсулой располагается клубочковая зона, секретирующая минералокортикоиды (альдостерон). К ней прилежит пучковая зона, основными продуктами которой являются глюкокортикоидные гормоны (кортизол). Самая внутренняя зона - сетчатая, которая в основном секретирует андрогены.
Т.е. гормоны коры надпочечника (кортикостероиды) подразделяют на три основных класса: минералокортикоиды, глюкокортикоиды и андрогены.
Клинические проявления патологии надпочечников обусловлены снижением (гипокортицизм), повышением (гиперкотицизм) синтеза надпочечников гормонов по сравнению с нормой.
В мозговом слое надпочечников имеются хромаффинные клетки, в которых вырабатываются катехоламины (адреналин, норадреналин и дофамин).
Синдром Иценко-Кушинга - синдром, который обусловлен эндогенной гиперпродукцией или длительным экзогенным введением кортикостероидов.
Этиология
В большинстве случаев 90% причиной синдрома Кушинга является аденома гипофиза (болезнь Иценго-Кушинга, которая связана с избыточным синтезом опухолью гипофиза АКТГ, которая приводит к диффузной гиперплазии коры надпочечников). Другой причиной развития синдрома является кортизопродуцирующая опухоль надпочечника, возникающая из коркового вещества надпочечника или эктопированная АКТГ продуцирующая опухоль (может локализоваться в любых органах – кишечнике, легких и др.).
Патогенез
При формировании опухоли, нарушается нормальная секреция АКТГ.
В основе патогенеза патологических изменений, которые при синдроме И-К развиваются со стороны большинства органов и систем, лежит в первую очередь гиперпродукция кортизола. Повышение уровня стероидных гомонов в крови приводит к полиорганному и полисистемному поражению.
Избыток кортизола оказывает катаболическое действие на белковые структуры большинства тканей (кости, мышцы, в том числе гладкие и миокард, кожа, внутренние органы и т.п.), в которых постепенно развиваются выраженные дистрофические и атрофические изменения. Нарушения углеводного обмена заключаются в стойкой стимуляции глюконеогенеза и гликолиза в мышцах и печени, что приводит к гипергликемии (стероидный диабет). На жировой обмен избыток кортизола оказывает комплексное действие: на одних участках тела происходит избыточное отложение, а на других — атрофия жировой клетчатки, что объясняется разной чувствительностью отдельных жировых компартментов к ГК. Важным компонентом патогенеза являются электролитные расстройства (гипокалиемия, гипернатриемия), которые обусловлены влиянием избытка кортизола на почки. Прямым следствием этих электролитных сдвигов является артериальная гипертензия и усугубление миопатии, в первую очередь кардиомиопатии, которая приводит к развитию сердечной недостаточности и аритмиям. Иммуносупрессивное действие ГКС обуславливает склонность к инфекциям.
Дата добавления: 2015-01-02; просмотров: 1355;
