Метод электронного баланса
Процессы окисления и восстановления выражают электронными уравнениями, в которых указывается количество электронов, принятых окислителем и отданных восстановителем. В левой и правой частях этих полуреакций должно соблюдаться равенство числа атомов каждого элемента и зарядов. Метод подбора коэффициентов к ОВР, где используется это правило, называется методом электронного баланса, поэтому между левой и правой частью полуреакции необходимо ставить знак равенства (=). При подборе коэффициентов в уравнениях окислительно-восстановительных реакций методом электронного баланса следует придерживаться следующего порядка:
1) составить схему реакции, определить степени окисления у всех атомов элементов и указать их над атомами в схеме, определить атомы, которые изменяют свою степень окисления, например:
K+1Mn+7O-24 + Fe+2S+6O-24+ H+12S+6O-24  Mn+2S+6O-24 + Fe+32(S+6O-24)3 + K+12S+6O-24 + H+12O-2,
Mn+2S+6O-24 + Fe+32(S+6O-24)3 + K+12S+6O-24 + H+12O-2,
В данной реакции изменяют степень окисления атомы марганца и железа. KMnO4 - окислитель, FeSO4 - восстановитель. Следует отметить, что заряды кислотных остатков не изменяются (например, SO42- , NO3- , РО43-). Здесь кислотный остаток SO42-.
2) написать электронные уравнения для процессов окисления и восстановления, учитывая, что в соответствии с электронным балансом число принятых окислителем электронов равно числу электронов, отданных восстановителем:
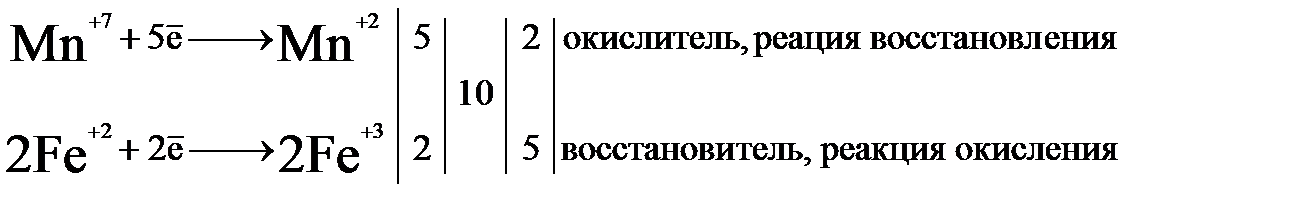
Три колонки чисел после составления схемы движения электронов означают: числа 5 и 2 в первой слева колонке, это количество электронов, отданное восстановителем и принятое окислителем. Число десять в средней колонке это наименьшее общее кратное между количеством электронов из левой колонки. Т.е. число, которое можно поделить на 5 и 2 без остатка. Числа 2 и 5, в правой колонке, это коэффициенты, на которые надо умножить составляющие полуреакций, чтобы число принятых окислителем электронов было равно числу электронов, отданных восстановителем. После сложения левых и правых частей уравнений (с учетом коэффициентов) получают уравнение материального баланса для атомов элементов, изменяющих свою степень окисления:
2Mn+7 + 10Fe+2 = 2Mn+2 + 10Fe+3
Число атомов железа в степени окисления +3 в правой части уравнения равно двум в молекуле Fe2(SO4)3, поэтому в процесс окисления записываются два атома и число электронов удваивается.
Следует помнить, что данное действие применяется всегда, если молекула содержит более одного атома окислителя или восстановителя. В баланс записывается необходимое количество атомов, а число электронов, отданных или принятых одним атомом, умножается на общее количество атомов окислителя или восстановителя.
3) расставить коэффициенты в уравнение реакции перед окислителем и восстановителем и, соответственно, перед молекулами в которых находятся продукты окисления и восстановления. Остальные коэффициенты определяют при подсчете баланса других атомов, не изменяющих степень окисления: катионы металлов, кислотные остатки и, в последнюю очередь, атомы водорода и кислорода. Сумма атомов каждого элемента в левой и в правой части уравнения должны быть равны:
2KMnO4 + 10FeSO4 + H2SO4 = 2MnSO4 + 5Fe2(SO4)3 + K2SO4 + H2O.
Перед Fe2(SO4)3 ставится цифра 5, потому что в одной молекуле уже содержится два атома железа в степени окисления +3. Следовательно, удвоив число 5, получим 10.
Коэффициенты перед атомами, не изменяющими степень окисления, определяют в следующем порядке:
- число катионов металла (в данной реакции ионов калия К+);
- число атомов кислотообразующих элементов (в данной реакции сера в кислотном остатке S+6);
- число атомов водорода (по ним уравнивается количество молекул воды, если они присутствуют в реакции);
- в последнюю очередь число атомов кислорода.
Очевидно, что суммы атомов каждого элемента в левой, и в правой частях уравнения, должны быть одинаковыми. Число атомов кислорода в левой части уравнения равно 80, в правой части тоже.
2KMnO4 + 10FeSO4 + 8H2SO4 = 2MnSO4 + 5Fe2(SO4)3 + K2SO4 + 8H2O.
Пример 12. С помощью метода электронного баланса расставьте коэффициенты в уравнении окислительно-восстановительной реакции:
Cu + HNO3 (разб) → Cu(NO3)2 + NO + H2O.
Решение:
Расставим степени окисления у всех атомов, чтобы найти атомы меняющие степень окисления.
Cu0 + H+1N+5O-23 (разб) → Cu+2(N+5O-23)2 + N+2O-2 + H+12O-2.
В приведенных соединениях изменяют степень окисления только атомы меди и азота. Азотная кислота HNO3 - типичный окислитель (азот в высшей степени окисления +5), а Cu – восстановитель (металл в виде простого вещества). Составим электронные уравнения и уравняем число отданных и принятых электронов:
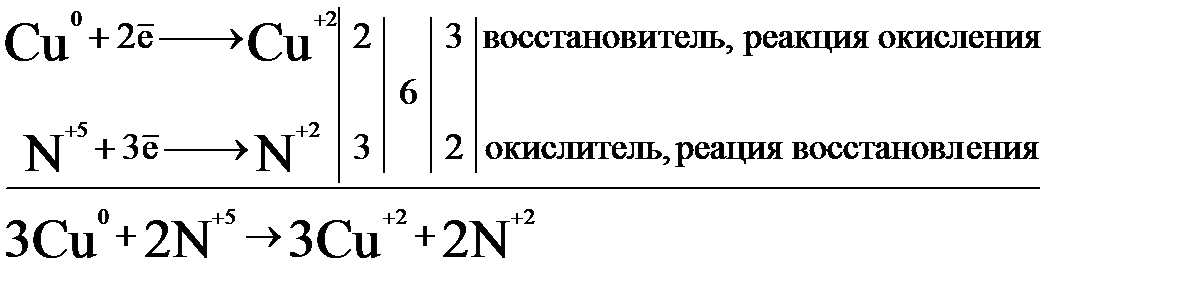
Найденные коэффициенты расставим в уравнение реакции перед окислителем и восстановителем, а затем дополнительными коэффициентами уравняем реакцию:
3Cu + 8HNO3 (разб) = 3Cu(NO3)2 + 2NO↑ + 4H2O.
Следует отметить, что в данном примере количество атомов азота в степени окисления +5 больше, чем требуется по окислительно-восстановительному балансу. Причина в том, что помимо изменившего степень окисления атома азота, в реакции часть азотной кислоты расходуется на связывание полученных ионов меди (степень окисления азота в кислотном остатке не изменяется). Поэтому коэффициент перед азотной кислотой нужно поставить только после подсчета количества атомов азота в правой части уравнения.
Пример 13. С помощью метода электронного баланса расставьте коэффициенты в уравнении окислительно-восстановительной реакции:
K2Cr2O7 + K2SO3 + H2SO4 → Cr2(SO4)3 + K2SO4 + H2O.
Решение:
Определяем степени окисления атомов элементов в их соединениях:
K+12Cr+62O-27 + K+12S+4O-23 + H+12S+6O-24 → Cr+32(S+6O-24)3 + K+12S+6O-24 + +Н+12O-2.
Составим электронный баланс:

Полученные коэффициенты необходимо расставить перед окислителем и восстановителем и продуктами окисления-восстановления в левой и правой частях уравнения. Затем дополнительными коэффициентами уравнять реакцию:
K2Cr2O7 + 3K2SO3 + 4H2SO4 = Cr2(SO4)3 + 4K2SO4 + 4H2O.
Проверяем число атомов металлов, неметаллов, водорода и в последнюю очередь кислорода (32=32) в левой и правой частях уравнения и заменяем стрелку → на знак равенства.
Метод электронного баланса применяют для составления уравнений окислительно-восстановительных реакций, протекающих как в гомогенных, так и в гетерогенных системах: в растворах и расплавах, при обжиге, горении. Но поскольку, понятие о степени окисления носит формальный характер и не отражает реального состояния вещества в растворе (например, ионы, Mn+7 и S+6 и т.д. не существуют в растворе в таком виде), то при составлении окислительно-восстановительных реакций в водных растворах используют электронно–ионный метод.
Дата добавления: 2019-04-03; просмотров: 1246;
