Примеры сложных окислительно-восстановительных реакций
а) ОВР с тремя атомами, которые меняют степень окисления
Разнообразие окислительно-восстановительных процессов не ограничивается только приведенными выше примерами. В некоторых реакциях степень окисления меняют сразу три и даже более атомов. Рассмотрим такой случай ОВР на примере взаимодействия сульфида мышьяка (III) и концентрированной азотной кислоты.
As2S3 + HNO3 (конц.) = H3AsO4 + H2SO4 + NO2 + H2O
Расставим степени окисления:
+3 -2 +1 +5 –2 +1 +5 -2 +1 +6 -2 +4 -2 +1 -2
As2S3 + HNO3 = H3AsO4 + H2SO4 + NO2 + H2O
После определения степеней окисления выявляем, что окислителем является азот в составе азотной кислоты, а восстановители – это мышьяк и сера в составе сульфида мышьяка. Следует отметить, что сульфид мышьяка – это бинарное соединение, в котором атом As+3 проявляет амфотерные свойства (атом мышьяка в степени окисления +5 обладает кислотными свойствами). Поэтому сера, как и в любом сульфиде, проявляет степень окисления –2.
Составление реакции окисления начинаем с записи сульфида мышьяка в виде молекулы, потому что это твердое вещество и неэлектролит. Продукты полуреакции также запишем в виде молекул (азотная кислота – концентрированная). В сульфиде мышьяка три атома серы и два атома мышьяка, поэтому перед серной кислотой ставим коэффициент 3, а перед ортомышьяковой кислотой – коэффициент 2. Схема полуреакции:
As2S3 → 3H2SO4 + 2H3AsO4
Количество электронов, которое отдают оба восстановителя, записывается суммарно одним числом. Одна сера отдает восемь электронов, а мышьяк – два. Общее количество электронов = 3 ∙ 8е + 2 ∙ 2е = 28е.
As2S3 – 28е → 3H2SO4 + 2H3AsO4 .
В этой схеме левая часть не содержит атомов водорода и кислорода, поэтому недостающие атомы берем из молекул воды, поскольку она является продуктом реакции:
As2S3 – 28е + 20H2O → 3H2SO4 + 2H3AsO4 + 28H+.
Полуреакция восстановления имеет следующий вид:
NO3- + 1е + 2Н+ → NO2 + H2O.
На основании двух полуреакций составим электронно-ионный баланс:
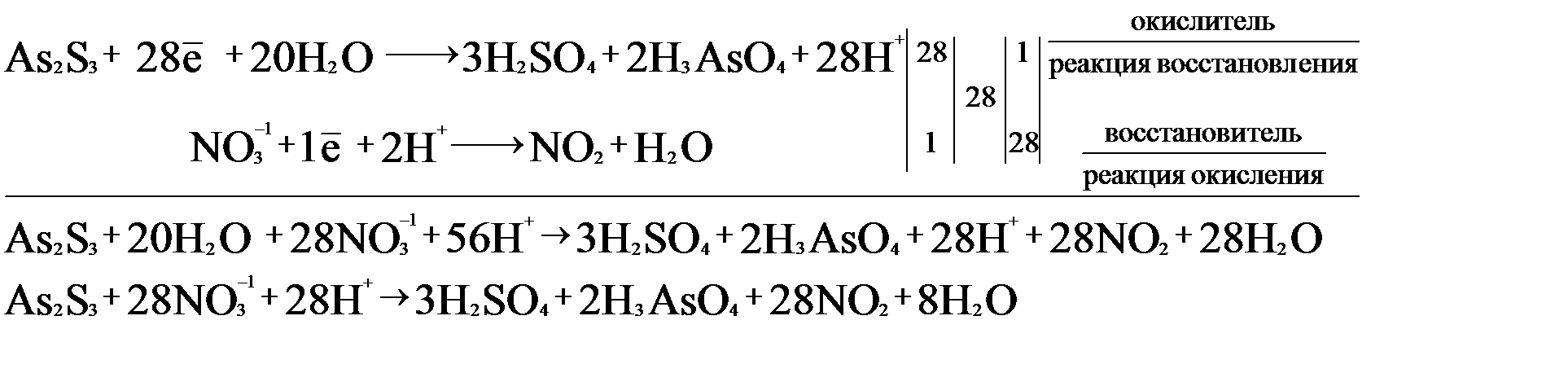
Исходя из полученного баланса, расставляем коэффициенты в уравнение:
As2S3 + 28HNO3 (конц.) = 2H3AsO4 + 3H2SO4 + 28NO2 + 8H2O
б) ОВР с неизвестным продуктами реакции
Зачастую, при выполнении домашних и контрольных заданий по теме ОВР у студентов возникают трудности по составлению неизвестной правой части уравнения реакции. Рассмотрим на примере:
Пример 18.Уравнять ОВР методом электронного баланса. Определить продукты реакции: Bi(OH)3 + Cl2 + NaOH = NaBiO3 + …
Решение:
Определяем степени окисления в исходных веществах и продуктах реакции.
+3 -2 +1 0 +1 -2 +1 +1 +5 -2
Bi(OH)3 + Cl2 + NaOH = NaBiO3 + …
Определив степени окисления известных участников реакции, можно сделать вывод, что висмут +3, является восстановителем, а хлор, следовательно, окислителем (см. п. 3.1).
Окислитель является простым веществом, полуреакция восстановления в данном случае:
Cl2 + 2e → 2Cl-.
Реакция окисления составляется с использованием молекулы гидроксида висмута, который переходит в висмутат-ион:
Bi(OH)3 – 2e → BiO3- , в щелочной среде восстановитель берет кислород из гидроксогрупп с образованием воды по следующей схеме:
Bi(OH)3 – 2e + 3OH- → BiO3- + 3H2O.
На основании двух полуреакций составим электронно-ионный баланс:
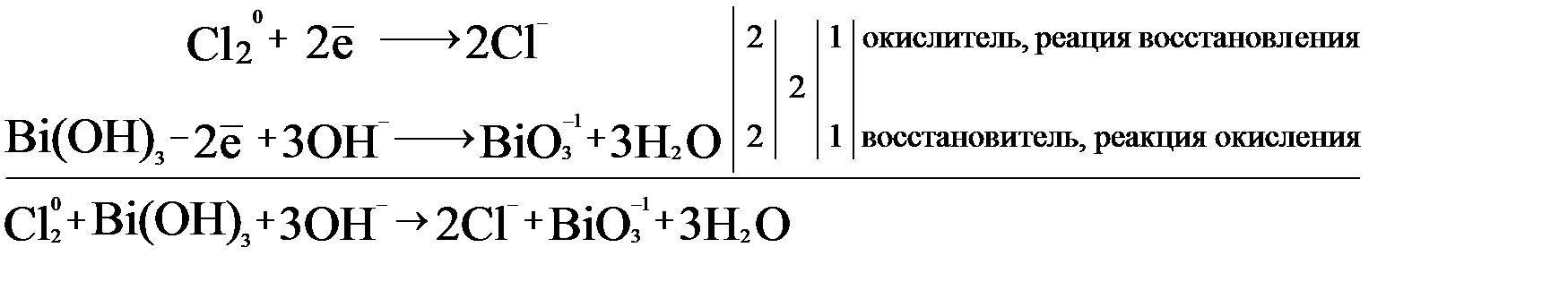
После составления баланса, можно дописать продукты реакции:
Bi(OH)3 + Cl2 + NaOH → NaBiO3 + Сl- + H2O.
Полученный в ходе реакции восстановления хлорид-ион не может существовать самостоятельно. Поэтому он присоединяет находящиеся в избытке катионы натрия. Расставляем коэффициенты в уравнение реакции.
Bi(OH)3 + Cl2 + 3NaOH = NaBiO3 + 2NaСl + 3H2O
Подсчет количества атомов в левой и правой частях уравнения дает следующие результаты: Bi: 1=1; Cl: 2=2; Na: 3=3; H: 6=6; O: 6=6.
Равенство количества атомов говорит о том, что уравнение дописано полностью, а коэффициенты расставлены правильно.
Контрольные вопросы и задания
1. Определите степени окисления атомов в окислительно-восстановительных реакциях (ОВР), составьте электронные балансы, и уравняйте реакции:
1) KMnO4 + Na2SO3 + H2O → МnО2 + Na2SO4 + KOH,
2) Mg + H2SO4(КОНЦ.) → MgSO4 + H2S + H2O,
3) KI + C12 + H2O → HCI + КIО3,
4) KI + KMnO4 + H2O → MnO2 + I2 + KOH,
5) Zn + HNO3(разб.) → Zn(NO3)2 + NH4NO3 + H2O.
2. Какие типы окислительно-восстановительных реакций существуют? Определите степени окисления атомов, с помощью электронного баланса уравняйте в ОВР и укажите тип реакции:
1) Сu(NO3)2 → CuO + NO2 + O2,
2) Cl2 + NaOH → NaCl + NaClO3 + H2O,
3) Р + НClO + H2O → Н3РO4 + HCI.
3. Какую роль в ОВР выполняют восстановители? Назовите наиболее важные восстановители.
4. Какую роль в ОВР выполняют окислители? Назовите наиболее важные окислители.
5. Что такое окислительно-восстановительная двойственность? Рассмотрите на примере сернистой кислоты:
Н2SO3 + KMnO4 + H2SO4 → МnSО4 + Н2SO4 + K2SO4 + H2O,
Н2SO3 + H2S + H2O → S↓ + H2O.
6. Из приведенных ниже веществ выберите типичные окислители. Докажите их свойства с помощью уравнения реакции.
NaI, KClO4, S, H2SO4
7. Из приведенных ниже веществ выберите типичные восстановители. Докажите их свойства с помощью уравнения реакции.
NaI, KClO4, S, H2SO4
8. Из приведенных ниже веществ выберите соединение способное проявлять окислительно-восстановительную двойственность. Докажите его свойства с помощью уравнения реакции.
NaI, KClO4, S, H2SO4
Заключение
Современная химия представляет собой разветвленную область знаний о составе и строении веществ. Познания в области физико-химических свойств простых и сложных веществ помогают в дальнейшем специалистам при разработке и внедрении технологий, сводящих к минимуму вред окружающей среде. Многие сегодняшние экологические проблемы обусловлены производством различных химических веществ и отсутствием современных методов очистки отходящих газов и промышленных вод.
Изучение свойств представителей классов неорганических соединений позволяет в дальнейшем избежать ошибок при обращении с ними. Так, известно, что нельзя воду добавлять к концентрированной серной кислоте, так как реакция протекает с выделением большого количества теплоты и возможно разбрызгивание кислоты и, как следствие, ожоги кожных покровов и что еще хуже - глаз.
Чтобы химические соединения адекватно прочитывались, химиками различных стран ведется поиск номенклатурных правил, максимально отражающих состав и свойства соединений. Химическая номенклатура складывается из формул и названий. Переход от химических формул к названиям и (наоборот) определяется системой номенклатурных правил.
Номенклатурные правила ИЮПАК по составлению названий в различных странах адаптированы к традициям национального языка, так чтобы каждое название возможно легче произносилось и записывалось. В английском варианте правил ИЮПАК названия веществ строятся «по ходу формул», например , H2S - водорода сульфид , NaCl- натрия хлорид. Однако для русского языка больше подходит французский вариант номенклатуры с «обратным» чтением формул. В названиях на первом месте, как мы видели, должно стоять название электроотрицательной составляющей в именительном падеже, а на втором – обозначение электроположительной составляющей в родительном падеже.
Для ограниченного числа распространенных кислот и их солей правила ИЮПАК рекомендуют использование традиционных названий, например, H2SO4- серная кислота, Na2SO4 - сульфат натрия. В учебном пособии более широко использованы традиционные названия основных классов неорганических соединений, что связано с необходимостью адаптации студентов I курса нехимических специальностей к вузовской программе по химии.
Дата добавления: 2019-04-03; просмотров: 17469;
