Глава 2. Окислительно-восстановительные реакции
Реакции, протекающие с изменением степени окисления одного или нескольких атомов, связанные с переходом электроновот одних атомов к другим в реагирующих веществах называются окислительно-восстановительными реакциями (ОВР).
Степень окисления – условный заряд атома, вычисленный исходя из предположения, что все связи в молекуле являются ионными. Определение степени окисления проводят, исходя из следующего:
1 Степень окисления атомов в простых веществах, принята равной нулю, например Н20 , N20 , Р40, Fe0, Zn0 .
2 Водород в соединениях с неметаллами имеет степень окисления +1; (в гидридах металлов степень окисления водорода = -1).
3 Кислород в соединениях имеет степень окисления равную -2, за исключением пероксидов, содержащих цепочку -О-О- , где степень окисления кислорода = -1, например, Н2О2 .
4 Постоянную степень окисления + 1 имеют катионы щелочных металлов (Li+, Na+, K+ и др.); степень окисления +2 имеют катионы элементов 2-ой группы (Ba2+, Ca2+ , Zn2+ , Hg2+; и др.), но ртуть иногда имеет степень окисления +1 (Hg+); степень окисления алюминия = +3.
5 Алгебраическая сумма степеней окисления атомов в молекуле равна нулю, а в сложном ионе – заряду иона.
6 Степень окисления металла в солях можно определить по кислотному остатку: например, Cu(NO3)2 , у NO3- заряд равен -1, а остатков два, общий отрицательный заряд равен -2, следовательно, Cu имеет степень окисления = +2.
Процесс отдачи электронов – окисление. Атомы или ионы, отдающие электроны, называются восстановителями, в процессе реакции они окисляются. Процесс принятия электронов - восстановление. Атомы или ионы, присоединяющие электроны, называются окислителями, в процессе реакции они восстанавливаются. Так как атомы или ионы входят в состав определенных веществ, то и вещества, соответственно, называются окислителями или восстановителями.
Окисление одного атома всегда сопровождается восстановлением другого атома, и наоборот, восстановление одного сопровождается окислением другого атома. Поэтому окислительно-восстановительные реакции представляют единство двух противоположных процессов – окисления и восстановления.
В окислительно-восстановительных реакциях число электронов, отдаваемых восстановителем, равно числу электронов, присоединяемых окислителем. Например, в реакции:
Fe + 2НCl = FeCl2 + Н2
ион Н+, принимая один электрон, изменяет степень окисления, выступая в качестве окислителя, превращается в атом Но. Атом Fe , отдавая два электрона, выступая в роли восстановителя, превращается в ион Fе2+. Форма записи следующая:
Fe - 2ē = Fe 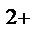 - процесс окисления, Fe - восстановитель;
- процесс окисления, Fe - восстановитель;
2Н ++ 2ē = Н2 - процесс восстановления, Н + - окислитель.
Дата добавления: 2019-04-03; просмотров: 497;
