Типы окислительно-восстановительных реакций
В зависимости от того, находятся ли атомы, выполняющие в реакции функцию окислителя и восстановителя, в одном или в различных веществах, все окислительно-восстановительные процессы можно разделить на три типа: межмолекулярные, внутримолекулярные и диспропорционирования.
1 Межмолекулярные ОВР – это такие реакции, в которых окислитель и восстановитель находятся в молекулах разных веществ. В таких реакциях окислительные функции выполняют одни вещества, а восстановительные – другие. Например:
Na+1H+1S+4О-23 + Cl20 + H+12О-2 = Na+1H+1S+6О-24 + 2H+1Cl-1
S+4 - 2ē = S+6 , реакция окисления, NaHSO3 - восстановитель
Cl20 + 2ē = 2Cl-1, реакция восстановления, Cl2 - окислитель
Электроны от восстановителя – молекулы гидрокарбоната натрия – переходят к окислителю – молекуле Cl2.
2 Реакции самоокисления-самовосстановления (диспропорционирования), в которых окислителями и восстановителями являются атомы одного и того же элемента. Эти реакции, сопровождаются одновременным увеличением и уменьшением степени окисления атомов одного и того же элемента, принадлежащего одной молекуле. Чаще всего реакции диспропорционирования протекают в щелочной, реже в нейтральной среде. Они характерны для неметаллов при их взаимодействии со щелочами (галогенов, кроме фтора, серы, фосфора и некоторых других). Например,
реакция хлора со щелочью:
Cl 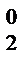 +2KOH = KCl-1+KCl+1O+H2О,
+2KOH = KCl-1+KCl+1O+H2О,
Cl0 + ē = Cl-1, один атом хлора принимает электрон - окислитель, Cl0 - ē = С1+1, другой атом хлора отдает электрон, восстановитель.
3 Реакции конмутации (контрдиспропорционирования), обратные реакциям диспропорционирования, в которых атомы одного элемента в двух разных степенях окисления принимают в продуктах реакции одинаковую степень окисления (промежуточную между исходными степенями окисления). Реакции конмутации протекают, как правило, в кислой, реже в нейтральной среде. Например:
KCl+5O3 + 6HCl-1 = KCl +3Cl20 + 3H2O,
Cl+5 + 5ē = Cl0, атом хлора Cl+5 принимает 5 электронов - окислитель,
Cl-1 - ē = С10, атом хлора Cl-1 отдает электрон, восстановитель.
4 Реакции внутримолекулярного окисления-восстановления - это такие реакции, которые протекают с изменением степеней окисления разных атомов, принадлежащих одной молекуле. Например, разложение дихромата аммония (NH4)2Cr2O7:
(N-3H4)2Cr+62O7 = N20 + Cr2+3O3 + 4H2O,
2N-3 - 6ē = N2 - атомы азота окисляются, (N-3 - восстановитель),
2Cr +6 + 6ē = 2Cr+3 - атомы хрома восстанавливаются (Cr+6 – окислитель).
Дата добавления: 2019-04-03; просмотров: 1244;
