I. Реакции замещения
1. Восстановление (замещение галогена на водород) может быть осуществлено каталитическим гидрированием или действием алюмогидридом лития LiAlH4 , боргидрид натрия NaBH4 и других восстановителей.
R–I + H–I ¾® R–H + I2
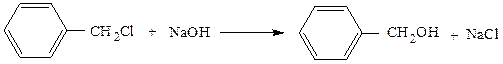
2. Гидролиз (замещение галогена на гидроксил)

Реакцию обычно проводят в щелочной среде. Равновесие полностью
сдвинуто вправо за счет связывания галогеноводорода щелочью
Геминальные дигалогенопроизводные (содержащие два атома галогена
при одном углеродном атоме) при этом образуют альдегиды или кетоны.
R–CHCl2 + 2 H2O ¾® [R–CH(OH)2] ¾¾® R–CH=O
(— H2O)
Геминальные тригалогенопроизводные гидролизуются легче, даже в
кислой среде
Cl OH
│ │
R–C– R' + 2 H2O ¾® [ R–C– R' ] ¾¾® R–C– R'
│ │ (— H2O) ║
Cl OH O
3. Реакции с алкоголятами (фенолятами) щелочных металлов (образование
простых эфиров по Вильямсону)
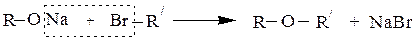
например:
СH3CH2ONa + CH3СH2CH2Cl ¾® СH3CH2 –O–СH2CH2CH3 + NaCl
этилат натрия хлористый пропил этилпропиловый эфир
С этой реакцией конкурирует реакция отщепления галогеноводорода.
4. Образование сложных эфиров. Классической реакцией является взаимо-
действие галогеналканов с серебряными солями карбоновых кислот:
CH3СH2CH2Br + CH3COOAg ¾® CH3COOCH2СH2CH3 + AgBr↓
бромистый пропил ацетат серебра пропиловый эфир
уксусной кислоты
Возможно также применение солей щелочных металлов в полярных
растворителях.
5. Образование меркаптанов и дисульфидов. Галогеналканы легко взаимо-
действуют с сульфидами и гидросульфидами щелочных металлов:
2 CH3CH2Br + K2S ¾® СH3CH2 – S –CH2CH3 + 2 KBr
диэтилсульфид
СH3CH2SNa + CH3I ¾® СH3CH2 – S – CH3 + NaI
метилэтилсульфид
(CH3)2СHCH2Br + NaHS ¾® (CH3)2СHCH2–SH + NaBr
бромистый изобутил изобутилмеркаптан
6. Взаимодействие с аммиаком и аминами.
Реакция широко используется для синтеза аминов
CH3I + NH3 ¾® CH3NH2 |+ HI
Взятый в большом избытке аммиак связывает образующийся галогено-водород ( NH3 + HI ¾® NH4I). Галогеноводород может также связываться избытком исходного амина или добавлением щелочного реагента.
CH3I + СH3CH2 –NH2 ¾® СH3CH2 –NH–CH3 • HI
йодистый метилэтиламмоний
(йодгидрат метилэтиламмония)
7. Получение нитросоединений. Галогеналканы взаимодействуют с нитритами серебра или щелочных металлов в полярных растворителях
(CH3)2СHBr + AgNO2 ¾® (CH3)2СH–NO2 + AgBr ↓
2-бромпропан 2-нитропропан
В сольватирующих растворителях (вода, спиртах) могут образовываться также нитриты R–O–N=O (эфиры азотистой кислоты).
8. Реакция с цианидами позволяет удлинить в молекуле цепочку углеродных атомов

нитрил масляной кислоты
Реакция с солями серебра дает, преимущественно изонитрилы.
9. Алкилирование ароматических соединений. Галогеналканы алкилируют бензол в присутствии хлорида алюминия (реакция Фриделя – Крафтса)
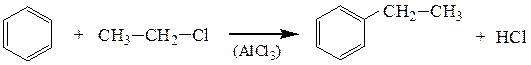
этилбензол
10. Замещение галогена галогеном (см. с. 82). Реакция применяется для получения фторидов и йодидов из более доступных хлоридов и бромидов.
Основные превращения галогенопроизводных углеводородов см. на схеме
на с. 88.
Нетрудно заметить, что во всех реакциях связь между углеродом и новым заместителем образуется за счет пары электронов, предоставленной этим заместителем, а электронная пара разрывающейся связи С–Hal уходит с анионом галогена.
При реакции происходит атака нуклеофильной частицы, поставляющей электронную пару ( ¯OH, ¯OR, ¯CN, :NH3 , Hal¯, NO2¯ и др. на атом углерода. Такие реакции называются реакциями нуклеофильного замещения SN (substitution nucleofilic).
Для реакций замещения галогена при насыщенном атоме углерода достоверны два механизма SN1 иSN2. Особенно хорошо они изучены на примере реакции гидролиза.
Дата добавления: 2017-09-19; просмотров: 2511;
