Многоядерные ароматические углеводород с конденсированными ядрами
В молекулах этих соединений бензольные ядра имеют общие углеродные атомы. Важнейшие представители - нафталин, антрацен, фенанантрен.
Нафталин.Молекула имеет плоское строение, но облако 10 p-электронов распределено в ней менее равномерно, чем в бензоле. Сравнивая длины связей в молекуле нафталина (нм) с длиной одинарных и двойных связей, видно, что они занимают промежуточное положение. Различают a-положение (1, 4, 5, 8 атомы углерода) и b-положение (2, 3, 6, 7 атомы углерода), поэтому для нафталина существуют a- и b-монопроизводные.
Нафталин – бесцветное кристаллическое вещество, tпл. = 80°С, tкип. = 218°С, летуч, обладает сильным характерным запахом. Хорошо растворим в органических растворителях. Основной промышленный способ получения – выделение из каменноугольной смолы. Большая его часть сосредоточена во фракциях среднего и тяжелого масел.
Химические свойства. Нафталин проявляет ароматический характер, но легче, чем бензол, вступает в реакции электрофильного замещения и присоединения.
I. Реакции электрофильного замещения. Заместитель направляется в a-положение, так как при этом возникает более энергетически выгодный s-комплекс, чем в b-положении, который стабилизируется перераспределением электронной плотности без нарушения ароматичности второго кольца. В b-положении такая стабилизация невозможна:

Если в одном из колец нафталина находятся электроноакцепторные заместители, дезактивирующие кольцо (ориентанты II рода), то реакции SE протекают по более активному незамещенному кольцу. Электронодонорные заместители (ориентанты I рода, кроме галогенов), напротив, активируют ароматическое кольцо, и реакция SE протекает по замещенному кольцу.
II. Гидрирование нафталина протекает легче, чем бензола. Тетралин и декалин парименяют в качестве растворителей.
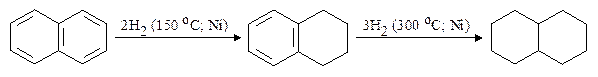
нафталин тетралин декалин
Схема 7. Химические свойства нафталина.
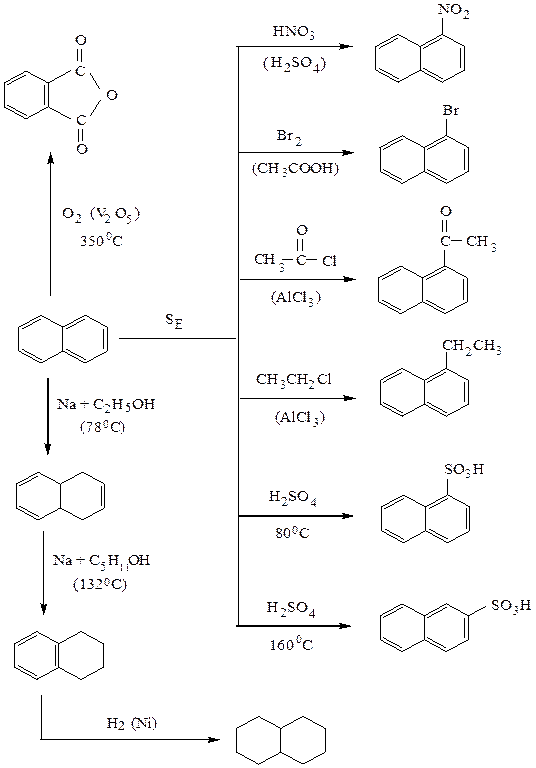
III. Окисление нафталина. При энергичном окислении нафталина (450°С; катализатор –V2O5) образуется фталевый ангидрид:
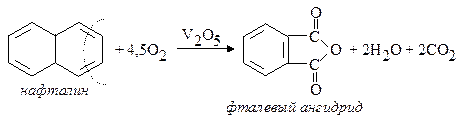
Антрацен и фенантрен имеют молекулярную формулу С14Н10 и являются изомерами по способу сочленения бензольных колец. Их молекулы имеют плоское строение. Выделяют из каменноугольной смолы.
Схема 8. Химические реакции антрацена и фенантрена
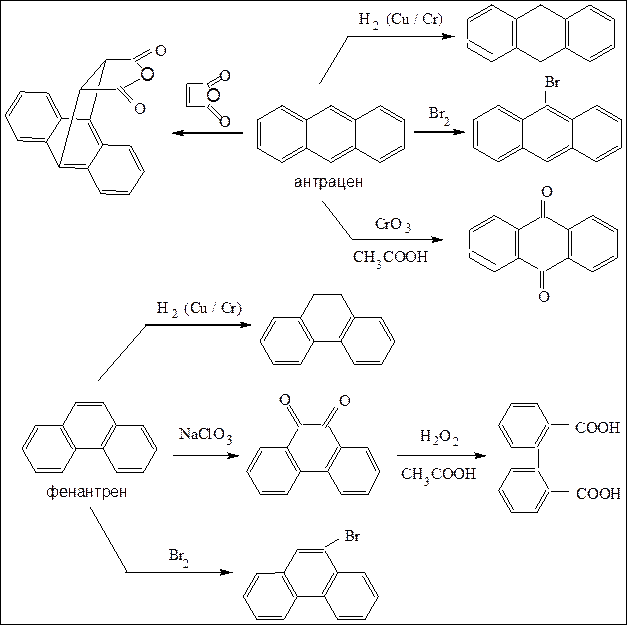
Контрольные вопросы к главе 5 «Ароматические углневодороды»
№ 1.Укажите соединения, которые проявляют ароматические свойства:
№ 2. Напишите уравнения реакций: (а) сульфирования толуола, (б) хлористого бензила с бензолом в присутствии А1С13, (в) бромирования п-ксилола на свету (1:1), (г) окисления антрацена хромовым ангидридом, (д) ацилирования толуола хлористым ацетилом в присутствии А1С13, (е) озонолиза толуола, (ж) гидрирования мезитилена (1,3,5-триметилбензола).
№ 3.Рассмотрите механизм алкилирования бензола 2-метилпропеном-1 при катализе Н3РО4 и 1-бромбутаном в присутствии А1С13. Какова роль катализатора? Почему реакционная способность алкилгалогенидов изменяется в следующем порядке: RF < RC1 < RBr < RI ?
№ 4. Рассмотрите механизм реакций нитрования этилбензола нитрующей смесью и 10%-ной HNO3 при высоких температуре и давлении (по Коновалову). Почему скорость нитрования по Se концентрированной азотной кислотой резко падает при добавлении солей азотной кислоты и увеличивается при добавлении концентрированной серной кислоты?
№ 5.В какой последовательности увеличивается количество пара-изомеров в реакциях SE (например, при сульфировании) для следующих соединений: этилбензол, третбутил-бензол, изопропилбензол, толуол?
№ 6. Расположите ароматические соединения в ряд по уменьшению реакционной способности в реакциях SE и укажите продукты реакций:
(а) нитрования бензойной кислоты, о-сульфобензойной кислоты, фенола, резорцина; (б) ацилирования хлористым пропионилом бензола, п-крезола, толуола, нитробензола; (в) сульфирования фенола, гидрохинона, нитробензола, п-нитротолуола; (г) бромирования бензола, м-ксилола, м-динитробензола, п-нитроизопропилбензола, м-толуидина.
№ 7. Для каждого из соединений укажите, какое кольцо будет затрагиваться при нитровании и приведите структурные формулы основных продуктов реакции:
№ 8.Рассмотрите химические превращения многоядерных конденсирован-ных аренов (нафталина, антрацена и фенантрена) в сравнении с бензолом.
№ 9. Предложите схемы синтеза следующих веществ:(а)м-нитротрет-бутилбензола из бензола и изобутилена; (б) a-нитроизопропилбензола из бензола и пропанола-1; (в) м-нитробензойной кислоты из толуола; (г) п-хлорбензойной кислоты из бензола и пропилена; (д)1,2-дифенилэтана из толуола; м-нитробромбензола из бензола; е) м-нитробромбензола из ацетилена; (ж 3-нитрофталевой кислоты из нафталина.
№ 10. Установите строение соединений: (а) С9Н12, при окислении KMnO4 образует в изофталевую кислоту; (б) C8H9NO2, окисление дает п-нитро-бензойную кислоту; (в) С9Н10, обесцвечивает бромную воду, при окислении хромовой смесью превращается в бензойную кислоту, а при окислении по Вагнеру (разбавленным раствором КМпО4) - в 3-фенилпропандиол-1,2;(г)С8Н6, обесцвечивает бромную воду, образует соединение с аммиачным раствором оксида серебра, при окислении превращается в бензойную кислоту;
(д) С9Н12, при монохлорировании в прис. А1С13 образуется только один изомер;
(е) C10H6NO2Br, при окислении дает 3-нитро-6-бромфталевую кислоту.
Дата добавления: 2017-09-19; просмотров: 4882;
