ГАЛОГЕНОПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ.
К галогенопроизводным относятся органические соединения, молекулы которых кроме углерода и водорода содержат только атомы галогенов. Это один из самых реакционноспособных классов органических соединений. Они находят широкое применение в синтетической органической химии.
Классификация галогенопроизводных:
1) По типу углеводородного радикала они подразделяются на алифатические,
алициклические и ароматические (алифатические и алициклические могут
быть предельными и непредельными).
2) По природе атома галогена соединения подразделяются на фтористые,
хлористые, бромистые и йодистые.
3) По числу атомов галогена различают: моно-, ди-, полигалогенпроизводные.
Номенклатура. В основе систематических и рациональных наименований лежат названия соответствующих углеводородов. Галогенопроизводные несложного строения называют по соответствующим радикалам, а также по обычным правилам рациональной номенклатуры или номенклатуры IUPAC:
(CH3)2CHСl хлористый изопропил; 2-хлорпропан
СН2I2 йодистый метилен; дихлорметан
СH3CHF2 фтористый этилиден; 1,1-дифторэтан
ClCH2CH2CH2CH2Cl хлористый тетраметилен; 1,4-дихлорбутан
С6H5CH2Cl хлористый бензил.
Полностью замещенные соединения получают приставку «пер-» :
С2F4 перфторэтилен; C6F6 перфторбензол.
Способы получения.Свободные галогенопроизводные в природе не встречаются. Они могут быть синтезированы из углеводородов уже рассмотренными способами или из других классов органических соединений.
I. Замещение водорода на галоген.
Прямое галогенирование возможно лишь для получения хлоридов и
бромидов
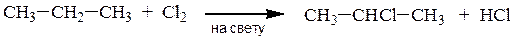
2-хлорпропан
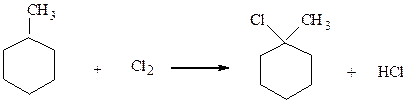
1-хлор-1-метилциклогексан
В ароматических углеводородах в зависимости от условий может
замещаться водород в бензольном кольце или в боковой цепи:
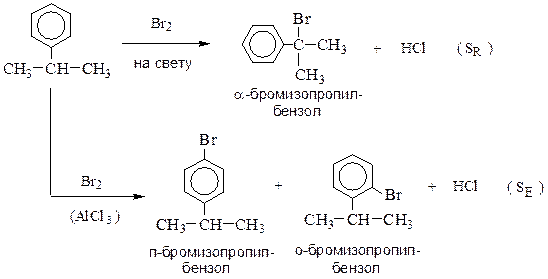
Фторирование свободным фтором обычно приводит к полному
расщеплению молекулы углеводорода
СnH2n+2 + (3n + 1) F2 ¾¾® n CF4 + (2n +2) HF
Для получения фторзамещенных используют трехфтористый кобальт,
который, разлагаясь при нагревании, медленно выделяет фтор; при этом,
как правило, образуются перфторпроизводные:
t
2 CoF3 ¾® 2 CoF2 + F2 C2H6 + CoF3 ¾® C2F6 + CoF2 + HF
Йод с насыщенными и ароматическими углеводородами не реагирует.
II. Реакции присоединения (подробно рассматривались при изучении свойств углеводородов).
1. Присоединение галогенов:
а) по двойной связи
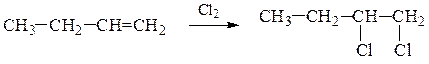
1,2-дихлорбутан
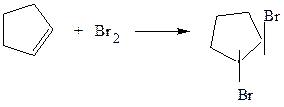
транс-1,2-дибромциклопентан
б) по тройной связи
Cl2
HC≡CH + Cl2 ¾® Cl–CH=CH–Cl ¾® Cl–CH–CH–Cl
│ │
1,2-дихлорэтен Cl Cl
1,1,2,2-тетрахлорэтан
в) к малым циклам
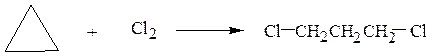
1,3-дихлорпропан
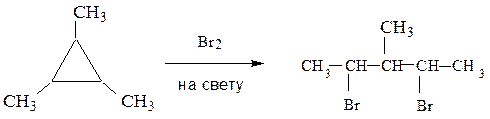
2,4-дибром-3-метилпентан
Галогенирование алкенов можно также осуществить путем замещения атома водорода в аллильном положении. Реакцию проводят при высокой температуре на свету. Реакция носит радикальный характер.
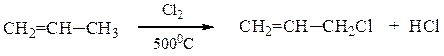
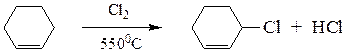
3-хлорциклогексен-1
Аллильное бромирование алкенов удобно осуществлять по методу Воля – Циглера с помощью N-бромсукцинимида:
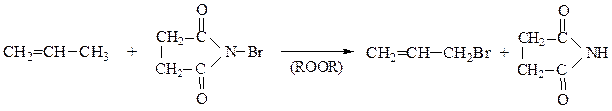
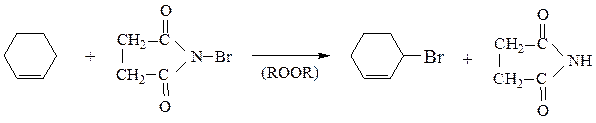
2. Присоединение галогеноводородов (НCl, HBr)
а) присоединение хлороводорода подчиняется правилу Марковникова
СН2=СН–СН3 + H–Cl ¾® CH3–CHCl–CH3
2-хлорпропан
б) в присутствии пероксидов или даже кислорода воздуха бромоводород
присоединяется против правила Марковникова.
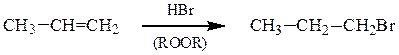
1-бромпропан
в) к циклопропану
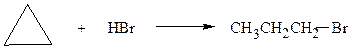
1-бромпропан
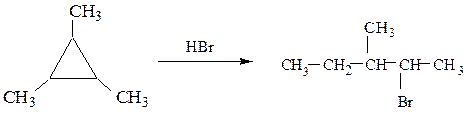
2-бром-3-метилпентан
III. Замещение гидроксильных групп на галоген.
а) Гидроксильная группа в спиртах (но не фенолах) замещается на
хлор или бром действием соответствующих галогеноводородов.
При получении галогенопроизводных по обменной обратимой реакции:
R–OH + H–X  R–X + H2O (где X = Cl или Br)
R–X + H2O (где X = Cl или Br)
галогеноводороды используют в виде концентрированных кислот или газов. Реакционная способность спиртов в этой реакции уменьшается от третичных к первичным; замещение на бром протекает легче, чем на хлор (в случае HCl обычно дополнительно используют безводный ZnCl2), причем первичные спирты (за исключением бензилового и аллилового спиртов) с хлороводородом практически не взаимодействуют. Равновесие сдвигают вправо удаляя образующуюся воду добавлением веществ, связывающих ее или азеотропной отгонкой.
СH3CH2CH2CH2–OH + HBr ¾® СH3CH2CH2CH2–Br + H2O
бутанол-1 1-бромбутан
Йодоводород в условиях реакции восстанавливает гидроксильную группу.
СH3CH2CH2CH2CH2–OH + HI ¾® СH3CH2CH2CH2CH3 + I2 + H2O
Недостатки метода: обратимость замещения, побочные реакции
б) Значительно легче реагируют спирты с галогенидами фосфора
R–OH + PCl5 ¾® R–Cl + HCl + POCl3
R–OH + PBr3 ¾® R–Br + P(OH)3
R–OH + P + I2 ¾® R–I (низкий выход) + P(OH)3
Удобным реагентом для замещения гидроксильной группы на хлор
является хлористый тионил
R–OH + SOCl2 ¾® R–Cl + HCl ↑ + SO2 ↑
например:
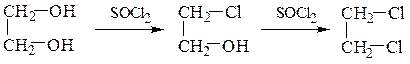
этиленгликоль 2-хлорэтанол-1 1,2-дихлорэтан
Галогениды фосфора замещают также атом кислорода карбонильной
группы в альдегидах (Rٰ = H) и кетонах на два атома галогена
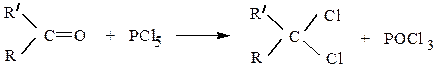
например: CH3CH2–CH=O + PCl 5 ¾® CH3CH2–CHCl2 + POCl3
пропионовый альдегид 1,1-дихлорпропан
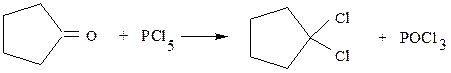
1,1-дихлорциклопентан
IV. Замещение аминогруппы на галоген.
1. В алифатических аминах осуществляется действием хлористого или
бромистого нитрозила
R–NH2 + NOBr ¾® R–Br + N2 ↑ + H2O
2. В ароматических аминах через соли диазония по реакции Зандмейера:
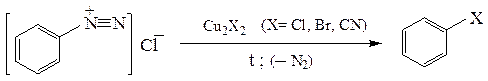
Этим методом удается получать ароматические йодиды, недоступные йодированием аренов:
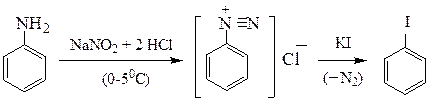
йодбензол
При термическом разложении борфторидов солей арилдиазония
получают ароматические фторпроизводные (реакция Шимана):
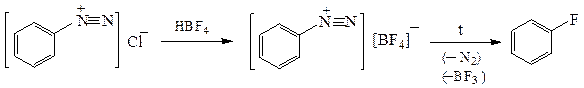
фторбензол
V. Замещение одного галогена другим.
Метод используется для получения труднодоступных фторидов и йодидов
R–Cl + AgF ¾® R–F + AgCl ↓
Равновесие сдвинуто вправо, т.к. серебряные соли более тяжелых галогенов
хуже растворимы в спирте, ацетоне и других растворителях
R–Cl + NaI ¾® R–I + NaCl ↓
Напротив, NaI гораздо лучше растворим в ацетоне, чем NaBr или NaCl.
VI. Алкилгалогениды можно синтезироватьдействием галогена насеребряные или ртутные соли карбоновых кислот (реакция Бородина-Хунсдиккера).

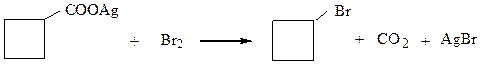
1-бромциклобутан
Физические свойствагалогенопроизводных зависят от природы, числа атомов галогена в молекуле и длины углеводородного радикала. Температура кипения, плавления и плотности фторпроизводных мало отличаются от свойств соответствующих углеводородов. Эти характеристики резко возрастают в ряду R–F → R–Сl → R–Br → R–I и с количеством атомов хлора, брома и йода.
Газообразными при комнатной температуре являются CH3F, CH2F2, CHF3, CF4, C2H5F, C3H7F, FCH2CH2F, CH3CHF2, CH3Cl, C2H5Cl (т.кип. +12 0С), CH3Br (т.кип. +3 0С). Удлинение углеводородного радикала на одну СH2-группу, в среднем, повышает температуру кипения на 30 0С (та же зависимость наблюдается в ряду алканов). Плотность же галогеналканов при этом снижается. Монофтор- и монохлорзамещенные легче воды, бромиды и йодиды
тяжелее (CH3I 2,3 г/cм3; CH2I2 3,3 г/cм3; CHI3 4,0 г/cм3; CI4 4,3 г/cм3; последниедва вещества представляют собой кристаллические соединения;
йодистый метилен – самая тяжелая органическая жидкость). Все галогено-производные легко растворимы друг в друге, в углеводородах, эфирах; не растворяются в воде. Хлориды широко применяются в качестве растворителей. Низшие галогенопроизводные обладают сладковатым запахом и наркотическим действием. Хлористый этил применяется для местного обезболевания. Не огнеопасны. Полигалогениды, например четыреххлористый углерод, благодаря большой летучести и высокой плотности паров можно использовать для тушения пожаров. Большинство галогенопроизводных токсичны, хлориды применяются в качестве инсектицидов, перфторпроизводные – безвредны. Легкие фториды – фреоны, например фреон 12 (CF2Cl2) используются в качестве хладоагентов, они не оказывают вредного действия при контакте с пищевыми продуктами. Испытывался в качестве заменителя крови перфтор-1-метилдекалин. Он хорошо растворяет кислород и углекислый газ (даже лучше, чем кровь), не поражает кроветворные органы, выводится через легкие.
Перфторполимеры, например, перфторполиэтилен (тефлон) химически очень инертны, устойчивы в любых агрессивных средах. Весьма ценными свойствами обладают фторкаучуки, однако стоимость их очень высока.
Дата добавления: 2017-09-19; просмотров: 5065;
