Окисление углеводородов.
а) окисление алкенов по двойной связи действием сильных окислителей (перманганат калия, хромовая смесь) при нагревании:
KMnO4
R–CH=CH–R' ¾¾® R–COOH + R'–COOH
б) окисление боковых цепей ароматических углеводородов под влиянием сильных окислителей (перманганат калия, хромовая смесь) при нагревании с получением ароматических кислот:
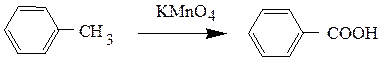
Окисление первичных спиртов дихроматом или перманганатом калия в кислой среде через стадию образования альдегидов до карбоновых кислот по схеме:
3 R–CH2OH + K2Cr2O7 + 4 H2SO4 ¾® 3 R–CHO + K2SO4 + Cr2 (SO4)3 +7 H2O
Окисление альдегидов и кетонов:
а) действие слабых окислителей, например аммиаката серебра (реактив Толленса) на альдегиды (реакция серебряного зеркала):
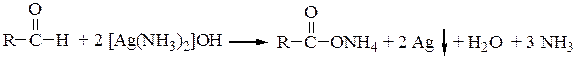
или комплексной соли (жидкость Фелинга), полученной растворением гидроксида меди (II) в растворе сегнетовой соли, на альдегиды:
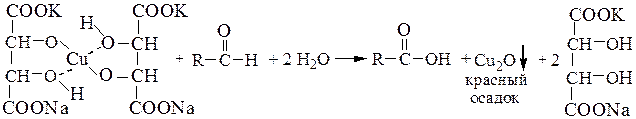
Кетоны при данных условиях не окисляются, поэтому реакции используются для определения отличий альдегидов от кетонов.
б) окисление кетонов в жестких условиях. При расщеплении кетонов образуется смесь карбоновых кислот по схеме (правило Попова):
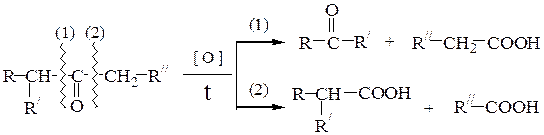
Окисление метилкетонов (галоформная реакция):
Галогенирование метилкетонов в щелочной среде (или действие гипогалогенидов натрия) с расщеплением молекулы и образованием галоформов и натриевых солей карбоновых кислот по схеме:
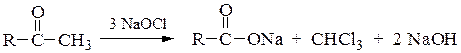
Дата добавления: 2017-09-19; просмотров: 1081;
