Химические свойства
Строение и реакционная способность карбоксильной группыРеакционная способность карбоновых кислот обуславливается присутствием в их молекулах карбоксильной группы, в которой имеются полярные ковалентные связи: между углеродным и кислородным атомами (С=О, С-О) и связь О-Н. При этом связь С=О длиннее (0,124 нм), чем в кетонах (0,122), а связь С=О короче (0,131 нм), чем в спиртах (0,144 нм). Эти изменения длин связей обусловлены взаимодействием неподеленной пары кислородного атома группы - ОН с π- электронами карбонильной группы, т.е. электродонорным эффектом сопряжения (+М). В результате увеличивается полярность связи О-Н и снижается частичный положительный заряд δ+ на карбонильном углеродном атоме, по сравнению с альдегидами и кетонами. Отсюда и С-Н кислотный центр является более слабым, чем аналогичный центр в альдегидах и кетонах:
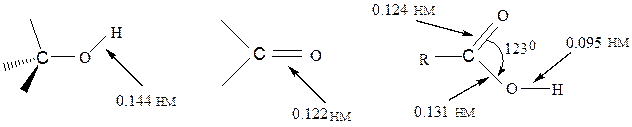
спирт кетон карбоновая кислота
Таким образом, электронное строение кислот характеризуется взаимным влиянием углеводородного радикала, гидроксильной, карбонильной групп. Реакционная способность карбоновых кислот взаимосвязана с реакционными центрами:
· кислотным на связи О-Н;
· протоноакцепторным на атоме О;
· электрофильным, при участии которого кислоты вступают в реакции нуклеофильного замещения образования функциональных производных кислот;
· замещающим Н-водорода у α-углеродного атома за счет отрицательного индуктивного эффекта карбоксильной группы;
· диссоциативным по связи -СООН (реакции декарбоксилирования).
Реакции карбоновых кислот подразделяются на:
· реакции, указывающие на кислотность;
· реакции нуклеофильного замещения у ацильного атома углерода;
· реакции декарбоксилирования;
· реакции замещения при α-углеродном атоме карбоновых кислот;
· восстановление карбоновых кислот.
Кислотные свойства. Образование солей.Кислотные свойства карбоновых кислот и способность их к диссоциации обусловлены тем, что в группе -СООН электронная плотность связи О-Н понижена за счет перемещения электронов на соседнюю связь С-О под влиянием частично положительного заряда карбонильного атома углерода:
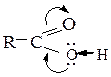
При этом облегчается разрыв связи О-Н и происходит диссоциация кислоты:
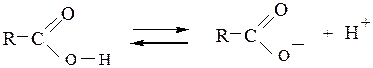 .
.
В образующемся карбоксилат-анионе наблюдается делокализация заряда, приводящая к его равномерному распределению между двумя атомами кислорода и выравниванию длин связей между атомами С и О:
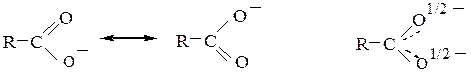
За счет делокализации заряда снижается энергия, поэтому образование карбоксилат-аниона энергетически выгодно, что является второй причиной, облегчающей диссоциацию карбоновых кислот.
Кислотность соединений количественно выражается через константу диссоциации Ка (или через рКа = - lgKa):
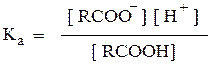
Сила кислот зависит от электронного влияния радикала на карбоксил. При наличии в радикале электронодонорных заместителей электронная плотность на О-Н повышается и кислотные свойства ослабевают. Напротив, введение электроноакцепторных заместителей способствует дополнительной поляриза-ции связи О-Н и вызывает усиление степени диссоциации кислот. С удалением заместителя от СООН влияние его на степень диссоциации резко уменьшается.
Например,сила кислот увеличивается в следующих рядах: уксусная < монохлоруксусная < дихлоруксусная < трихлоруксусная кислоты; масляная < γ-броммасляная < β-броммасляная < α-броммасляная кислоты; п-толуиловая < бензойная < п-нитробензойная < 2,4-динитробензойная кислоты.
В результате реакций обмена при взаимодействии с металлами, стоящими в ряду напряжений слева до водорода, оксидами основного характера, щелочами и солями металлов карбоновые кислоты образуют соли:
CН3СООН + Na ¾® CН3СООNa + Н2 ↑
(ледяная)
2 CН3СООН + Са ¾® (CН3СОО)2Са + Н2 ↑
(ледяная)
CН3СООН + Na2О ¾® CН3СООNa + Н2О
(ледяная)
CН3СООН + NaОН ¾® CН3СООNa + Н2О
2 CН3СООН + Na2СО3 ¾® 2 CН3СООNa + Н2О + СО2 ↑
CН3СООН + NaНСО3 ¾® CН3СООNa + Н2О + СО2 ↑
Соли карбоновых кислот называют, перечисляя в родительном падеже название аниона кислоты и катиона. Название анионов образуют заменой суффикса «-ил» в названии ацильного радикала на «-ат». Анион, полученный из названия кислоты с суффиксом «-карбоновая кислота», обозначают названием углеводорода, выполняющего роль радикала с добавлением суффикса «-карбоксилат».
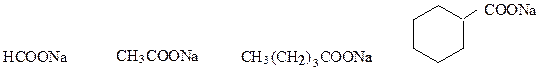
метаноат натрия этаноат натрия пентаноат натрия циклогексанкарбоксилат
(формиат натрия) (ацетат натрия) натрия
Реакции нуклеофильного замещения.В реакциях нуклеофильного замещения гидроксильная группа карбоновой кислоты замещается на другой нуклеофил с образованием функциональных производных карбоновых кислот.
Таблица 15.Функциональные производные карбоновых кислот
| Название производных | Структурная формула |
| Галогенангидриды | 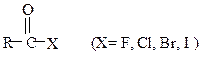
|
| Простые ангидриды | 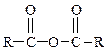
|
| Смешанные ангидриды | 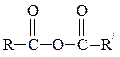
|
| Сложные эфиры | 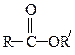
|
| Амиды (первичные, вторичные, третичные) | 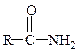 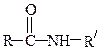 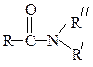
|
| Нитрилы | 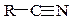
|
| Соли | 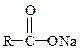
|
Реакции носят название реакций ацилирования, так как в состав молекулы вводится группа R-СО-.
Образование галогенангидридов. При обработке карбоновых кислот галогенидами фосфора или тионилхлоридом образуются галогенангидриды:
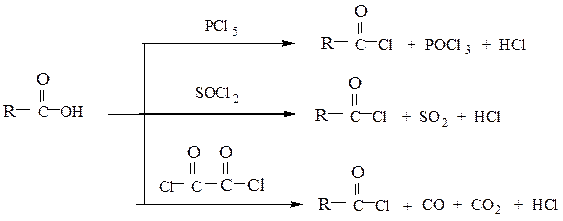
Ниже приводится механизм реакции получения хлорангидрида действием тионилхлорида SOCl2 на карбоновую кислоту:
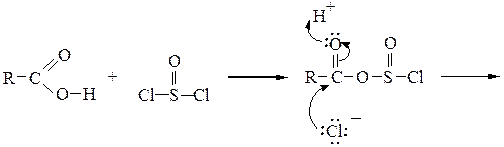
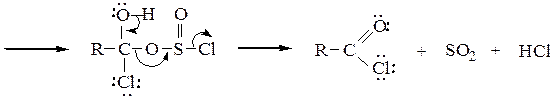
Образование ангидридов кислот.Под действием водоотнимающих реагентов при нагревании карбоновые кислоты претерпевают межмолекулярную дегидратацию с образованием симметричных ангидридов:
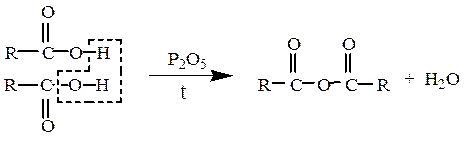
Так, нагревание пропионовой кислоты с оксидом фосфора (V) приводит к образованию пропионового ангидрида:
Образование сложных эфиров.Взаимодействие карбоновой кислоты со спиртом называется реакцией этерификации. Реакция представляет собой обратимый процесс и осуществляется обычно в присутствии H2SO4:

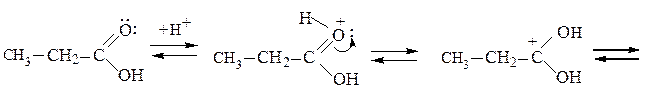
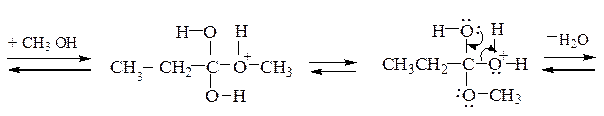
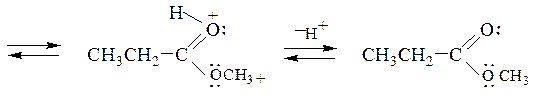
Повышение выхода эфира достигается сдвигом равновесия вправо удалением образующейся воды, добавлением связывающих веществ, либо азеотропной отгонкой с бензолом или толуолом. Скорость этерификации зависит от природы кислоты, спирта и пространственных факторов. Более высокий выход получают при использовании первичных спиртов. Труднее всего в реакцию вступают третичные спирты, α-замещенные алифатические и орто-замещенные ароматические кислоты.
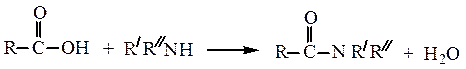
Образование амидов.Карбоновые кислоты реагируют с аммиаком, первичными и вторичными аминами:

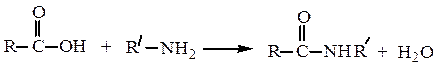
Дата добавления: 2017-09-19; просмотров: 1017;
