II. Характерные свойства кислот
ХИМИЧЕСКИЕ СВОЙСТВА АЗОТИСТОЙ КИСЛОТЫ
I. Разлагаетсяпри нагревании и в момент образования
HNO2 → NO + NO2 + H2O
HNO2 →← HNO3 + NO + H2O в присутствии сильных кислот
II. Окислительные свойствавыражены сильнее, чем восстановительные
Так как азот находится в промежуточной степени окисления, то является и окислителем, и восстановителем
HNO2 + KJ + H2SO4 → NO↑ + J2 + K2SO4 + H2O
При действии сильных окислителей может восстанавливаться до N2O, N2, NH2OH, NH3
III. Восстановительные свойства
HNO2 + KMnO4 + H2SO4 → HNO3 + MnSO4 + K2SO4 + H2O
Соли азотистой кислоты – НИТРИТЫ Me(NO2)X
Это бесцветные кристаллические вещества. Более устойчивы, чем HNO2. Нитриты щелочных металлов плавятся без разложения. Нитриты менее активных металлов разлагаются:
Zn(NO2)2 t→ ZnO + N2O3
ПОЛУЧЕНИЕ НИТРИТОВ
Взаимодействием щелочей с оксидом азота(III)
NaOH + N2O3 → NaNO2 + H2O
Восстановлением нитратов
NaNO3 + Pb → NaNO2 + PbO
АЗОТНАЯ КИСЛОТА HNO3
Строение молекулы
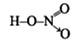
В молекуле кислоты азот находится в степени окисления +5, но валентность проявляет IV. Связь, обозначенная стрелочкой, образуется за счет неподеленной электронной пары азота и пустой орбитали кислорода, которая образуется при переходе его в возбужденное состояние.
ФИЗИЧЕСКИЕ СВОЙСТВА АЗОТНОЙ КИСЛОТЫ
HNO3 – бесцветная жидкость, дымящая на воздухе. Из-за присутствия NO2, который образуется при ее разложении, часто имеет желтоватый оттенок. Смешивается с водой в любых соотношениях.
tпл = -41 °С, tкип = 83 °С.
ХИМИЧЕСКИЕ СВОЙСТВА АЗОТНОЙ КИСЛОТЫ
I. Разлагаетсяна свету и при нагревании. Ее раствор буреет при длительном стоянии
HNO3 →← NO2 + H2O + O2 чем больше температура и концентрация, тем сильнее кислота разлагается
II. Характерные свойства кислот
1) Диссоциирует. HNO3 – одна из наиболее сильных кислот
HNO3 →← 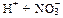
Дата добавления: 2019-07-26; просмотров: 826;
