ХИМИЧЕСКИЕ СВОЙСТВА ФОСФОРА
Фосфор более активен, чем азот N2, так как атомы в структуре P4 связаны одинарными связями, а в молекуле азота атомы связаны тройной связью 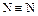 .
.
1) Взаимодействует с металлами при повышенной температурес образованием фосфидов
Mg + P t→ Mg3P2 фосфид магния
Взаимодействует с кислородом
P + O2(недостаток) → P2O3
P + O2(избыток) → P2O5
С водородом НЕ взаимодействует!
Взаимодействует с серой
P + S → P2S3 сульфид фосфора(III)
Взаимодействует с галогенами
P + Cl2(недостаток) → PCl3 хлорид фосфора(III)
P + Cl2(избыток) → PCl5 хлорид фосфора(V)
Галогениды фосфора легко гидролизуются:
PCl3 + Н2O → H3PO3 + HCl
PBr5 + Н2O t→ H3PO4 + HBr
6) Взаимодействует с водойпри нагревании и в присутствии катализатора
P + Н2O Cu→ H3PO4 + H2 катализатор – медный порошок, температура 700 °С
Взаимодействует с кислотами-окислителями
P + HNO3(конц) → H3PO4 + NO2 + H2O
P + HNO3(разб) → H3PO4+ NO
P + H2SO4(конц) → H3PO4 + SO2 + H2O
C другими кислотами НЕ реагирует
Со щелочами диспропорционирует
P + Ba(OH)2 + H2O t→ PH3 + Ba(H2PO2)2 гипофосфит бария
ПОЛУЧЕНИЕ ФОСФОРА
Прокаливанием фосфорита с песком и углем в электропечи
Ca3(PO4)2 + SiO2 + C t→ CaSiO3 + CO + P
Пары фосфора затем конденсируются под водой
ФОСФИН PН3
ФИЗИЧЕСКИЕ СВОЙСТВА ФОСФИНА
РН3 – бесцветный газ с запахом гнилой рыбы. tкип = -88 °С, tпл = -133 °С. Довольно хорошо растворим в воде, но хуже, чем аммиак NH3. ОЧЕНЬ ЯДОВИТ! Летальный исход наступает после получасового пребывания в атмосфере с концентрацией PH3 0,05 мг/л.
ХИМИЧЕСКИЕ СВОЙСТВА ФОСФИНА
Самовоспламеняется на воздухе со свечением
PH3 + O2 → P2O5 + H2O → H3PO4
Чистый фосфин загорается на воздухе только при 150 °С, но обычно в качестве примеси он содержит следы более активного дифосфина (P2H4) и поэтому самовоспламеняется на воздухе при комнатной температуре.
2) Взаимодействует с очень сильными кислотамиподобно аммиаку
PH3 + HJ → PH4J йодид фосфония
3) Является очень сильным восстановителем.Окисляется обычно до H3PO4
PH3 + KMnO4 + H2SO4 → H3PO4 + MnSO4 + K2SO4 + H2O
ПОЛУЧЕНИЕ ФОСФИНА
Гидролиз фосфидов
Mg3P2 + HOH → PH3↑ + Mg(OH)2
Действием кислот на фосфиды
Mg3P2 + HCl → PH3↑ + MgCl2
Дата добавления: 2019-07-26; просмотров: 628;
