II. Нуклеофильное присоединение (AN)) по α-углеродному атому.
Альдольная и кротоновая конденсации карбонильных соединений протекает под действием щелочного катализатора по следующей схеме:
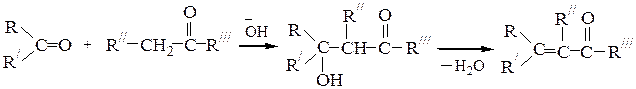 карбонильный метиленовый b-оксикарбонильное a,b-непредельное
карбонильный метиленовый b-оксикарбонильное a,b-непредельное
компонент компонент соединение (продукт соединение (про-
альдольной конденсации) дукт кротоновой
конденсации)
В реакцию могут вступать альдегиды и кетоны, содержащие атом Н при a-С-атоме, либо два различных карбонильных соединения, причем одно из них должно иметь СН2-группу. В последнем случае протекают четыре конкурирующих процесса данной схемы. Реагирует каждое карбонильное соединение само по себе плюс два варианта участия в конденсации различных молекул, причем будет преобладать направление реакции, соответствующее участию более реакционного вещества из пары в качестве карбонильной компоненты согласно ряду: формальдегид – алифатический альдегид – ароматический альдегид – алифатический кетон – жирноароматический кетон.
Механизм реакции под действием щелочного катализатора:
1-я стадия: образование a-карбаниона, стабилизированного cопряжением с енолят-анионом (протекает под действием ОН-):
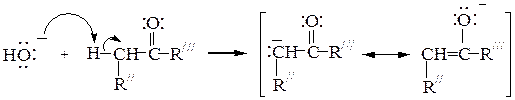
2-я стадия: образование алкоксид-аниона путем атаки карбонильного углеродного атома нуклеофилом (a-карбанионом):
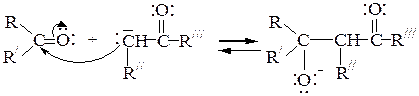
3-я стадия: присоединение протона алкоксид-анионом из воды (регенерация ОН-); при этом образуется b-оксикарбонильное соединение - продукт альдольной конденсации:
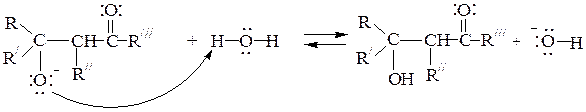
4-я стадия: при нагревании под влиянием щелочного катализатора может происходить дегидратация альдоля с образованием a,b-непредель-ного карбонильного соединения, у которого двойная связь сопряжена с карбонильной группой (продукта кротоновой конденсации):
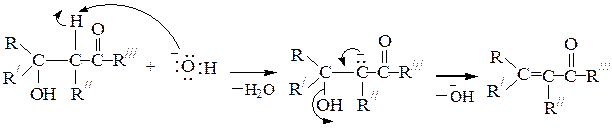
Ниже приведены два примера перекрестных конденсаций с участием молекул двух различных карбонильных соединений:
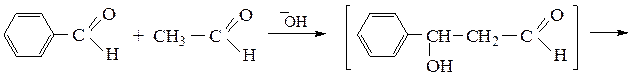
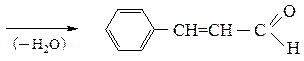
коричный альдегид
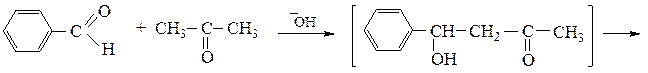
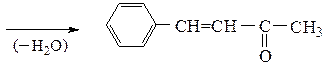
бензальацетон
Альдольные и кротоновые конденсации также можно осуществить в условиях кислотного катализа. В отличие от щелочной среды, в которой происходит активация метиленовой компоненты, в кислой среде катализатор активирует карбонильную компоненту; кроме того, в кислой среде метиленовая компонента превращается в енол:
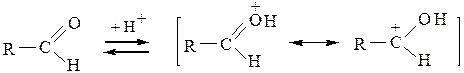
активированная карбонильная компонента
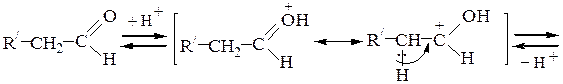
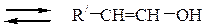 енольная форма метиленовой компоненты
енольная форма метиленовой компоненты
Протонирование карбонильной группы облегчает отрыв протона от a-углеродного атома. Активированная карбонильная компонента (I) реагирует с енольной формой метиленовой компоненты (II):
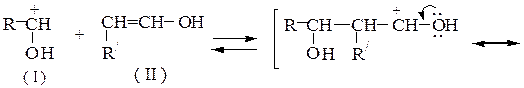
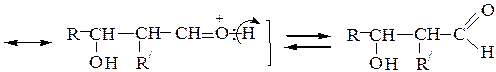
альдоль (III )
В реакциях конденсации, катализируемых кислотами, альдоли обычно легко теряют воду, превращаясь в a,b-непредельные альдегиды - продукты кротоновой конденсации:
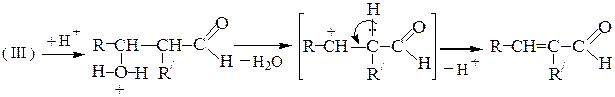
Перкина реакция - получение b-замещенных производных акриловой кислоты конденсацией ароматических альдегидов с ангидридами карбоновых кислот в присутствии оснований.
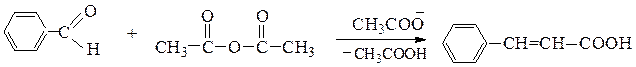
Реакция осуществляется по следующему механизму:
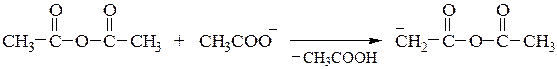
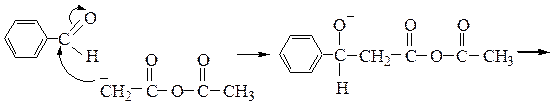
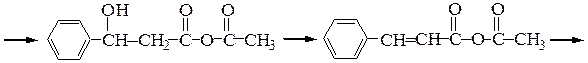
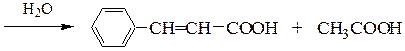
Кневенагеля конденсация – реакция карбонильных соединений в присутствии оснований (триметиламина, пиридин и др.) с веществами, содержащими активные метиленовые группы (которые соседствуют с двумя электроноакцепторными заместителями) с образованием производных этилена:
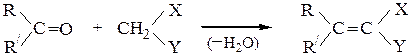
где X и Y = –СN, –COR, –СOOR, –NO2 и др.
В реакцию вступают алифатические, ароматические и гетероциклические альдегиды. Кетоны реагируют труднее. Метиленовой компонентой реакции чаще всего служат малоновая кислота и ее производные, ацетоуксусный , нитро- и циануксусный эфиры. Главным направлением использования реакции является синтез α,β-непредельных кислот, например:
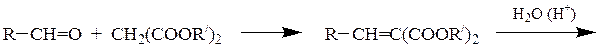
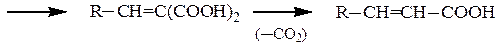
При использовании сильных оснований в качестве катализаторов (тв. КОН, NaNH2, C2H5ONa) карбонильные соединения также вступают в реакцию с углеводородами, обладающими СН-кислотностью – циклопентадиеном и монозамещенными ацетиленами.
Окисление
а) Альдегиды, даже при действии слабых окислителей (реакция серебряного зеркала, реакция Фелинга) легко превращаются в карбоновые кислоты:
CH3CHO + 2 [Ag(NH3)2]OH ¾® CH3COONH4 + 3 NH3 + H2O + 2 Ag ↓
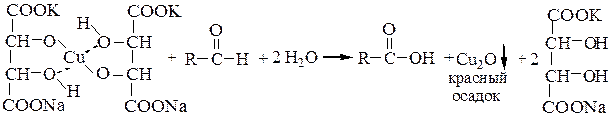
Поскольку кетоны в мягких условиях не окисляются, то эти реакции удобно использовать для отличия альдегидов и кетонов
б) Ароматические альдегиды легко окисляются кислородом воздуха на свету. (Для алифатических альдегидов это нехарактерно). Легкое окисление объясняется образованием стабильного ароильного радикала:
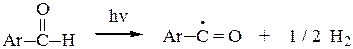
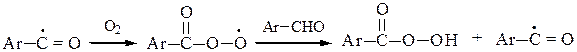
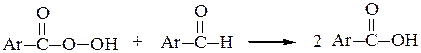
в) Окисление кетонов протекает только в жестких условиях. А.П.Попов установил, что С-С-связь при окислении кетонов расщепляется по двум направлениям рядом с карбонильной группой; в результате реакции получаются карбоновые кислоты и кетоны:
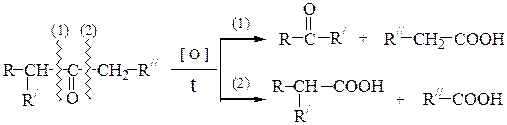
Oкислению кетона предшествует его енолизация, которая может проходить как в щелочной, так и в кислой среде:
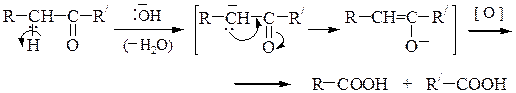
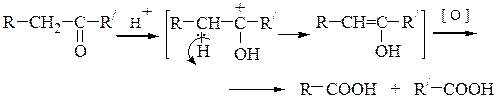
Несимметричные кетоны могут переходить в енольную форму по двум направлениям, что приводит к образованию четырех продуктов.
г) Практическое значение имеет окисление циклических кетонов, которые дают дикарбоновые кислоты, применяемые в производстве поликонденса-ционных полимеров:
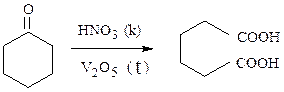
д) Кетоны в результате обработки пероксидом водорода или надкислотами
могут окисляться до сложных эфиров (окисление по Байеру-Виллигеру):
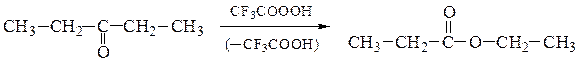
Циклические кетоны образуют лактоны:
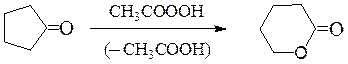
Восстановление.
а) Восстановление альдегидов приводит к получению первичных спиртов, кетонов – вторичных спиртов. Восстановление осуществляют каталитическим гидрированием или действием комплексных гидридов металлов – алюмогидридом лития (LiAlH4) или боргидридом натрия (NaBH4):
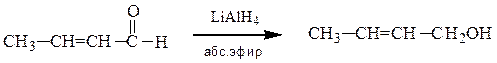
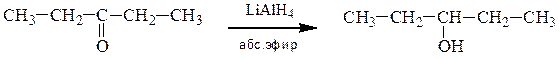
Боргидрид натрия значительно менее активен, но более избирателен. Его применяют для селективного восстановления карбонильной группы альдегидов и кетонов в тех случаях, когда вещества также содержат другие группы (например, –NO2, –CN, –COOR, –CONH2), которые можно восстановить действием более сильных восстановителей.
NaBH4
O2N–СН2СН2СН2СН2 –СНО ¾¾¾® O2N–СН2СН2СН2СН2 –СН2ОH
б) Карбонильную группу можно восстановить до метиленовой при действии амальгамы цинка и соляной кислоты (восстановление по Клеменсену):
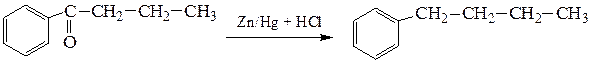
Образование углеводородов также наблюдается при нагревании гидразонов карбонильных соединений в присутствии основных катализаторов (восстановление по Кижнеру-Вольфу):
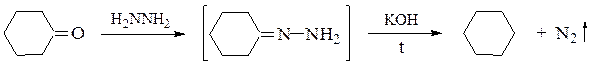
в) Отличительной чертой альдегидов является их способность к реакциям окислительно-восстановительного диспропорционирования, когда одна молекула альдегида окисляется, а другая – восстанавливается. Примерами таких реакций служат реакции Канниццаро и Тищенко.
Альдегиды, не содержащие при α-углеродном атоме водорода в присутствии щелочей в результате реакции Канниццаро образуют первичный спирт (продукт восстановления) и анион карбоновой кислоты (продукт окисления):
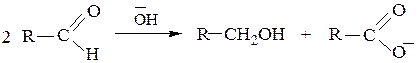
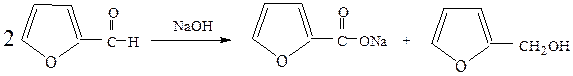
В случае, если в реакции Канниццаро участвует смесь двух альдегидов, то образуется набор всевозможных продуктов. Однако, если одним из альдегидов будет формальдегид, то образуется почти исключительно формиат натрия и спирт, соответствующий восстановлению другого альдегида. Повышенная склонность формальдегида к окислению делает подобную перекрестную реакцию Канниццаро удобным методом синтеза первичных ароматических спиртов:
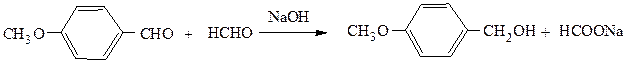
г) Под действием алкоголята натрия альдегид претерпевает конденсацию альдольно-кротонового типа, а присутствие алкоголятов алюминия (имеющих значительно меньшую основность) приводит реакции Тищенко
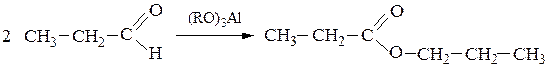
Образуется сложный эфир, который является производным кислоты (продукта окисления) и спирта (продукта восстановления).
Взаимодействие алюминия с кислородным атомом альдегида значительно увеличивает электрофильность карбонильного атома углерода, что облегчает конденсацию, перенос гидридного иона:
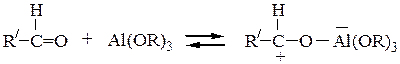
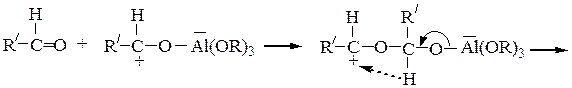
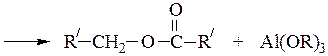
Галогенирование.
Альдегиды и кетоны легко галогенируются по α-углеродному атому:

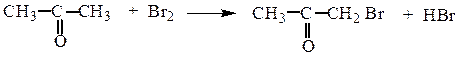
Направленность галогенирования объясняется тем, что она идет через образование енольной формы. При действии избытком галогена возможно замещение всех α-атомов водорода, причем последующие стадии галогенирования идут с возрастающей скоростью, т.к. атомы галогена, являясь акцепторами, еще более увеличивают подвижность α-атомов водорода. После исчерпывающего галогенирования метильной группы в сильно щелочной среде метилкетоны расщепляются с образованием галоформа СНХ3.
В случае ацетона механизм галоформной реакции выглядит следующим образом:
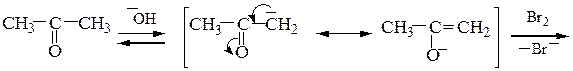
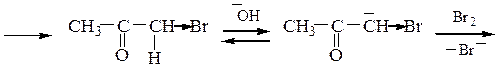
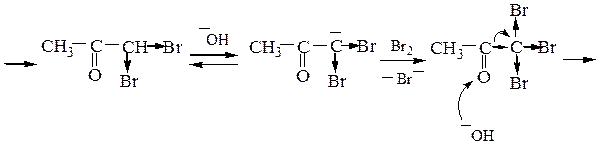
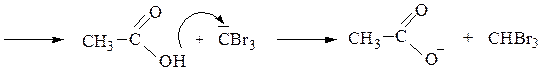
Ацетальдегид и метилкетоны дают качественную реакцию – образуют желтый осадок иодоформа с иодом и раствором NaOH:
CH3CHO + 4 NaOH + 3 I2 ® HCOONa + CHI3 ¯ + 3 H2O + 3 NaI
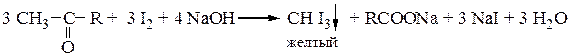
Этой пробой можно отличать карбонильные соединения, содержащие метильный радикал, от остальных карбонильных соединений.
Дата добавления: 2017-09-19; просмотров: 1539;
