ОКИСИ АЛКЕНОВ (ОКСИРАНЫ, ЭПОКСИДЫ)
Определение.Соединения, содержащие атом кислорода в трехчленном цикле.
Способы получения. Получают окислением алкенов кислородом на серебряном катализаторе (400 ºС) или надкислотами (реакция Прилежаева), а также дегидрогалогенированием галогенгидринов спиртовым раствором КОН.
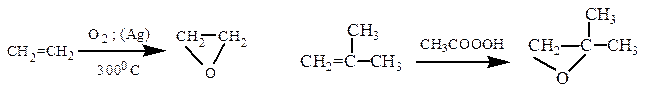
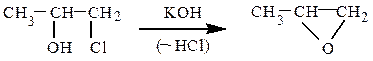
В настоящее время окись этилена в промышленности получают окислением этилена над серебряным катализатором (375 0С).
Химические свойства.В отличие от простых эфиров α-окиси алкенов отличаются высокой реакционной способностью. Ввиду сильного напряжения в трехчленном цикле, реакции проходят обычно с его раскрытием. Полярность связи Сδ+– Оδ- обуславливает возможность атаки нуклеофилом по углеродному атому и протоном по кислородному атому. Суммарно реакции протекают как присоединение реагента, содержащего нуклеофильную частицу.
Схема 11. Основные реакции окиси этилена:
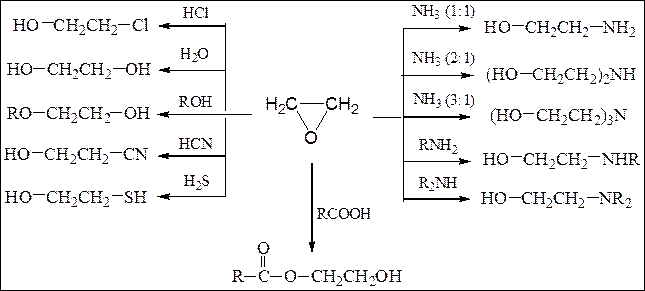
При взаимодействии эпоксиэтана (окиси этилена) со спиртами образуются моно- и диэфиры этиленгликоля и диэтиленгликоля, которые находят широкое применение в качестве высококипящих растворителей, незамерзающих охлаждающих смесей для автомобилей (антифризов). Целлозольвы – моноэфиры этиленгликоля, карбитолы – моноэфиры диэтиленгликоля, диглимы – диэфиры диэтиленгликоля.
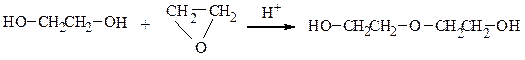
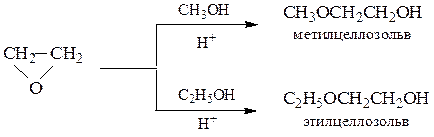
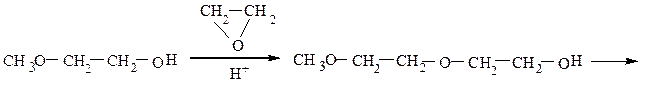 метилцеллозольв метилкарбитол
метилцеллозольв метилкарбитол
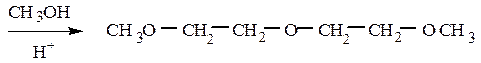
диметилдиглим
С фенолами окись этилена образует фениловые эфиры этиленгликоля:
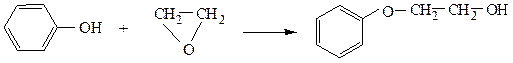
2-феноксиэтанол
С продуктом алкилирования фенола диизобутиленом получают неонол (ПАВ):

Галогенгидрины, являющиеся продуктами взаимодействия окиси этилена с галогеноводородами применяются в качестве растворителей эфиров целлюлозы и как β-оксиэтилирующие реагенты.
Продукт взаимодействия окиси этилена с триметиламином – холин в результате ацилирования превращается в ацетилхолин, обладающий высокой физиологической активностью (резко понижает кровяное давление, усиливает перистальтику кишечника):
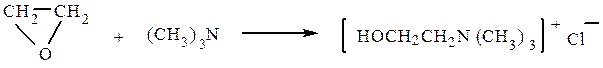
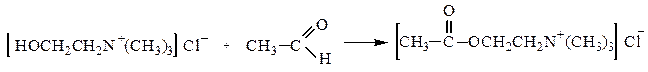 холин (хлоргидрат) ацетилхолин (хлоргидрат)
холин (хлоргидрат) ацетилхолин (хлоргидрат)
Ароматические углеводороды алкилируются окисью этилена в присутствии кислот Льюиса. Взаимодействием бензола с окисью этилена получают β-фенилэтиловый спирт, обладающий запахом розы и широко применяемый в парфюмерии.
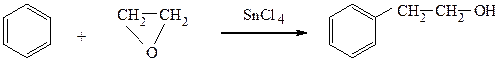
Реакции окиси этилена с реактивами Гриньяра позволяют синтезировать первичные спирты, а прочих α-окисей алкенов – вторичные спирты (см. выше, способы получения спиртов).
В производных окиси этилена типа 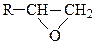 реакции раскрытия напряженного трехчленного цикла в нейтральной и щелочной средах осуществляется обычно по механизму SN2 с обращением конфигурации при атакуемом атоме углерода:
реакции раскрытия напряженного трехчленного цикла в нейтральной и щелочной средах осуществляется обычно по механизму SN2 с обращением конфигурации при атакуемом атоме углерода:
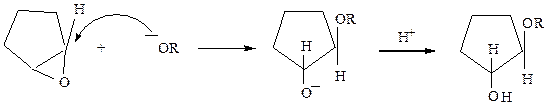
В кислой среде реакции могут идти по механизмам SN1 и SN2 :
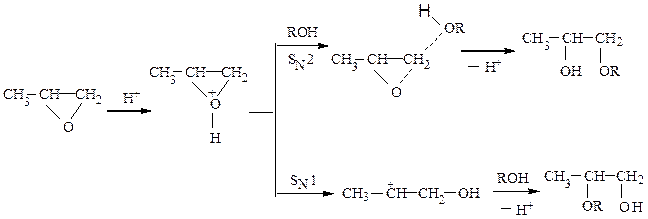
Механизм реакций раскрытия трехчленного оксидного цикла зависит от наличия в реакционной среде нуклеофильных частиц (в основном, от ее кислотности) и определяется правилом Красуского: окиси типа 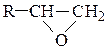 размыкают цикл в кислой среде так, что гидроксил оказывается связанным с углеродом, несущим наибольшее количество атомов водорода, т.е. преимущественно образуется первичная спиртовая группа –СН2ОН, а если это невозможно, то преимущественно вторичная
размыкают цикл в кислой среде так, что гидроксил оказывается связанным с углеродом, несущим наибольшее количество атомов водорода, т.е. преимущественно образуется первичная спиртовая группа –СН2ОН, а если это невозможно, то преимущественно вторичная 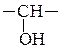 .
.
α-Окиси алкенов восстанавливаются алюмогидридом лития во вторичные спирты (окись этилена превращается в первичный спирт – этанол):
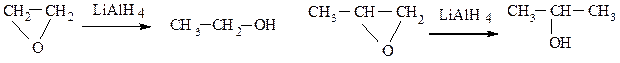
При нагревании окиси этилена с разбавленной серной кислотой наблюдается димеризация приводящая к диоксану:
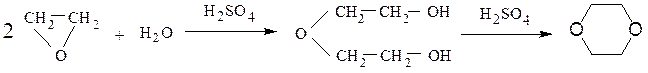
Окись этилена при 300 – 400 0С (без катализатора) или при 150 – 300 0С (кат. Al2O3, H3PO4) изомеризуется в уксусный альдегид:
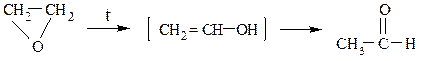
Окись этилена под действием амида натрия или триизобутилалюминия (ТИБА) полимеризуется:
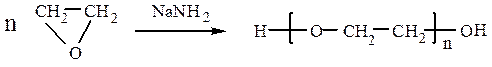
Полимеры с молекулярной массой выше 1 млн применяются в качестве флотореагентов, коагуляторов, загустителей латексов; низкомолекулярный полиэтиленоксид (желеобразный) является основой косметических композиций последнего поколения.
Контрольные вопросы к главе 10 «α-Окиси алкенов»
№ 1.Перечислите методы синтезов α-окисей алкенов.
№ 2.Предложите схему синтеза следующих веществ из окиси этилена:
(а) (β,β'-дихлордиэтил)сульфида (иприта) из окиси этилена; (б) карбитола СН3СН2ОСН2СН2ОСН2СН2ОН из окиси этилена; (в)фенилкарбитола С6Н5-О-СН2СН2-О-СН2ОН из фенола и окиси этилена; (г) этилцелозольва С2Н5ОСН2СН2ОН из этилена; (д) b-меркаптоэтиламина HS-CH2CH2-NH2 (антирадиационного препарата) из окиси этилена.
№ 3. Рассмотрите механизм гидратации α-окиси пропилена в кислой и щелочной среде.
№ 4. Какие продукты образуются при раскрытии эпоксидного цикла окиси изобутилена при действии метилатом натрия и метанола в кислой среде?
АЛЬДЕГИДЫ И КЕТОНЫ
Большая группа органических соединений содержит карбонильную группу С=О. Если карбонильный атом углерода связан только с атомом водорода или углеводородными радикалами, то такие соединения относятся к альдегидам и кетонам.
Определение.Альдегиды и кетоны относятся к карбонильным органическим соединениям и обладают высокой реакционной способностью. Почти все химические свойства связаны с наличием в них сильно поляризованной карбонильной группы С=О.
Электронное строение карбонильной группы.sp2-Гибридизированный атом углерода и атом кислорода, содержащий несмешанные s- и р-орбитали, образуют σ-связь за счет sp2-орбитали углерода и р-орбитали кислорода. π-Связь карбонильной группы С=О возникает при перекрывании р-орбитали атомов углерода и кислорода. Остаются две sp2-орбитали углерода, используемые для образования σ-связей, а также одна s- и одна р-орбитали кислорода, на каждой из которых находится по паре свободных электронов.
Благодаря большой электроотрицательности кислорода обе углерод-кислородные связи сильно поляризуются и атом углерода приобретает частичный положительный заряд (δ+). Этот положительный заряд является причиной индуктивного смещения электронов в связях между атомом углерода и соседними группами. Все эти особенности электронного строения карбонильной группы могут объяснить многие характерные реакции карбонилсодержащих соединений. Свободная пара электронов на атоме кислорода обусловливает электрофильную атаку; углерод карбонильной группы из-за частичного положительного заряда является местом атаки нуклеофильных частиц; индуктивный сдвиг электронов вдоль связей между углеродным атомом и соседними группами объясняет некоторые особые свойства групп, расположенных по соседству с карбонильной функцией, например, подвижность атомов водорода при α-углеродном атоме.
Классификация.
1) По характеру углеводородного радикала альдегиды и кетоны делятся на:
алифатические и алициклические (карбоциклические, ароматические, гетероциклические):
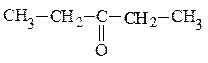
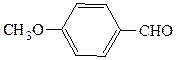
пентанон-3 п-метоксибензальдегид
(алифатический кетон) (ароматический альдегид)
По наличию или отсутствию кратных связей в радикале бывают предельные и непредельные альдегиды и кетоны, например:
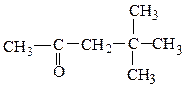
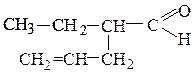
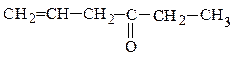
метилнеопентилкетон этилаллилуксусный альдегид этилаллилкетон
(предельный кетон) (непредельный альдегид) (непредельный кетон)
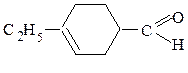
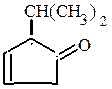
4-этилциклогексен-3-карбальдегид 2-изопропилциклопентен-3-он-1
(непредельный циклический альдегид) (непредельный циклический кетон)
2) По количеству карбонильных групп: монокарбонильные, дикарбониль-
ные и т.д.
СН3 Br O O O
│ │ ║ ║ ║
СН3–СН–СН–С–Н CH3–C–CH2– CH2–C–CH3
α-бромизовалериановый альдегид ацетонилацетон (гександион-2,5)
(монокарбонильное соединение) (дикарбонильное соединение)
Номенклатура.
Рациональная номенклатура.Основой названия альдегидов могут быть уксусный альдегид или какой-либо другой альдегид, более простого строения.В качестве основы рационального названия кетонов используется указание класса соединения, а радикалы, связанные с карбонилом, перечисляются по старшинству.
Номенклатура IUPAC. В систематической номенклатуре наличие альдегидной группы в молекуле обозначается суффиксом «-аль», а кетонной суффиксом «-он» добавляемым к названию углеводорода, соответствующему длине главной углеродной цепи. Если карбонильная группа в полифункциональном соединении не является главной, то независимо от ее природы ее обозначают приставкой «оксо-», причем альдегидная группа считается старше кетонной. (Если С-атом альдегидной группы не входит в главную цепь – «формил-» или «-карбальдегид»).
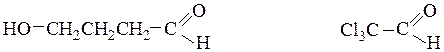
g-оксимасляный альдегид (рац.) трихлоруксусный альдегид (рац.)
4-гидроксибутаналь (IUPAC) 2,2,2-трихлорэтаналь (IUPAC)
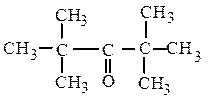
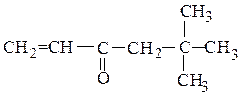
дитретбутилкетон (рац.) винилнеопентилкетон (рац.)
2,2,4,4-тетраметилпентанон-3 (IUPAC) 5,5-диметилгексен-1-он-3 (IUPAC)
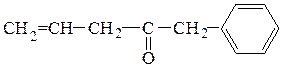
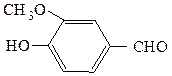
аллилбензилкетон (рац.) 3-метокси-4-гидроксибензальдегид (IUPAC)
1-фенилпентен-4-он-2 (IUPAC)
Довольно часто используются названия альдегидов, образованные от названий соответствующих карбоновых кислот (валериановый альдегид, кротоновый альдегид) и тривиальные названия оксосоединений – ацетон, ацетофенон, бензофенон и др.
Способы получения.
1. Озонолиз алкенов.В зависимости от степени замещенности атомов углерода при двойной связи могут образовываться альдегиды или кетоны.
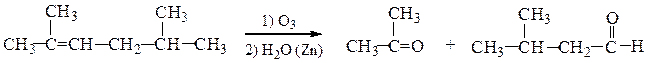
Использование алкенов симметричного строения позволяет получать один продукт:
CH3CH2CH2CH=СНCH2CH2CH3 ¾® 2 CH3CH2CH2CH=О
2. Кучерова реакция - гидратация ацетилена в присутствии HgSO4, приводит к уксусному альдегиду, остальных алкинов – к кетонам.
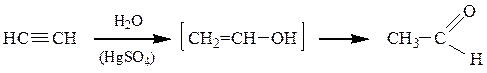
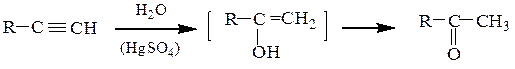
3. Фриделя–Крафтса реакция - ацилирование аренов действием галоидангидридов или ангидридов карбоновых кислот в присутствии кислот Льюиса дает жирноароматические кетоны.
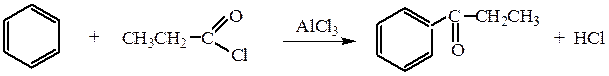
Для получения ароматических альдегидов используют разнообразные методы формилирования, которые с успехом могут быть применены лишь для активированных ароматических систем, поскольку в процессе протекания этих реакций образуются недостаточно активные электрофильные частицы, например:
а) формилирование по Вильсмейеру – N-метилформамидом в присутствии POCl3:
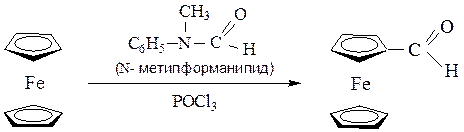
б) реакция Гаттермана – формилирование фенолов с помощью НCN и HCl в присутствии кислот Льюиса (обычно ZnCl2 или AlCl3).
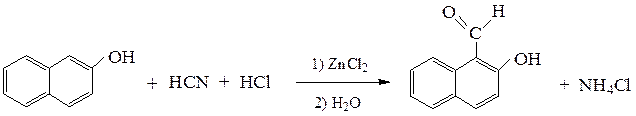
в) формилирование по Гаттерману–Коху - получение ароматических альдегидов обработкой аренов оксидом углерода (II) и HCl в присутствии катализатора.
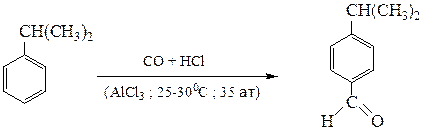
Дата добавления: 2017-09-19; просмотров: 8224;
