Гидролиз геминальных дигалогенпроизводных.
R–CHCl2 + 2 H2O ¾® [R–CH(OH)2] ¾¾® R–CH=O
(— H2O)
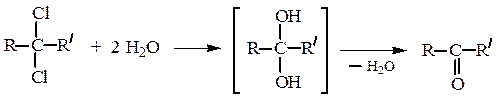
Кислотный гидролиз ряда производных альдегидов и кетонов (ацеталей, оксимов, гидразонов и др.) также приводит к образованию карбонильных соединений (см. ниже).
Окисление спиртов.
Первичные спирты окисляются в альдегиды:
3 CH3CH2OH + K2Cr2O7 + 4 H2SO4 ¾®
¾® 3 CH3CHO + K2SO4 + Cr2(SO4)3 + 7H2O
Вторичные спирты дают кетоны:
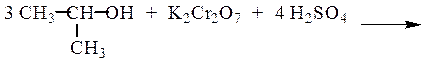
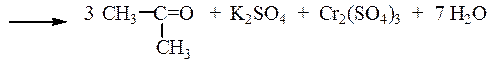
Третичные спирты не окисляются.
В промышленности формальдегид, уксусный альдегид и ацетон получают окислением или дегидрированием соответствующих спиртов с использованием медных катализаторов по следующим схемам:
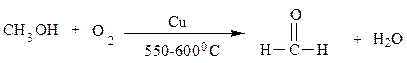
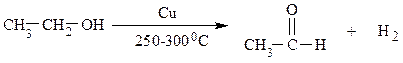
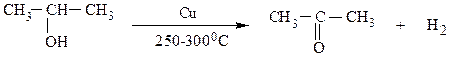
Ацетон также получают в качестве второго продукта при промышленном производстве в фенола кумольным способом (см. выше).
6. Пиролиз кальциевых или бариевых солей карбоновых кислотдает симметричные кетоны, например ацетат кальция при нагревании образует ацетон:
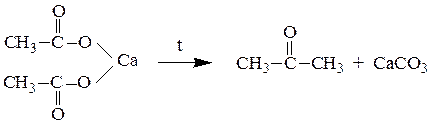
Смешанные соли (содержащие при одном катионе два различных карбоксилат-аниона) образуют несимметричные кетоны, а если один из них – остаток муравьиной кислоты, то данное превращение приводит к адьдегиду. Выход продуктов в этих реакциях, как правило, невысок. Пиролизом кальциевой или бариевой соли двухосновной адипиновой кислоты (гександиовой кислоты) получают циклический кетон – циклопентанон:
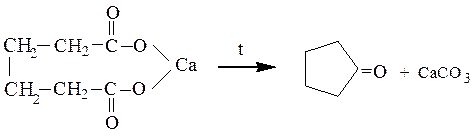
Себацинаты кальция и бария (солей гептадиовой кислоты) по аналогичной схеме дают циклогексанон.
7. Восстановление хлорангидридов карбоновых кислот по Розенмунду.Гидрирование на отравленном катализаторе позволяет получать альдегиды:
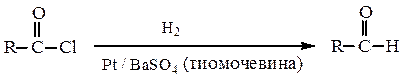
Метилкетоны получают из ацетоуксусного эфира (см. «Оксокислоты»).
8. Оксосинтез (гидроформилирование).
[Cо(CО)4]2
CH2=CH2 + CO + H2 ¾¾¾¾® CH3–CH2–CHO
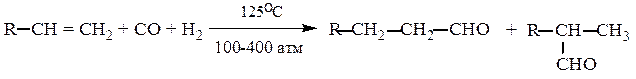
Физические свойства.За исключением газообразного формальдегида низшие альдегиды и кетоны являются жидкостями, температуры кипения которых ниже, чем у соответствующих им спиртов, т.к. молекулы карбонильных соединений не способны к образованию водородных связей между собой. Способность полярных молекул альдегидов и кетонов образовывать водородные связи с водой объясняет растворимость низших карбонильных соединений в воде. Удлинение углеродной цепи углеводородных радикалов увеличивает их гидрофобность, что приводит к резкому уменьшению их растворимости в воде.
Таблица 13. Физические свойства альдегидов и кетонов.
| Название карбонильного соединения | Формула | Мол. масса | Т.пл./т.кип. 0С | ρ, г . см-3 | Растворимость 200,100 г воды |
| Альдегиды муравьиный уксусный пропионовый масляный изомасляный валериановый капроновый энантовый фенилуксусный бензальдегид о-толуиловый м-толуиловый п-толуиловый салициловый (о-оксибензойный) п-оксибензойный п-метоксибензаль-дегид (анисовый) ванилин Кетоны ацетон метилэтилкетон пентанон-2 пентанон-3 гексанон-2 гексанон-3 гептанон-2 метилизобутилкетон октанон-2 нонанон-2 деканон-2 ацетофенон пропиофенон бутирофенон бензофенон циклопентанон циклогексанон |
Н–СНО
СН3–СНО
СН3СН2–СНО
СН3(СН2)2–СНО
(СН3)2СН–СНО
СН3(СН2)3–СНО
СН3(СН2)4–СНО
СН3(СН2)5–СНО
С6Н5СН2–СНО
С6Н5–СНО
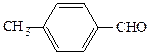
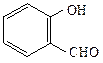
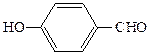
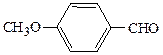
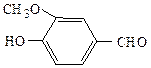 СН3СОСН3
СН3СОСН2СН3
СН3СО(СН2)2СН3
СН3СН2СОСН2СН3
СН3СО(СН2)3СН3
СН3СН2СО(СН2)2СН3
СН3СО(СН2)4СН3
СН3СО(СН2)2СН3
СН3СО(СН2)5СН3
СН3СО(СН2)6СН3
СН3СО(СН2)7СН3
С6Н5СОСН3
С6Н5СОСН2СН3
С6Н5СОСН2СН2СН3
С6Н5СОС6Н5
СН3СОСН3
СН3СОСН2СН3
СН3СО(СН2)2СН3
СН3СН2СОСН2СН3
СН3СО(СН2)3СН3
СН3СН2СО(СН2)2СН3
СН3СО(СН2)4СН3
СН3СО(СН2)2СН3
СН3СО(СН2)5СН3
СН3СО(СН2)6СН3
СН3СО(СН2)7СН3
С6Н5СОСН3
С6Н5СОСН2СН3
С6Н5СОСН2СН2СН3
С6Н5СОС6Н5
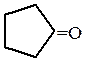
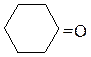
| -92 / -21 -121 / 20 -81 / 49 -99 / 76 -66 / 61 -91 / 103 — / 131 -42 / 155 — / 194 -26 / 178 — / 196 — / 199 — / 205 2 / 197 116 / — 3 / 248 82 / 285 -94 / 56 -86 / 80 -78 / 102 -41 / 101 -35 / 150 — / 124 -36 / 151 -85 / 120 -16 / 173 -7 / 195 14 / 210 21 / 202 21 / 218 11 / 232 48 / 306 -51/ 130 -31 / 157 | 0,815 0,781 0,807 0,817 0,794 1,019 1,169 1,123 0,791 0,805 0,814 0,830 1,028 0,953 0,946 | хорошо раств. хорошо раств. малорастворим малорастворим 0,1 малорастворим 0,3 1,7 1,4 0,2 неограниченно 6,3 малорастворим 1,9 растворим |
Дата добавления: 2017-09-19; просмотров: 4654;
