Химические свойства.
Химические свойства спиртов определяет функциональная группа – гидроксил. Спиртам характерны разрушение одной из двух связей: С–ОН с отщеплением гидроксила или О–Н с отрывом водорода. Полярный характер связей С–О и О–Н способствует гетеролитическому разрыву и протеканию реакций по ионному механизму. Это могут быть реакции замещения, в которых происходит замена ОН или Н, или элиминирования, когда отщепляется молекула воды (дегидратация) и образуется двойная связь.
Таблица 11. Физические свойства спиртов и фенолов
| Название спирта | Формула | Мол. масса | Т.пл./т.кип. 0С | ρ, г . см-3 | Растворимость 200,100 г воды |
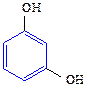
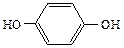
| метиловый этиловый пропиловый изопропиловый бутиловый вторбутиловый третбутиловый изобутиловый амиловый изоамиловый вторамиловый пентанол-3 третамиловый неопентиловый гексанол-1 гептанол-1 октанол-1 деканол-1 додециловый (лауриловый) тетрадециловый (миристиновый) гексадециловый (цетиловый) аллиловый кротиловый циклопентанол циклогексанол бензиловый α-фенилэтиловый β-фенилэтиловый дифенилкарбинол (бензгидрол) трифенилкарбинол коричный этиленгликоль глицерин фенол о-крезол п-крезол м-крезол пирокатехин резорцин гидрохинон |
СН3ОН
СН3СН2ОН
СН3СН2СН2ОН
СН3СН(ОН)СН3
СН3СН2СН2СН2ОН
СН3СН(ОН)СН2СН3
(СН3)3СОН
(СН3)2СНСН2ОН
СН3(СН2)3СН2ОН
(СН3)2СНСН2СН2ОН
СН3СН(ОН)СН2СН2СН3
СН3СН2СН(ОН)СН2СН3
СН3СН2С(СН3)2(ОН)
(СН3)3ССН2СОН
СН3(СН2)4СН2ОН
СН3(СН2)5СН2ОН
СН3(СН2)6СН2ОН
СН3(СН2)8СН2ОН
СН3(СН2)10СН2ОН
СН3(СН2)12СН2ОН
СН3(СН2)14СН2ОН
СН2=СНСН2ОН
СН3СН=СНСН2ОН
С6Н5СН2ОН
С6Н5СН(ОН)СН3
С6Н5СН2СН2ОН
(С6Н5)2СНОН
(С6Н5)3СОН
С6Н5СН=СНСН2ОН
НОСН2СН2ОН
НОСН2СН(ОН)СН2ОН
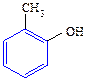
С6Н5ОН
| -98 / 65 -115 / 78 -126 / 92 -88,5 / 82 -90 / 118 -115 / 99 25,5 / 83 -108/ 108,5 -78,5 / 138 -117/ 130,5 т.пл.119 т.пл.116 -12 / 102 53 / 114 -52 / 156 -34 / 176 -17 / 195 6 / 228 24 / — 38 / — 49 / — -129 / 97 118 / — 140 / — 24 / 161,5 -15 / 205 — / 205 -27 / 221 69 / 298 162,5 / — 33 / 258 -17 / 197 18/290(разл.) 43 / 181 30 / 191 35,5 / 201 11 / 201 105 / 245 110 / 281 170 / 285 | 0,792 0,789 0,804 0,786 0,810 0,808 0,789 0,801 0,814 0,812 0,819 0,815 0,809 0,812 0,820 0,822 0,825 0,829 0,900 0,853 0,949 0,962 1,046 1,013 1,02 1,115 1,261 1,05 (450) 1,048 1,034 1,034 | неограниченно неограниченно неограниченно неограниченно 8 г 12,5 неограниченно 10,2 2,3 12,5 0,6 0,2 0,06 г неограниченно 16,6 1.6 0,05 неограниченно неограниченно 9,2 2,5 2,3 2,6 |
Схема 9. Строение спиртов, их химические связи и основные типы реакций
окисление дегидратация кислотные свойства
нуклеофильное 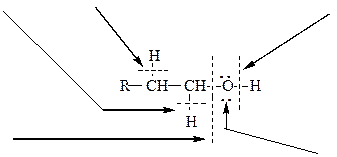
замещение нуклеофильные свойства
(основные свойства)
Схема 10. Строение фенолов, их химические связи и основные типы реакций
нуклеофильное замещение
при ненасыщенном нуклеофильные свойства кислотные свойства,
атоме углерода (основные свойства) окисление
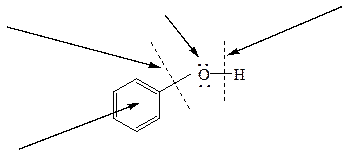
электрофильное замещение
водорода в ароматическом кольце.
1) Разрыв О–Н –связи:
а)Кислотные свойства спиртов и фенолов выражаются равновесием  . Гидроксил проявляет здесь очень слабые кислотные свойства (равновесие сдвинуто влево). Кислотные свойства спиртов зависят от природы углеводородного радикалаR товства спиртов определяен, что используется, в частности, при ситезе простых эфиров по Вильямсонуа в результате отрицате, с которым связан гидроксил. Кислотность первичных спиртов меньше кислотности воды (но того же порядка). У третичных спиртов она еще меньше, так как алкильные группы своим + Iэфф уменьшают полярность связи О-Н и подавляют ее склонность к диссоциации.
. Гидроксил проявляет здесь очень слабые кислотные свойства (равновесие сдвинуто влево). Кислотные свойства спиртов зависят от природы углеводородного радикалаR товства спиртов определяен, что используется, в частности, при ситезе простых эфиров по Вильямсонуа в результате отрицате, с которым связан гидроксил. Кислотность первичных спиртов меньше кислотности воды (но того же порядка). У третичных спиртов она еще меньше, так как алкильные группы своим + Iэфф уменьшают полярность связи О-Н и подавляют ее склонность к диссоциации.
Таким образом, реакционная способность спиртов как кислот уменьшается в ряду: метанол > первичные > вторичные > третичные.
Введение в радикал электроноакцепторных заместителей (С1, NО2 и др.) усиливает кислотные свойства в результате - Iэфф.
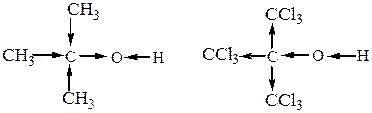
Повышенной по сравнению со спиртами кислотностью обладают и фенолы. Здесь неподеленная пара электронов кислородного атома вступает в сопряжение с p-электронной системой ароматического кольца. В результате электронная плотность кислородного атома частично перемещается на связь С-О, увеличивая при этом электронную плотность в бензольном ядре (особенно в о- и п-положениях). Электронная пара связи О-Н сильнее притягивается к атому кислорода, способствуя созданию большего положительного заряда на атоме водорода гидроксильной группы и, следовательно, отщеплению этого водорода в виде протона. Второй причиной повышенной кислотности фенола является особая устойчивость фенолят-аниона, образующегося после отщепления протона. Эта устойчивость является следствием делокализации отрицательного заряда:
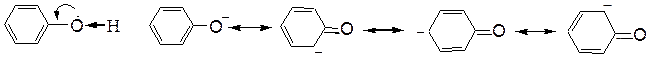
При взаимодействии кислорода с p-электронной системой ароматического ядра наблюдается мезомерный эффект – растекание электронной плотности по всей сопряженной системе. Отдавая электроны, кислород проявляет положительный мезомерный эффект (+М эфф.).
б) Расщепление связи О–Н происходит и при образовании алкоголятов в результате взаимодействия спиртов с активными металлами.
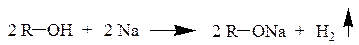
2 R–OH + Ca → (R–O)2Ca + H2 ↑
Реакционная способность падает в ряду: метанол – первичный спирт – вторичный спирт – третичный спирт (согласно ряду кислотности спиртов).
Многоатомные спирты реагируют по схеме:
CH2 –CH2 Na CH2 –CH2 Na CH2 –CH2
│ │ ——→ │ │ ——→ │ │
OH OH OH ONa ONa ONa
В случае более кислых фенолов образование фенолятов возможно также и при растворении в водных растворах щелочей:
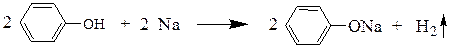
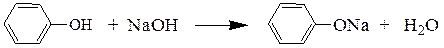
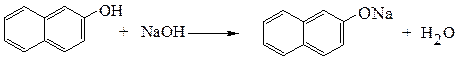
При наличии в ароматическом кольце электроноакцепторных заместителей кислотность фенолов еще более увеличивается.
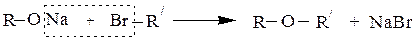
В ходе этой реакции образуется алкоголят-анион, являющийся сильным нуклеофильным реагентом, что используется, в частности, при синтезе простых эфиров по Вильямсону (R' – не третичный радикал):
Алкоголяты и феноляты щелочных металлов будучи производными очень слабых кислот легко гидролизуются, причем гидролиз усиливается нагреванием:
R–ONa + H2O ¾® R–OH + NaOH
Спирты или фенолы легко вытесняются из этих соединений также действием более сильных кислот, например хлороводородной или даже угольной:
R–ONa + HCl ¾® R–OH + NaCl
2 R–ONa + CO2 + H2O ¾® 2 R–OH + Na2CO3
Этими свойствами пользуются, если надо разделить смесь нерастворимых в воде спиртов и фенолов: смесь обрабатывают водным раствором щелочи. Слой нерастворимого в воде спирта отделяют от щелочного водного раствора фенолята и последний подкисляют. В результате последней операции выделяется фенол.
Алкоголяты – твердые соединения; используются в качестве конденсирующих реагентов, т.к. являются более сильными основаниями, чем гидроксил-анион.
в) Легко протекает взаимодействие спиртов с магнийорганическими соединениями:
R–OH + R'–MgBr ¾® R'–H + Mg(OR)Br
Эта реакция лежала в основе количественного определения активного водорода в веществах по методу Церевитинова-Чугаева, путем измерения объема выделившегося газообразного углеводорода.
г) Спирты реагируют с кислотами, образуя эфиры:
на холоду
СН3СН2ОН + H2SO4 ¾¾¾® СН3СН2ОSO2OH + H2O
этилсерная кислота
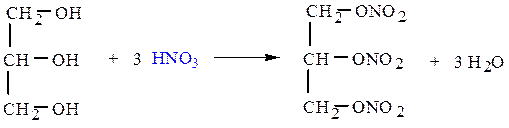
тринитроглицерин
Реакция карбоновых кислот со спиртами приводит к синтезу сложных эфиров и называется реакцией этерификации:

метиловый эфир
пропионовой кислоты
(метилпропионат)
Карбоновые кислоты ацилируют спирты с хорошими выходами только в случае первичных спиртов. Катализаторы – НС1, H2SO4, BF3. (Подробнее о
реакции этерификации см. раздел «Карбоновые кислоты», другие методы ацилирования спиртов в сложные эфиры см. раздел «Сложные эфиры»).
Дегидратация
а) Внутримолекулярная дегидратация одноатомных спиртов приводит к алкенам, при этом соблюдается правило Зайцева: атом водорода отщепляется преимущественно от соседнего наименее гидрогенизированного атома углерода; образующийся алкен наиболее замещен у двойных связей:
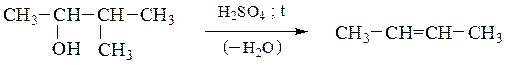
Способность спиртов подвергаться внутримолекулярной дегидратации уменьшается в ряду третичный спирт > вторичный спирт > первичный спирт в соответствии с легкостью образования и устойчивостью соответствующих карбкатионов.
б) Межмолекулярная дегидратация одноатомных спиртов дает симметричные простые эфиры (≤ 140 0C; H2SO4):
R–OH + HO–R → R–O–R + H2O
Так, образование дибутилового эфира из бутанола-1 проходит по следующему механизму:
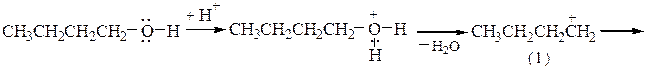
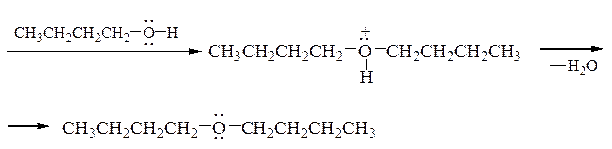
В реакции требуется небольшое количество кислоты и относительно низкая температура во избежание преимущественного образования алкенов. Разбавление спирта инертным растворителем также способствует подавлению межмолекулярной реакции из-за уменьшения вероятности столкновения молекул. Образование простых эфиров с хорошим выходом наблюдается для первичных спиртов; в случае вторичных и особенно третичных алканолов в продуктах дегидратации преобладают алкены, что вызвано легкой стабилизацией соответствующих катионов путем отщепления протона и образованием двойной связи. Для отделения простых эфиров от алкенов они промываются H2SO4, а затем водой до рН 7.
Простые эфиры можно также синтезировать действием галогеналкилов на алкоголяты, феноляты, диалкилсульфатов на феноляты и другими способами.
в) Внутримолекулярная дегидратация многоатомных спиртов.
Этиленгликоль превращается в уксусный альдегид, β-пропиленгликоль (пропандиол-1,3) – в аллиловый спирт (пропен-2-ол-1), а бутандиол-1,4 – в тетрагидрофуран или в бутадиен-1,3:
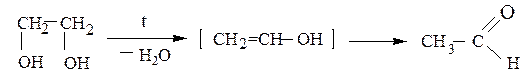
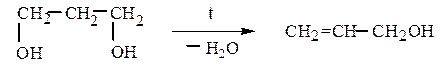
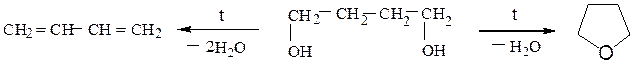
Глицерин при дегидратации дает акролеин (пропеналь):
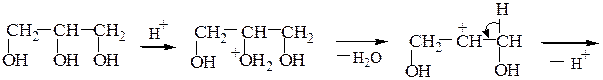
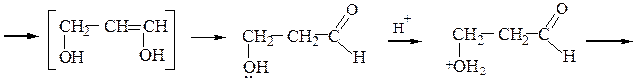
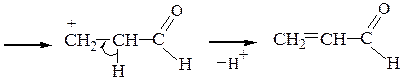
г) Межмолекулярная дегидратация многоатомных спиртов.
При дегидратации этиленгликоля можно получить диэтиленгликоль или диоксан:
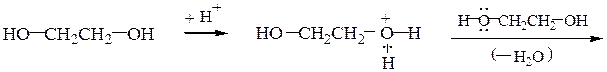
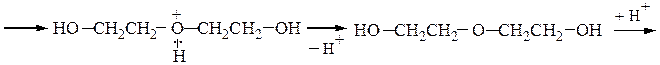
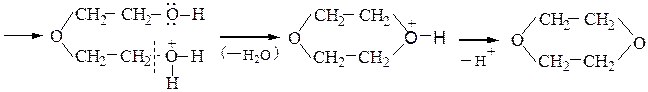
Замещение гидроксильной группы спиртов на галоген осуществляется действием галогенидов фосфора и серы или галогеноводородных кислот:
R–OH + PCl5 ¾® R–Cl + POCl3 + HCl
R–OH + PCl3 ¾® R–Cl + P (OH)3
R–OH + SOCl2 ¾® R–Cl + SO2 ↑ + HCl
При получении галогенопроизводных по обменной обратимой реакции:
R–OH + H–X  R–X + H2O (где X = Cl или Br)
R–X + H2O (где X = Cl или Br)
галогеноводороды используют в виде концентрированных кислот или газов. Реакционная способность спиртов в этой реакции уменьшается от третичных к первичным; замещение на бром протекает легче, чем на хлор (в случае HCl обычно дополнительно используют безводный ZnCl2). Образующуюся воду удаляют добавлением веществ связывающих ее или азеотропной отгонкой. Йодалкилы этим методом не получают из-за восстанавливающего действия HI.
Окисление
а) При действии дихромата натрия или перманганата калия в кислой среде первичные одноатомные спирты превращаются в альдегиды и далее в карбоновые кислоты:
3 R–CH2OH + K2Cr2O7 + 4 H2SO4 ¾® 3 R–CHO + K2SO4 + Cr2(SO4)3 +7 H2O
R–CHO + [О ] ¾® R–CОOН
Для получения альдегидов из первичных спиртов используют более мягкие условия проведения реакции окисления: разбавленный раствор триоксида хрома в разбавленной серной кислоте (реагент Джонса) или комплекс CrO3 с пиридином и НCl (реагент Саррета) при 15-20 0С.
Вторичные одноатомные спирты всегда превращаются в кетоны. Оранжевый раствор окислителя приобретает зеленую окраску.
3 R–CH–R' + K2Cr2O7 + 4 H2SO4 ¾® 3 R–C–R'+ K2SO4 + Cr2(SO4)3 +7 H2O
│ ║
ОН О
3 R–CH–R' + 2 CrO3 + 6 СН3СООН ¾® 3 R–C–R' + 2 (СН3СОО)3 Cr +6 H2O
│ ║
ОН О
Третичные одноатомные спирты не окисляются, и реакционная смесь остается оранжевой.
б) При горении происходит полное окисление спиртов; образуютcя оксид углерода (IV) и вода:
С2Н5ОН + 3 О2 ¾® 2 СО2 +3 Н2О
в) Многоатомные спиртыокисляются ступенчато.
Так, окисление этиленгликоля может привести к образованию пяти веществ в зависимости от последовательности и степени окисления спиртовых групп: частичное окисление всегда дает смесь промежуточных продуктов. Полное окисление приводит к щавелевой кислоте:
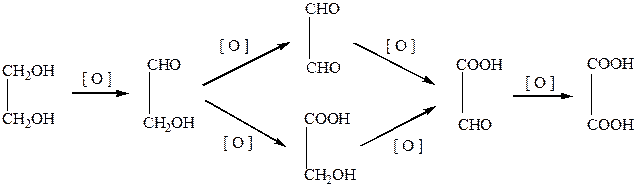
При обработке соединений, содержащих две и более групп –OH, находящихся у соседних атомов углерода, йодной кислотой (р. Малапрада) протекает окислительное расщепление С–С связи по схемам:
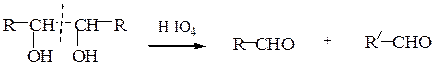
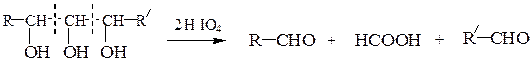
При окислении глицерина образуются следующие соединения:
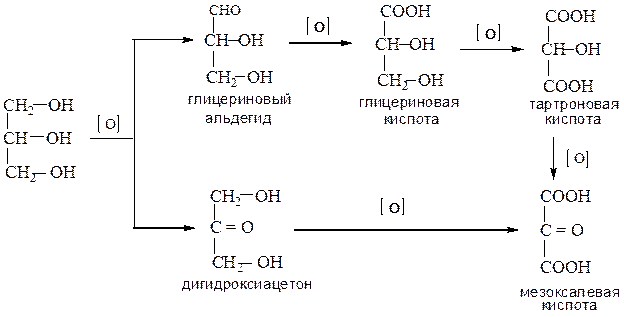
г) Многоатомные фенолы легко окисляются с образованием окрашенных хинонов:
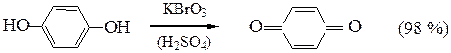
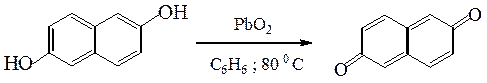
Отличие фенолов от предельных одноатомных спиртов:
1) большая кислотность (фенолы растворяются в водных растворах ще-
лочей, а одноатомные спирты - нет);
2) пониженная реакционная способность гидроксильной группы в реакциях замещения. В фенолах связь между атомами углерода и кислорода более прочная из-за сопряжения неподеленной пары р-электронов атома кислорода с ароматическим кольцом. Так, циклогексанол с бромоводородом образует циклогексилбромид, а у фенола замещения гидроксила на бром в этих условиях не наблюдается.
3) фенолы очень активны в реакциях SE по ароматическому кольцу,
благодаря сильному активирующему (электронодонорному) действию на бензольное кольцо гидроксильной группы – ориентанта I рода. Так, фенол с бромной водой дает осадок 2,4,6-трибромфенола (при большом избытке брома образуется тетрабромпроизводное):
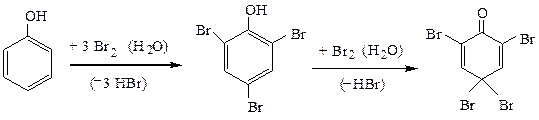
а при нитровании – пикриновую кислоту (2,4,6-тринитрофенол), причем если нитровать разбавленной азотной кислотой при охлаждении реакционной смеси льдом можно выделить смесь о- и п-нитрофенолов:
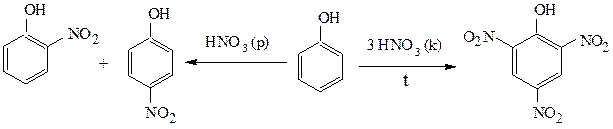
4) фенолы образуют фиолетовое (или малиновое) окрашивание с водным
раствором FeCl3. Это используется как качественная реакция на фенолы.
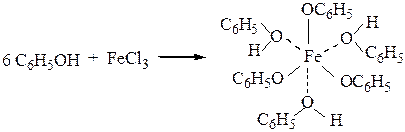
5)Реакция Реймера-Тиманадает о-гидроксибензальдегид (салициловый альдегид), путем введения формильной группы в фенолы при нагревании их с хлороформом в присутствии щелочи.
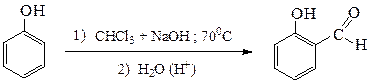
6) Поликонденсация с формальдегидом – образуются фенолформаль-дегидные смолы (см. c. 160).
Особенности многоатомных спиртов:
1) способность давать производные по одной или нескольким ОН-группам
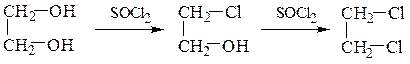
2) образование комплексных соединений с гидроксидом меди и борной
кислотой:
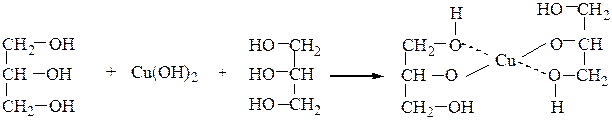
Наблюдается растворение светло-голубого осадка с образованием темно-синего раствора. Комплексы образуют цис-диолы, содержащие гидроксильные группы при соседних углеродных атомах.
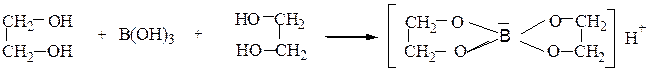
Образующаяся ансольвокислота значительно сильнее, чем исходная борная кислота (наблюдается скачок рН).
Контрольные вопросы к главе 8 «Спирты и фенолы»
№ 1.Расположите в ряд по убыванию кислотности фенол, тимол (2-изопропил-5-метилфенол), 2,4-динитрофенол, 4-нитрофенол. Как изменяется относительная реакционная способность этих веществ в реакциях электрофильного замещения по ароматическому кольцу
№ 2.Предложите метод разделения о-крезола и бензилового спирта. Вещества должны быть получены в чистом виде.
№ 3.В шести пробирках находятся: аллиловый спирт, третбутиловый спирт бутанол-1, пропандиол-1,2, о-крезол, бутанол-2. Как идентифицировать каждое из веществ?
№ 4. Расположите в ряд по легкости дегидратации следующие спирты: 4-метилпентанол-1; 3-метилбутанол-2; 2-метилпентанол-2.
№ 5. Почему при кипячении фенола с бромоводородной кислотой реакции не происходит, в то время как при кипячении в тех же условиях циклогексанола с высоким выходом образуется бромциклогексан.
№ 6.Опишите химические тесты, позволяющие различить: (а) п-крезол и бензиловый спирт; (б) фенол и циклогексанол; (в) циклогексанол и циклогексен; (г) метоксибензол (анизол) и п-крезол; (д) 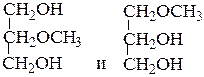 .
.
№ 7.Напишите уравнения реакций: аллилового спирта с пентабромидом фосфора, п-крезола с натрием; метанола с пентахлоридом фосфора; п-нитрофенола с гидроксидом калия, внутримолекулярной дегидратации 2-метилциклопентанола-1; бутандиола-2,3 с гидроксидом меди (II).
№ 8.Расшифруйте схемы химических превращений:
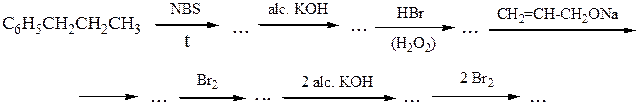
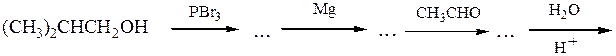
№ 9. Напишите схемы синтеза следующих соединений: (а) циклопентен-2-ола-1 из циклопентанола; (б)1,2-дибромпентана из пентанола-1; (в) глицерина из акрилонитрила СН2=СН-CN; (г)4-метилпентанола-1 из 2-метилпропанола-1; (д)пропилизопропилового эфира из пропилового спирта;(е)триметилкар-бинола из изопропилкарбинола.
№10. Установите строение соединения, если известны его молекулярная формула и продукты некоторых его превращений: (а)С7Н16О, при действии CH3MgCl выделяется метан, при дегидратации превращается в углеводород С7Н14, который в результате озонолиза дает смесь уксусного и валерианового альдегидов; (б) С13Н12О, реагирует с гидроксидом натрия, метилируется диметилсульфатом (продукт метилирования при окислении перманганатом калия, образует 4'-метокси-4-бифенилкарбоновую кислоту); (в) С4Н10О, реагирует с натрием, при окислении образует кетон; (г) С4Н8О, обесцвечивает бромную воду, реагирует с натрием, а при осторожном окислении образует винилуксусный альдегид; (д)С5H12O, реагирует с натрием с выделением водорода, при окислении дает кетон C5H10O, при дегидратации - триметилэтилен.
ПРОСТЫЕ ЭФИРЫ
Определение.Простыми эфирами являются производные углеводородов, в которых атомы водорода замещены на алкоксидную группу R–O–R¢. Простые эфиры могут иметь циклическое строение, в этом случае фрагмент С–O–C входит в состав цикла.
Классификация.В зависимости от строения–симметричные (R–O–R), несимметричные (R–O–R¢), циклические ( 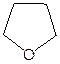 ,
, 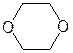 и др.). По природе радикалов – алифатические (СН3–О–СН2СН3), ароматические (С6Н5–О–С6Н5); предельные (СН3СН2СН2–О–СН2СН3), непредельные (СН2=СН–О–СН=СН2).
и др.). По природе радикалов – алифатические (СН3–О–СН2СН3), ароматические (С6Н5–О–С6Н5); предельные (СН3СН2СН2–О–СН2СН3), непредельные (СН2=СН–О–СН=СН2).
Способы получения. Простые эфиры (R = R¢) получают межмолекулярной дегидратацией спиртов в присутствии серной кислоты:
СH3CH2OH + HOSO3H ¾® СH3CH2OSO3H + H2O
СH3CH2OSO3H + HOCH2CH3 ¾® СH3CH2–O–CH2CH3 + H2O
или взаимодействием галогенопроизводных углеводородов (R и R/ не являются третичными алкилами) с алкоголятами (фенолятами) щелочных металлов (синтез Вильямсона):

Простые эфиры фенолов получают обработкой фенолов эфирами серной кислоты (диметилсульфатом, диэтилсульфатом) в щелочной среде:
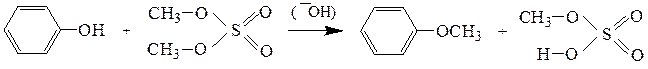
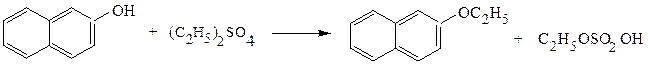
Физические свойства.Неспособность молекулами простых эфиров образовывать водородные связи делает их более легколетучими по сравнению со спиртами с близкой молекулярной массой. Однако в смесях с гидроксилсодержащими соединениями, например, с водой, простые эфиры образуют водородные связи за счет атома кислорода как донора пары электронов, поэтому низшие простые эфиры ограниченно растворимы в воде. Циклические простые эфиры, имея более доступный для сольватации атом кислорода, образует более прочные водородные связи, поэтому они хорошо растворимы в воде.
Таблица 12. Физические свойства простых эфиров и α-окисей алкенов
| Формула | Название | Молекуляр- ная масса | Т. пл. (оС) | Т.кип (оС) | Растворимость в 100 г воды (200С) |
СН3–О–СН3
С2Н5–О–С2Н5
н-С3Н7–О–С3Н7-н
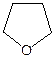
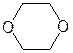
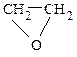
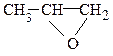
| Диметиловыйэфир Диэтиловыйэфир Дипропиловыйэфир Тетрагидрофуран Диоксан Окись этилена Окись пропилена | - 140 - 116 -122 -108 - 112 - 118 | -24 | 3700 мл 7,5 г 8 г Растворим Неограниченно Неограниченно Растворим |
Химические свойства. Благодаря симметричному распределению электронной плотности между связями С–О обладают высокой химической устойчивостью. Не взаимодействуют с большинством химических реагентов.
1) Гидролиз простых эфиров практически не осуществляется. Алкиловые и
алкилариловые эфиры расщепляются только при кипячении с галогеноводород-ными кислотами
С6Н5ОСH3 + HI → C6H5OH + CH3I
В данном случае образуется фенол, так как связь СSp2–O прочнее по сравнению с СSp3–O, и последняя разрывается легче.
Ариловые эфиры не гидролизуются даже в жестких условиях.
2) При взаимодействии с сильными Н-кислотами и кислотами Льюиса простые эфиры проявляют слабые основные свойства, образуя мало-устойчивые оксониевые соединения, содержащие положительно заряженный атом кислорода, связанный тремя ковалентными связями с органическими радикалами или атомом водорода и ионной связью с анионом:
+ _
СH3–CH2–O–CH2–CH3 + H2SO4 ¾® [ СH3–CH2–O–CH2–CH3 ] OSOH
│
H
+
СH3–CH2–O–CH2–CH3 + BF3 ¾® СH3–CH2–O–CH2–CH3
│
─ BF3
диэтилэфират трехфтористого бора
3). При хранении на воздухе большинство алифатических простых эфиров окисляются по Сα–Н связи на свету и дают неустойчивые и взрывоопасные гидропероксиды, например:
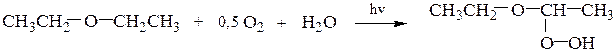
Перед работой с простыми эфирами их надо проверять на присутствие пероксидов. Остаток после отгонки растворителей может содержать опасные в отношении взрыва концентрации пероксидов, поэтому эфиры нельзя перегонять досуха. Пероксиды обнаруживают по покраснению при встряхивании эфира с водным раствором соли Мора (железоаммонийные квасцы) и тиоцианата калия; пероксиды окисляют Fe2+ в Fe3+, который реагирует с тиоцианат-ионом SCN-, давая характерное кроваво-красное окрашивание. Пероксиды можно обнаружить также по реакции окисления иодида калия до свободного иода, имеющего бурую окраску; причем малые количества иода хорошо определяются по появлению синей окраски крахмального раствора.
Пероксиды обычно удаляют либо промывая эфир растворами солей Fe2+ (или используя другие восстановители), либо осторожно разрушая их щелочами.
Краун-эфиры – макроциклические полиэфиры с четырьмя и более кислородными атомами в цикле. Большинство из них получают из этиленгликоля. В названиях краун-эфиров в квадратных скобках указывают число атомов в макроцикле, а цифра в конце названий – число атомов кислорода.
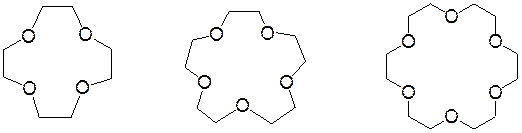
[12]-краун-4 [15]-краун-5 [18]-краун-6
Краун-эфиры синтезируют дегидратацией этиленгликоля или реакцией a,w-диола с a,w-дихлоридом в присутствии основания.
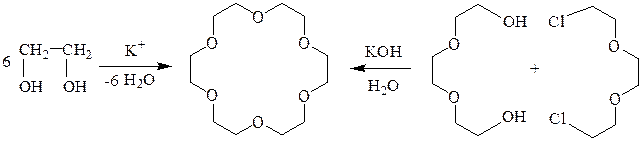
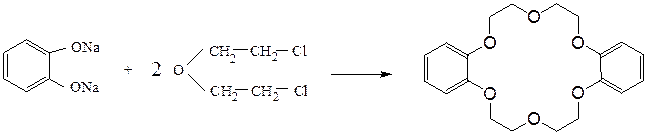 дибензо-18-краун-6
дибензо-18-краун-6
Области применения краун-эфиров:
─ разделение экстракцией, например, солей щелочных и щелочно-земельных металлов;
─ применение в сорбционных и хроматографических методах анализа;
─ повышение растворимости труднорастворимых веществ в малополярных органических растворителях и повышение реакционной способности реагентов;
─ моделирование биохимических процессов, биокаталитических свойств;
─ создание эффективных лекарственных средств;
─ выведение из организма радиоактивных изотопов;
─ обезвреживание и очистка сточных вод.
Контрольные вопросы к главе 9 «Простые эфиры»
№ 1. Напишите уравнения реакции и приведите механизм внутри-молекулярной и межмолекулярной дегидратации бутилового спирта в прис. H2SO4. Как при получении простого эфира по данной реакции удалить примесь алкена? Как при получении алкена путем дегидратации спирта уменьшить выход простого эфира?
№ 2. Напишите механизм реакции получения диоксана из этиленгликоля в присутствии серной кислоты
№ 3.Покажите два метода приготовления метилизопропилового эфира по реакции алкоголята щелочного металла с галогеналканом. Один метод дает гораздо больший выход эфира, чем второй. Объясните, какая реакция предпочтительнее и почему.
№ 4. Предложите схему синтезаb,b¢-дихлордиэтилового эфира (хлорекса С1СН2СН2-О-СН2СН2С1, применяемого в синтезе краун-эфиров) из этилового спирта.
№ 5. Простые эфиры при хранении в результате окисления образуют взрывоопасные пероксиды. Опишите методы обнаружения и обезвреживания пероксидов в простых эфирах.
№ 6.Установите строение веществ: (а)С7Н16О, не реагирует с натрием при комнатной температуре, при кипячении с иодоводородной кислотой образует С2Н5I и С5Н11I, после обработки влажной окисью серебра С5Н11I превращается в изоамиловый спирт; (б) два изомерных вещества С10Н12О выделены из масла листьев лавра, нерастворимы в воде, разбавленных кислотах и щелочах, дают поло-жительные пробы с разбавленным раствором КМnО4 и Вг2/СС14; при энергичном окислении оба вещества дают п-метоксибензойную кислоту;
Дата добавления: 2017-09-19; просмотров: 4741;
