Промышленное получение метанола и этанола
Метанол получают из синтез-газа (катализатор – Cr2O3, ZnO; 350oC, 210 атм):
CO + 2 H2 → СН3ОН
Этанол получают прямой гидратацией этилена (катализатор – Н3РО4, SiO2; 300 oC):
CН2=CН2 + Н2О → СН3СН2ОН
или в присутствии концентрированной серной кислоты (непрямая гидратация):
CН2=CН2 + Н2О → СН3СН2ОSO3H → СН3СН2ОН
Этиловый спирт также получают ферментативным гидролизом углеводов – брожением глюкозы с помощью дрожжей рода Saccharomyces и бактерий рода Zimomonas
C6Н12О6 → 2 СН3СН2ОН + 2 СО2
9) Двухатомные спирты получают гидроксилированием производных этилена – окислением в водной среде, приводящее к образованию α-гликолей
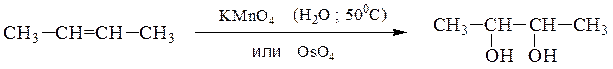
гидратацией α-окисей алкенов:
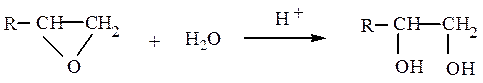
гидролизом дигалогенпроизводных или галогензамещенных спиртов слабым раствором щелочи:
СlCH2CH2Cl + 2 NaOH ¾® НOCH2CH2OH + 2 NaCl
СlCH2CH2CH2CH2OH + NaOH ¾® НOCH2CH2CH2CH2ОН
10) Глицеринсинтезируют либо из пропилена по следующим схемам:
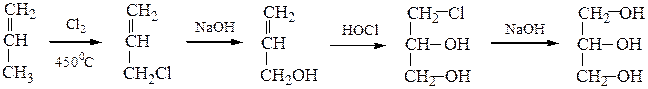
│ ↑
│________ Сl2 __________CH2–CH–CH2 _________________│
│ │ │
OH OH OH
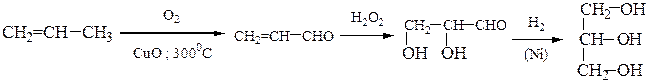
или в результате гидролиза жиров в кислой или в щелочной среде:
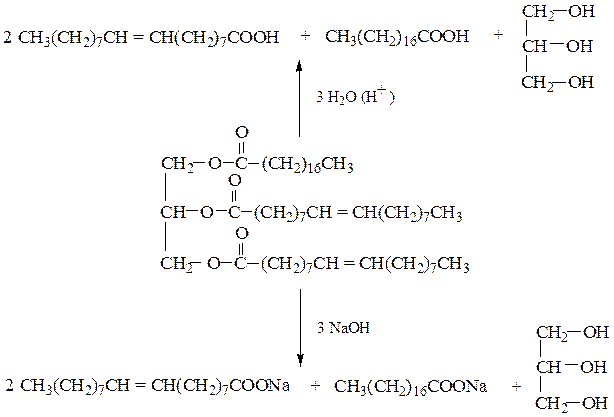
Синтезы фенолов
а) В промышленности обычно получают фенол по методу Хока – окислением изопропилбензола (метод Хока)
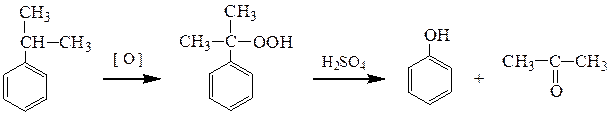
б) Фенолы могут быть получены сплавлением натриевых солей ароматических сульфокислот с гидроксидами щелочных металлов

в) В жестких условиях (350 0С и повышенном давлении) реакцией замещения галогена в арилгалогенидах на гидроксигруппу
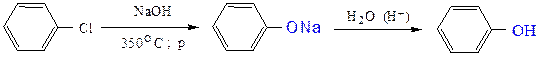
в) Гидролизом солей арилдиазония
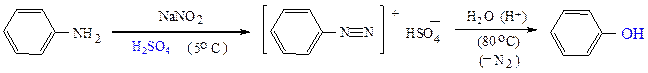
Физические свойства.Эти свойства спиртов зависят от строения углеводородного радикала и положения гидроксильной группы. Первые представители гомологического ряда спиртов – это жидкости, высшие спирты – твердые вещества.Спирты и фенолы имеют более высокие температуры кипения и плавления,чем соответствующие им углеводороды и галогенопроизводные. Это объясняется тем, что молекулы спиртов ассоциированы за счет образования водородных связей.
:O–Н …. :O–Н …. :O–Н
½ ½ ½
Ассоциаты спиртов имеют следующее строение: R R R
Ассоциация молекул спиртов за счет водородных связей определяется высокой полярностью связи О–Н из-за сильного различия в электроотрицатель-ности атомов кислорода и водорода. Энергия водородной связи (Н....О) составляет 20 кДж/моль, т.е. существенно меньше, чем ковалентной связи Н-О (460 кДж/моль). Тем не менее разрушение водородных связей, которое должно предшествовать испарению веществ при кипении, требует определенных энергетических затрат, что и выражается в повышении температуры кипения. Многоатомные спирты в еще большей степени ассоциированы, т. к. содержат большее число гидроксильных групп, участвующих в образовании водородных связей. Благодаря этому они обладают еще более высокими температурами кипения, а также повышенной растворимостью в воде.
Спирты нормального строения кипят при более высокой температуре, чем разветвленные. Низшие спирты (метанол, этанол, пропанолы) смешиваются с водой в любых соотношениях. С ростом молярной массы растворимость спиртов в воде резко падает. Высшие спирты не растворяются в воде. Растворимость спиртов с разветвленной структурой выше, чем у спиртов, содержащих нормальные радикалы.
Дата добавления: 2017-09-19; просмотров: 6054;
