МАГНИЙОРГАНИЧЕСКИЙ СИНТЕЗ
Получение магнийорганических соединений.Смешанные магний-органические соединения(реактивы Гриньяра) обычнополучают реакцией галогенопроизводных углеводородов со стружками металлического магния в среде безводных (абсолютированных) простых эфиров (диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан и др.)
R–X + Mg ¾® R–MgX (где Х = Cl, Br, I)
Магнийорганические соединения можно получить почти из любых алкилгалогенидов (за исключением фторидов), причем скорость взаимо-действия галоидного алкила с магнием в эфире уменьшается от йодида к хлориду. Выходы RMgX уменьшаются при переходе от первичных радикалов к третичным и от хлоридов к иодидам. Основными побочными процессами, осложняющими получение реактивов Гриньяра из галоидных алкилов, являются дегидрогалогенирование и реакция сдваивания радикалов, подобная реакции Вюрца. Первый процесс наиболее характерен для разветвленных алкилгалогенидов, особенно иодидов (например, йодистый третбутил при обработке магнием в эфире в основном превращается в изобутилен); второй протекает тем легче, чем подвижнее галоид в галогенопроизводном (так, для аллилгалогенидов сдваивание радикалов под действием магния в эфире является основным направлением реакции; для получения аллилмагнийгалоге-нида реакцию ведут в разбавленных эфирных растворах и с большим избытком магния) и чем больше радикал. Хлориды ароматического и винильного типов с магнием в эфире не реагируют, однако фенилмагнийхлорид и винил-магнийхлорид (реактив Нормана) могут быть получены, если реакцию вести при кипячении в среде высококипящих простых эфиров (ТГФ, диоксане, дибутиловом эфире). Диброммагнийацетилен (комплекс Йоцича) получают, пропуская ацетилен через этилмагнийбромид:
2C2H5MgBr + НСºСН ¾® BrMg-СºС-MgBr + 2C2H6
(имеет место избыток реактива Гриньяра). Моноброммагнийацетилен может быть синтезирован при добавлении раствора этилмагнийбромида в ТГФ к насыщенному раствору ацетилена в том же растворителе:
C2H5MgBr + HСºCH ¾® HСºC-MgBr + С2Н6
Химические реакции магнийорганических соединений. Основными синтетическими областями применения магнийорганических реагентов являются реакции, в которых они выступают в качестве нуклеофильных соединений.
Для синтеза первичных спиртовиспользуют реакции магнийорганических соединений с формальдегидом и окисью этилена, причем образующиеся продукты содержат в радикале соответственно на один или на два атома углерода больше, чем исходный реактив Гриньяра:
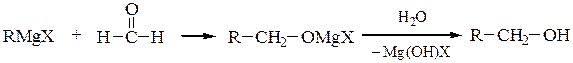
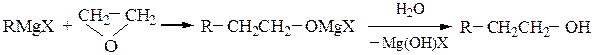
Вторичные спирты получают взаимодействием реактивов Гриньяра с альдегидами, α-окисями монозамещенных этиленов или с производными муравьиной кислоты:
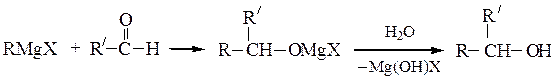
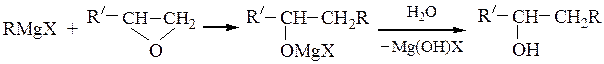
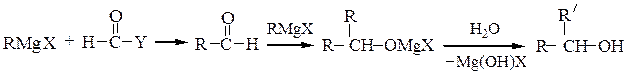
Последнюю реакцию (Y = -OR', галоген) в особых условиях можно остановить на стадии образования карбонильного соединения; конечным продуктом является вторичный спирт, содержащий два одинаковых радикала.
Третичные спирты получают при обработке RMgX кетонами или при двухстадийном превращении производных карбоновых кислот (сложных эфиров, ангидридов, галогенангидридов); в особых условиях можно выделить образующийся при этом кетон:
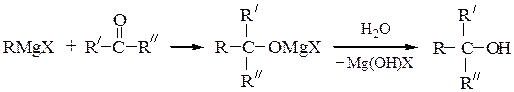
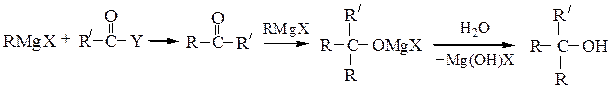
Карбоновые кислоты получают действием оксида углерода (IV) по схеме:
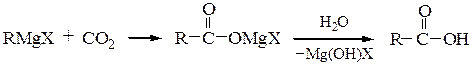
При выполнениив лаборатории этих синтезов следует помнить о том, что магнийорганические соединения очень реакционноспособны и их не рекомендуется долго хранить.
Реактивы Гриньяра вступают в реакции с кислородом и серой:
H2O
R–MgX + ½ O2 ¾® R–OMgX ¾¾® R–OH
спирты
R–MgX + S ¾® R–SMgX ¾¾® R–SH
меркаптаны
Магнийорганические соединения легко разлагаются до углеводородов под действием веществ, содержащих подвижный атом водорода, например:
R–MgX + H–OH ¾® R – H ↑ + Mg(OH)X
вода
R–MgX + H–OR' ¾® R – H ↑ + Mg(OR')X
спирты
R–MgX + H–SH ¾® R – H ↑ + Mg(HS)X
сероводород
R–MgX + H–NH2 ¾® R – H ↑ + Mg(NH2)X
аммиак
R–MgX + H–NH–R' ¾® R – H ↑ + Mg(R'NH)X
первичные амины
R–MgX + H–NR'R'' ¾® R – H ↑ + Mg(R'R''N)X
вторичные амины
R–MgX + H–O–CO–R' ¾® R – H ↑ + Mg(R'COO)X
карбоновая кислота
По той же схеме реактивы Гриньяра будут разлагаться СН-кислотами, например ацетиленом, алкинами-1 и циклопентадиеном:
2 R–MgX + НСºСН ¾® R – H ↑ + ХMg-СºС-MgХ
R–MgX + HСºC–R' ¾® R – H ↑ + R'–СºC-MgBr
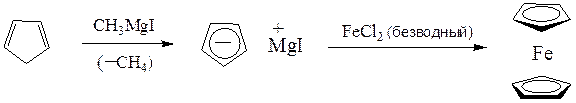
ферроцен
В связи с указанными выше реакциями, разлагающими RMgX до углеводородов, для получения высоких выходов продуктов магний-органического синтеза следует использовать свежеприготовленные реактивы Гриньяра, сухие растворители и реагенты; работы проводить в атмосфере очищенных инертных газов. В случае синтеза вторичных спиртов исходные альдегиды перегоняют для удаления примесей спиртов и карбоновых кислот.
Магнийорганические реагенты удобно использовать при синтезе химических соединений, меченых изотопной меткой (например, D дейтерий – 2H, 14С, 15N, 18О и др.). Вещества, содержащие в молекуле радиоактивные изотопы, не отличаются от обычных аналогов по химическим свойствам, но обнаруживаются при помощи счетчика Гейгера.
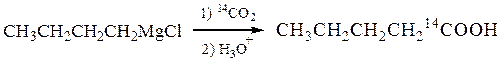
1-14С-пентановая кислота
CH2=CH–CH2–MgBr + D2O ¾¾® CH2=CH–CH2D + Mg(OD)Br
тяжелая вода 3-дейтеропропен-1
Контрольные вопросы к главе 7 «Магнийорганический синтез»
№ 1.Расположите галогенопроизводные в ряд по убыванию активности в реакции с магнием: йодистый метил, хлорбензол, йодбензол; хлористый бутил; бромистый винил, бромистый этил.
№ 2.Наиболее удобным методом синтеза вторичных спиртов является реакция альдегидов с реактивами Гриньяра. Почему для получения высоких выходов используют свежеприготовленные реактивы Гриньяра, очищенные реагенты и безводные растворители в атмосфере чистого инертного газа?
№ 3.Предложите схемы синтеза спиртов, используя химические свойства реактивов Гриньяра: (а) метилдиэтилкарбинола из этанола; (б) метилдиэтил-карбинола из этанола; (в) 3,3-диметилбутанола-1 из изобутилена и этилена; (г) диметилизопропилкарбинола из пропилена.
№ 4.Предложите схему синтеза кислот, используя химические свойства реактивов Гриньяра: (а) циклопентанкарбоновой кислоты из циклопентана; (б) 2-метилбутановой кислоты из бутена-1; (в) п-толуиловой кислоты из толуола; (г) 1-нафтилуксусной кислоты из нафталина.
№ 5.Предложите схемы синтеза соединений, меченых радиоактивными изотопами: (а) изомасляной (1-14С) кислоты (СН3)2СН14СООН из пропилена и Са14СО3; (б) дейтеротолуола С6H5CH2D из толуола и тяжелой воды; (в); 3-дейтеропропилена-1 CH2=CH-CH2D из хлористого аллила и D2O; (г) гексадейтеробензола из ацетилена и тяжелой воды.
№ 6.Реакция пентанона-3 с реактивом Гриньяра и последующим гидролизом приводит к спирту, дегидратация которого дает 2-метил-3-этил-пентен-2. Какова формула реактива Гриньяра?
№ 7.Бромистый алкил образует реактив Гриньяра, который под действием воды превращается в гексан. При обработке натрием получается 4,5-диэтилоктан. Какова структурная формула галогенида?
№ 8. Реакция реактива Гриньяра с диэтилкетоном дает третичный спирт, дегидратация и последующее каталитическое гидрирование которого привели к 3-этилпентану. Каково строение реактива Гриньяра?
СПИРТЫ И ФЕНОЛЫ
Определение.Спирты и фенолы – это производные углеводородов, у которых один или несколько атомов водорода замещены на гидроксильную группу (–ОН). У спиртов гидроксильная группа связана с насыщенным углеродным атомом.
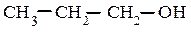
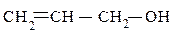
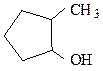
пропиловый спирт аллиловый спирт 2-метилциклопентанол-1
пропанол-1 (IUPAC) пропен-2-ол-1(IUPAC) (IUPAC)
у фенолов – непосредственно с ароматическим кольцом.
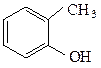
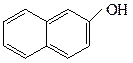
о-крезол β-нафтол
Соединения, содержащие гидроксильную группу, связанную с углеродным атомом боковой цепи арена называют ароматическими спиртами.
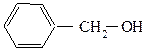
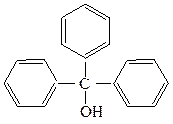
бензиловый спирт трифенилкарбинол
Классификация.
1. По типу углеродного атома, с которым связана ОН-группа, спирты
делят на первичные RCH2OH :
СH3–CH2–CH2–CH2–OH СH3–CH–CH2–OH
│
СH3
бутиловый спирт изобутиловый спирт
бутанол-1 (IUPAC) 2-метилпропанол-1 (IUPAC)
вторичные RR¢CHOH :
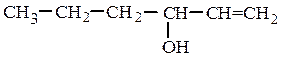
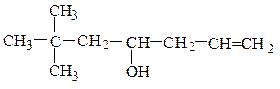
винилпропилкарбинол (рац.) аллилнеопентилкарбинол (рац.)
гексен-1-ол-3 (IUPAC) 6,6-диметилгептен-1-ол-4 (IUPAC)
и третичные RR¢R¢¢COH :
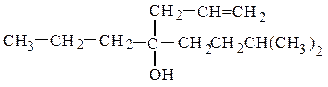
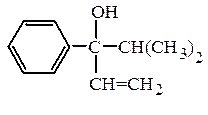
пропилаллилизопентилкарбинол (рац.) винилизопропилфенилкарбинол (рац.)
7-метил-3-пропилоктен-1-ол-4 (IUPAC) 4-метил-3-фенилпентен-1-ол-3 (IUPAC)
Спирты могут быть предельными и непредельными, в зависимости от того, имеется или нет кратная связь в углеводородном радикале, связанном с гидроксильной группой. Непредельные спирты, содержащие одновременно при одном углеродном атоме двойную связь и гидроксил (енолы), очень неустойчивы и сразу же изомеризуются альдегиды или кетоны (правило Эльтекова-Эрленмейера).
2. По числу гидроксильных групп различают одно-, двух- и многоатомные
спирты и фенолы:

метилизопропилкарбинол (рац) β-фенилэтиловый спирт (рац) 3-метилбутанол-2 (IUPAC) 2-фенилэтанол-1 (IUPAC) (одноатомный спирт) (одноатомный спирт)
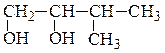
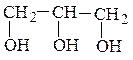
изопропилэтиленгликоль(рац)глицерин
3-метилбутандиол-1,2 (IUPAC) пропантриол-1,2,3 (IUPAC)
(двухатомный спирт) (трехатомный спирт)
Двухатомные фенолы:
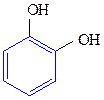
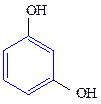
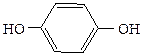
1,2-дигидроксибензол 1,3-дигидроксибензол 1,4-дигидроксибензол
(пирокатехин) (резорцин) (гидрохинон)
Трехатомные фенолы:
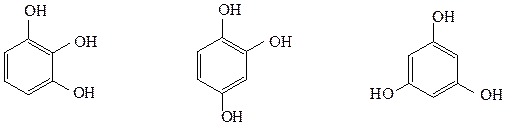
1,2,3-тригидроксибензол 1,2,4-тригидроксибензол 1,3,5-тригидроксибензол
(пирогаллол) (гидроксигидрохинон) (флороглюцин)
Многоатомные спирты устойчивы лишь при условии, что гидроксильные группы связаны с различными атомами углерода. Соединения, содержащие две (или три) гидроксильные группы при одном и том же углеродном атоме, с отщеплением воды переходят в более устойчивые карбонильные или карбоксильные соединения соответственно:
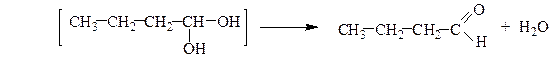
масляный альдегид
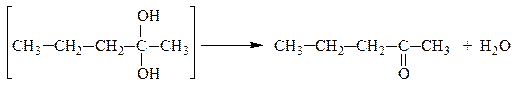
пентанон-2
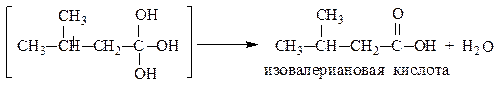
Номенклатура.При составлении рациональных названий обычно спирты рассматривают как замещенный метиловый спирт (карбинол). Названия радикалов перечисляют по старшинству (по мере увеличения количества атомов углерода и степени разветвленности). В случае одинаковых радикалов используют умножающие приставки (ди- и три-). Как видно из названий приведенных соединений по IUPAC, их получают из названий углеводородов, соответствующих длине главной углеродной цепи с добавлением суффикса «-ол», с указанием числа гидроксильных групп (диол, триол и т.д.) и цифр, указывающих на их положение в цепи (или в цикле).
Изомерия.
1. Изомерия углеродного скелета:
СH3–CH2–CH2–CH2–OH СH3–CH–CH2–OH
│
СH3
бутиловый спирт изобутиловый спирт
2. Изомерия положения гидроксильной группы или изомерия взаимного
расположения нескольких гидроксильных групп:
СH3–CH2–CH2–CH2–OН 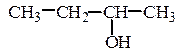
бутанол-1 бутанол-2
3. Изменение порядка связей между атомами в молекуле может привести к
образованию изомерных веществ, принадлежащих различным классам
органических соединений:
CH3–CH2–OH CH3–O–CH3
этиловый спирт диметиловый эфир
4. Пространственная изомерия (цис-транс-изомерия), как например:

цис-2-метилциклопентанол-1 транс-2-метилциклопентанол-1
Способы получения
1). Из оксида углерода (II) и водорода(катализаторы: Cr2O3, ZnO, Fe, Co)
катализатор
n CO + 2 n H2 ¾¾¾¾® CnH2n+1OH + (n-1) H2O
T
2). Гидратация алкенов – присоединение воды по двойной связи по правилу Марковникова: атом водорода присоединяется к более гидро-генизированному, а гидроксильная группа – к менее гидрогенизированному атому углерода при двойной связи; реакция АЕ протекает через образование карбкатиона, легкость образования и стабильность которого уменьшается в ряду: третичный > вторичный > первичный:
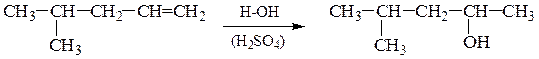
Гидратация протекает в присутствии катализаторов – Al2O3 , H3PO4, H2SO4.
3). Гидроборирование-окисление – является примером присоединения воды по двойной связи, но в отличие от классической гидратации, присоединение к несимметричным алкенам происходит против правила Марковникова, что дает возможность получать первичные спирты:
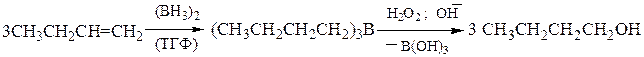
Гидроборирование-окисление осуществляется как цис-присоединение. Исходный диборан получают по реакции:
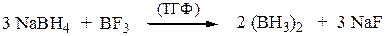
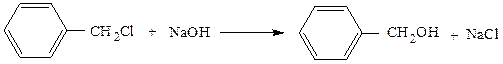
4)Гидролиз галогенопроизводных:

5) Магнийорганический синтез – удобный метод синтеза органических соединений различных классов, в котором используются доступные реактивы Гриньяра RMgX.
Первичные спирты получают реакциями с формальдегидом и окисью этилена; при этом происходит удлинение углеродной цепи на один или два атома соответственно:
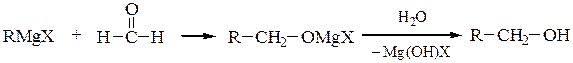
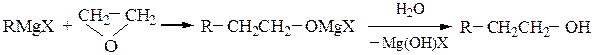
Вторичные спиртыполучают взаимодействием с альдегидами, окисями монозамещенных этиленов или с производными муравьиной кислоты:
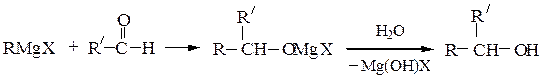
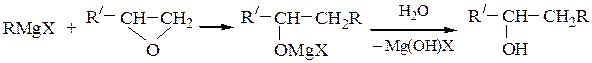
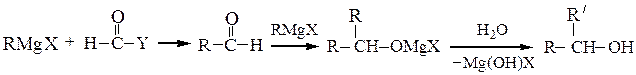
Третичные спиртыполучают из кетонов или сложных эфиров:
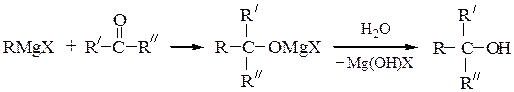
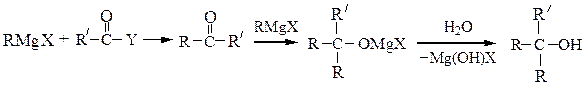
(где Y = OR'')
При получении третичных спиртов на последней стадии следует учитывать легкость их дегидратации в сильно кислой среде до алкенов.
6) Гидролиз сложных эфировв кислой или щелочной среде приводит к спиртам и карбоновым кислотам (или их солям):
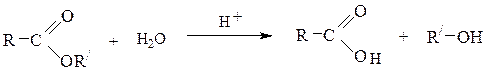
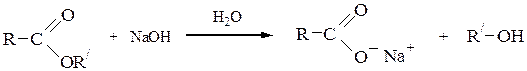
Аналогичным образомобразуется глицерин при гидролизе жиров (cм. с. ).
7) Восстановление альдегидов приводит к первичным спиртам, кетонов –
ко вторичным спиртам.
O O ОН
║ ║ │
R–C–H —→ R–CH2–OH R–C– R —→ R–CH–R'
O
║ LiAlH4
СH3–CH2–CH2–C–H ——→ СH3–CH2–CH2–CH2–OH
масляный альдегид бутиловый спирт
O OH
║ LiAlH4 │
СH3–CH2–CH2–C–CH3 ——→ СH3–CH2–CH2–CH–CH3
пентанон-2 пентанол-2
Первичные спирты также образуются в результате восстановления карбоновых кислот или сложных эфиров:
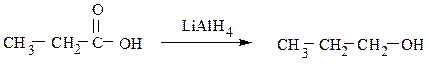
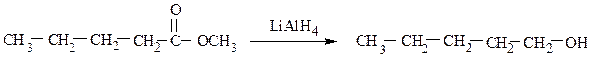
Дата добавления: 2017-09-19; просмотров: 19675;
