Алюминийорганический синтез
Олигомеризация олефинов
Олигомеризация — процесс полимеризации при участии небольшого количества (2-4) мономерных звеньев (соответственно олигомеры называют димерами, тримерами и т.п.) возможен лишь при Т<5000С. Олигомеризация – это равновесная реакция протекает с выделением Q.
2CnH2n  C2nH4n (- DH =63-105 кДж/моль)
C2nH4n (- DH =63-105 кДж/моль)
Параметры процесса
Давление способствует образованию олигомеров — реакция идет с уменьшением объема. Легче полимеризуются линейные олефины, труднее - разветвленные, т. к. они легче деполимеризуются (диизобутен — уже при 120—1500С).
Кислотная олигомеризация проводится с использованием гетерогенного катализатора Ипатьева (пропитанные о — фосфорной кислотой кизельгур, асбест или др. материалы). При 200—3000С кислота дегидратируется с образованием пиро— и метафосфорных кислот;
200-2500С 250-3000С
2H3РО4 ¾¾¾® H4Р2О7 ¾¾¾® 2HРО3
---орто--- -H2О --пиро-- - H2О --мета—
Каталитическую активность проявляют только орто— и пирокислоты. Поэтому для избежания дегидратации в реакционную массу добавляют водяной пар, сдвигающий равновесие в левую сторону.
Механизм реакции
Олигомеризация протекает по ионному механизму с промежуточным образованием карбокатиона (RС+),который образуется в результате присоединения к олефину протона, отдаваемого кислотой. Дальнейший процесс идет путем присоединения карбокатиона по двойной связи с передачей протона олефину (образуются многочисленные изомеры).
H3РО4 _  (H2РО4)- + Н+
(H2РО4)- + Н+
+
СН2 = СН-СН3 + Н+  (СН3 )2 СН
(СН3 )2 СН
+
(СН3 )2 СН + СН2 = СН-СН3 ¾® (СН3 )2 СН - СН - СН – СН3 ¾® и т.д.
Способность к олигомеризации обусловлена влиянием заместителей:
СН3 - С(СН3 ) = СН2 >> СН3 — СН = СН2 >> СН2 = СН2
Для полимеризации изобутена требуются более мягкие условия, чем для других олефинов с меньшим числом С—атомов.
Р = 3-6 МПа;
Т = 320-3500С (этилен);
180-2400С (пропилен);
130-1700С (изобутен).
Реакторы: -
-кожухотрубные, с отводом тепла кипящим теплоносителем;
-колонного типа с несколькими сплошными слоями катализатора и подачей между ними жидкой исходной фракции, испарением которой обеспечивается съем тепла реакции.
Принципиальная схема реакторного блока(колонного типа)
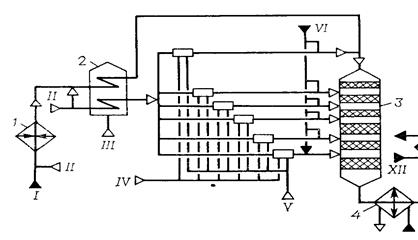
1-низкокипящие олефины
11- водяной пар
111- топливный газ
1V - нет
V – насыщенный водяной пар
V1 – ортофосфорная кислота
От продуктов реакции отгоняются в начале — низкокипящий олефин, затем низшие олигомеры (возвращаются на полимеризацию), затем целевой олигомер (остаток - высшие олигомеры, количество которых стараются свести к минимуму).
Димеризация олефинов применяется для получения олефинов С5—С7— ценных веществ для других синтезов или мономеров для сополимеризации с низшими олефинами
( Р=10 МПа, Т=150—1700С) степень конверсии исходного олефина 10%.
Катализаторы: АL—органические соединения, комплексы переходных металлов, щелочные металлы (суспензии в масле и на носителе).
Катализ — отрыв протона от олефина с образованием его аниона:
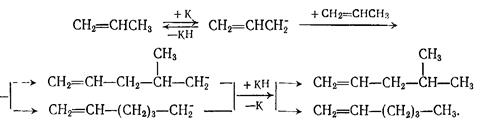
Алюминийорганический синтез
АL—органический синтез состоит в олигомеризацни этилена и применяется для получения линейных a—олефинов с числом С—атомов = 18—20, используемых в процессе производства ПАВ.
В основе его лежат реакции роста и вытеснения алкильных групп через промежуточное образование донорно -акцепторного комплекса:
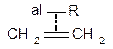
а1-R + СН2 = СН2 ——® ——® а1 – СН2 - СН2R
В случае гомологов этилена АL связывается с наиболее гидриро ванным С — атомом.
Схема процесса включает стадии:
1) Последовательный рост алкильных групп происходит статистически:
а1-С2 Н5 + n СН2 = СН2 ——® а1-(-СН2 – СН2 -)n – С2 Н5 . (1)
2) Вытеснение алкильных групп состоит в расщеплении а1-алкилов на олефин и а1—гидрид (а1—Н):
а1- (-СН2 – СН2 -) – С2 Н5 ¾——® СН2 = СН – (-СН2 – СН2 )n-1 - С2 Н5(2)
-(al - H)
(затем алюминийгидрид реагирует вновь с олефином, образуя а1-алкил).
Реакция (2) имеет более высокую энергию активации, чем реакция (1), поэтому ее осуществляют при более высокой температуре или в присутствии катализаторов (никель диспергированный или на носителях).
Двухстадийный метод - раздельное проведение реакций (1) и (2). В первый реактор вводят триэтилалюминий (ТЭА) и этилен.
Продукт разлагают во втором реакторе.
1 стадия; Т=100—1300С, Р=9МПа
2 стадия; Т=280-3000С (в атмосфере этилена) или Ni—катализатор.
Одностадийный процесс основан на совмещении реакций (1) и (2) при
Т= 2000С, когда скорости (1) и (2) реакций сравнимы по величине.
Сравнение 2-х методов синтеза
| Показатели | Двухстадийный процесс | Одностадийный процесс |
| Технология Давление, МПа Рециркуляция ТЭА Отделение ТЭА от продуктов Выход a-олефинов целевых фракций (С10 – С18) | Усложнена 1 моль/ 3моля получаемого a-олефина Трудность отделения Высокий (75-80%) | Упрощена 20-30 Без рециркуляции (расход ТЭА= 1моль на 250 моль получаемого a-олефина) Без регенерации Низкий (40-45%), поэтому степень конверсии огра-ичена 60-70%. |
Увеличение выхода целевых олефинов С18—С20 в одностадийном процессе достигается дополнением его диспропорционированием нецелевых фракций < С8 и > С20 (по 20—30%) после предварительной изомеризации в олефины с внутренним положением двойной связи.
При этом выход целевых фракций С10—С18 возрастает до 90%, хотя около половины их получается не в виде a—олефинов, а в виде олефинов с внутренней двойной связью. Последние также представляют ценность для синтеза ПАВ, при производстве которых все равно происходит изомеризация положения двойной связи (алкиларенсульфонаты, оксиэтилированные алкилфенолы).
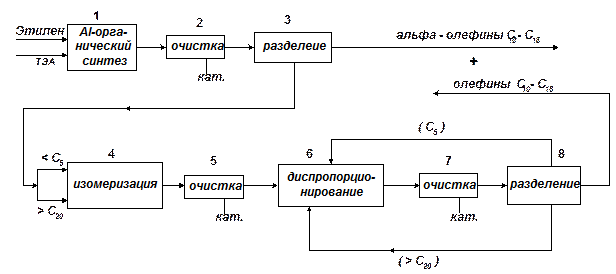 |
Блок - схема производства линейных олефинов С10—С18
В блоке 2 очищают (a—олефины от а1—алкилов (ТЭА);
В блоке 5 очищают продукты изомеризации от катализатора;
В блоке 7 очищают продукты диспропорционнрования от катализатора
Отходы — высококипящие вещества в виде кубовых жидкостей в блоках разделения 5 и 8.
| <== предыдущая лекция | | | следующая лекция ==> |
| Построение стрелочной диаграммы | | | Модели подходов к телесным и психическим феноменам в психотерапии и гештальт-терапии |
Дата добавления: 2017-08-01; просмотров: 1804;
