Нуклеофильное присоединение (AN)) по карбонильному
углеродному атому:
Реакции присоединения по С=О выражаются схемой:
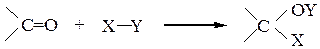
Действие C-нуклеофилов.Углеродцентрированные нуклеофилы являются карбанионами, т.к. атом углерода в обычных органических соединениях не имеет свободной неподеленной пары электронов. Карбанионы образуются в результате отрыва протона от С–Н-кислот. Нуклеофилами такого типа в реакциях альдегидов и кетонов являются цианид-анион (–С≡N), алкинид-анионы (–С≡С–R), реактивы Гриньяра (R–MgCl), альдегиды, кетоны и др. карбонильные соединения в присутствии оснований.
1) Cинильная кислота (в присутствии катализатора основного характера) с карбонильными соединениями образует α-гидроксинитрилы:
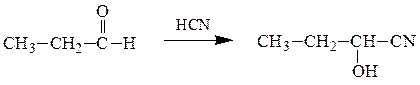
Механизм реакции:
H–C≡N + –OH ¾¾® –С≡N + H2O
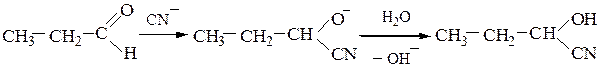
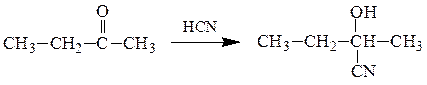
2) Магнийорганические реагенты RMgX c карбонильными соединениями
образуют смешанные алкоголяты, которые при гидролизе образуют спирты.
Формальдегид с реактивами Гриньяра образует первичные спирты, а с остальные альдегиды – вторичные спирты. Кетоны в данной схеме дают третичные спирты:
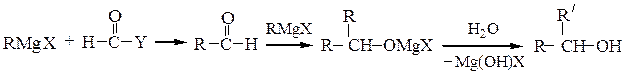
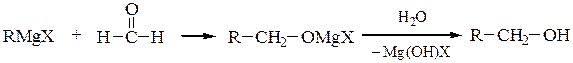
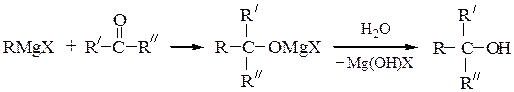
3) Получение ацетиленовых спиртов присоединением ацетиленовых
углеводородов к карбонильным соединениям в присутствии оснований (например, NaNH2):
НС≡СH + НСН=О → НС≡С–СН2–ОН
НС≡С–СН2–ОН + НСН=О → НО–СН2–С≡С–СН2–ОН
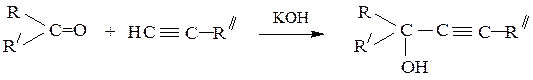
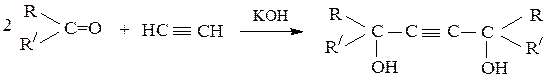
Действие О- и S-нуклеофилов.Кислород и серосодержащие нуклеофилы вступают в реакции по положительно заряженному карбонильному атому углерода за счет свободной пары электронов на атомах азота и серы.
1) С водой, как со слабым нуклеофилом, реагируют самые активные карбонильные соединения. Только они могут образовывать нестойкие гемм-диолы. В свою очередь, дегидратация этих гидратных форм приводит к карбонильным соединениям, например формальдегид:
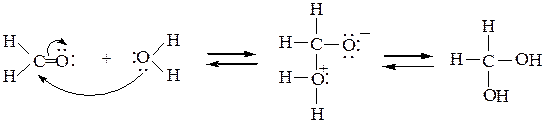
Положение равновесия зависит от стерических и электронных факторов. Электроноакцепторные заместители (например, атомы хлора), а также катализ минеральной кислотой смещают равновесие в сторону образования диолов, ускоряя прямую реакцию за счет увеличения электрофильности карбонильного углеродного атома. Так, ниже приведено содержание гидратных форм некоторых альдегидов и кетонов в водных растворах при рН 7: формальдегид, хлораль (трихлоруксусный альдегид), гексафторацетон – по 100%, уксусный альдегид – 58%, ацетон, бензальдегид – очень мало.
2) Cпирты (в зависимости от соотношения реагентов) в кислой среде
образуют полуацетали и ацетали:
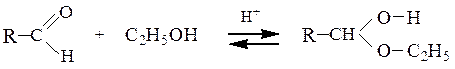
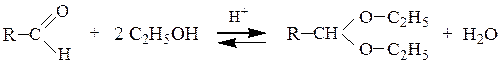
Рассмотрим механизм образования ацеталей и кеталей на примерах взаимодействия бензальдегида с метанолом и ацетона с этиленгликолем в условиях катализа минеральной кислотой:
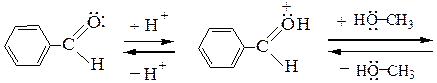
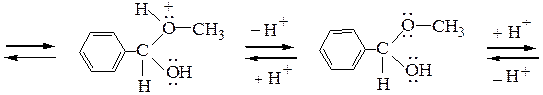
Полуацеталь
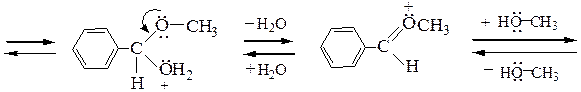
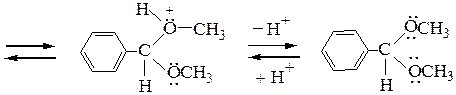
ацеталь
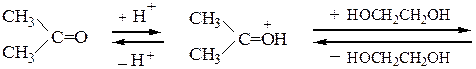
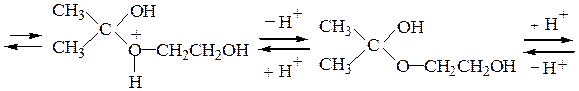
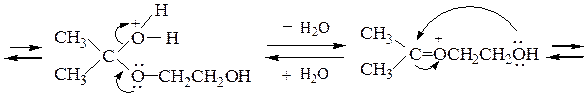
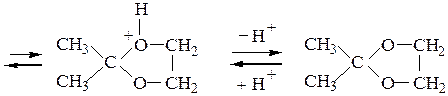
В отличие от альдегидов, образующих ацеталив результате взаимодействия со спиртами в условиях катализа минеральной кислотой, кетоны из-за их меньшей реакционной способности в подобную реакцию вступают редко. Для получения кеталей часто приходится использовать другие методы, например реакцию кетонов с ортомуравьиным эфиром:
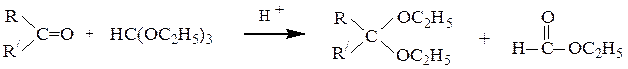
Ацетали и кетали легко гидролизуются в кислой среде (см. схему механизма реакции их образования в обратном направлении). В щелочной среде эти вещества гидролизу не подвергаются, так как гидроксилу не с чем реагировать в молекулах этих соединений. Поскольку ацетали и кетали не окисляются, не реагируют с восстановителями и устойчивы к действию оснований, этими свойствами пользуются, когда необходимо защитить карбонильную группу. Например, если надо окислить акролеин в глицериновый альдегид, то перед действием на исходное вещество перманганатом калия превращают альдегидную группу в ацетальную, которая не боится действия окислителя. Выполнив окисление по двойной связи, снимают ацетальную защиту с альдегидной группы кислотным гидролизом в мягких условиях:
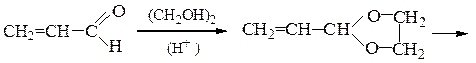
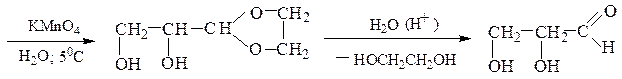
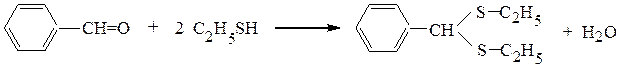
Аналогично альдегиды и кетоны образуют с тиоспиртами тиоацетали и тиокетали. Эти реакции идут несколько легче, чем со спиртами, т.к. атом серы более нуклеофилен, чем атом кислорода, ибо последний, обладая большим сродством к электрону, сильнее удерживает электронную пару при себе:
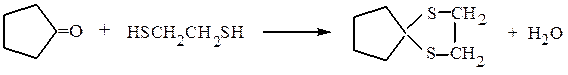
3) Гидросульфит натрия (NaHSO3) образует кристаллические осадки
гидросульфитных производных с альдегидами, метилкетонами и пространственно незатрудненными циклическими кетонами:
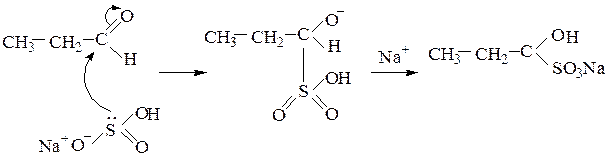
Способность образовывать гидросульфитные производные используют для отделения и очистки карбонильных соединений указанных типов от примеси веществ, с которыми гидросульфит натрия не вступает в реакцию. Карбонильное соединение переводят в осадок гидросульфитного производного, отделяют фильтрованием и регенерируют кипячением в содовом растворе или действием кислотой:
R-CH(OH)SO3Na + Na2CO3 ¾® 2 R-CHO + 2 Na2SO3 + CO2 + H2O
R-CH(OH)SO3Na + HCl ¾® R-CHO + NaCl + SO2 + H2O
Действие N-нуклеофилов. Аммиак и его производные (NH2–X) реагируют по карбонильному атому углерода за счет свободной пары электронов атома азота, причем обычная реакция AN завершается отщеплением молекулы воды от продукта реакции:
1) Аммиак. Взаимодействие формальдегида с аммиаком приводит к образованию уротропина (гексаметилентетраамина):
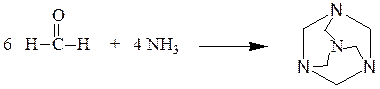
При действии аммиака на альдегиды или кетоны образуются имины (альдимины или кетимины соответственно), например:
СН3–СН2–СН2–СН=О + NН3 ® СН3–СН2–СН2–СН=NH
Однако, имины, как правило, неустойчивы и спонтанно полимеризуются.
При обработке водой имины легко гидролизуются до исходных карбонильных соединений:
СН3–СН2–СН2–СН=NH + 2 H2O ® СН3–СН2–СН2–СН=О + NН4OH
При взаимодействии альдегидов с аммиаком в присутствии водорода и никелевого катализатора происходит восстановительное аминирование с образованием амина.
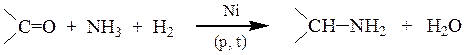
2) Карбонильные соединения с первичными аминами образуют N-замещенные имины – соединения общей формулы RR¢C=NR¢¢. Кетоны реагируют медленнее, чем альдегиды. Соединения, содержащие хотя бы один ароматический радикал отличаются большой устойчивостью; их называют основаниями Шиффа.
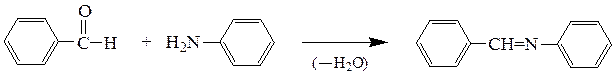
Бензальанилин
Гидролиз полученных соединений дает исходные вещества, гидрирование – вторичные амины.
3) Гидроксиламин (NH2OH) с карбонильными соединениями образуют производные, называемые оксимами:
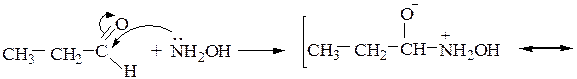
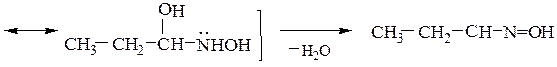
Например, диацетил (бутандион-2,3) c избытком гидроксиламина образует диметилглиоксим (реактив Чугаева), применяемый в аналитической химии для обнаружения катиона Ni 2+ :
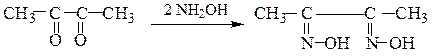
Восстановлением оксимов можно получать первичные амины.
Оксимы – кристаллические устойчивые соединения, применяются для идентификации карбонильных соединений.
4) С гидразином (NH2NH2) карбонильные соединения образуют два типа производных – гидразоны и азины.
Гидразоны – продукты взаимодействия эквимолярных количеств карбонильного соединения (альдегида или кетона) и гидразина:
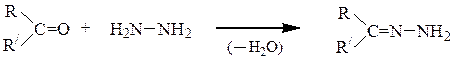
При соотношении реагентов 2:1 образуются азины карбонильных соединений.
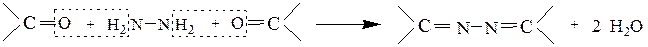
Монозамещенные гидразины (фенилгидразин, п-нитрофенилгидразин, 2,4-динитрофенилгидразин) дают только один продукт:
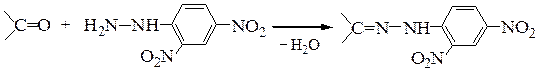
Образующиеся фенилгидразоны представляют собой легко очищаемые кристаллизацией производные с четкими температурами плавления; они очень удобны для химической идентификации карбонильных соединений. Замещенные фенилгидразоны используют также для синтеза азотсодержащих гетероциклических соединений – гомологов индола по методуФишера, представляющим собойвнутримолекулярную циклизацию фенил-гидразонов альдегидов и кетонов ароматического ряда в присутствии ZnCl2 и H2SO4:
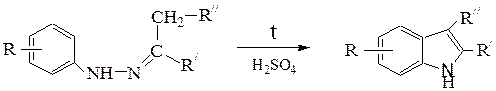
5) Семикарбазид (NH2NHСONH2) при взаимодействии с альдегидами и кетонами образуют семикарбазоны, например:
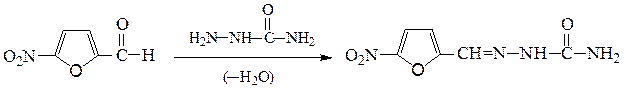
семикарбазон 5-нитрофурфурола
(фурацилин)
Следует отметить, что два атома азота семикарбазида, сопряженные с группой С=О получают частичный положительный заряд в результате образования резонансных структур:
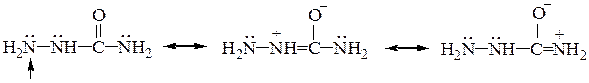
поэтому только атом азота, отмеченный стрелочкой является нуклеофильным и участвует в этой реакции.
Действие галогеннуклеофилов.Альдегиды и кетоны по реакции AN реагируют с галогенидами фосфора, например:
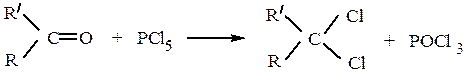
Продуктами являются геминальные дигалогенпроизводные. Они образуются по следующей схеме:
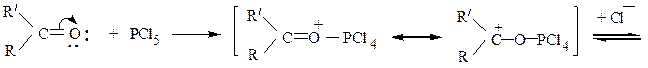
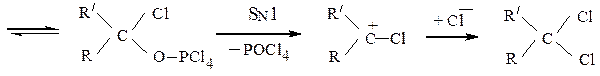
Дата добавления: 2017-09-19; просмотров: 1319;
