Нуклеофильное замещение
При нуклеофильном замещении нуклеофил атакует молекулу субстрата, предоставляя ей для образования новой связи свои электроны. Электроны разрывающейся связи уходят вместе с освобождающимся ионом. Такие ионные реакции идут преимущественно в жидкой фазе, поскольку растворитель стабилизирует образующиеся ионы за счет сольватации, что невозможно в газовой фазе.
Нуклеофильное замещение позволяет вводить в молекулу органического соединения большое количество функциональных групп, способных выступать в роли нуклеофилов. Например:
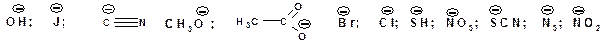
В роли нуклеофилов могут выступать и нейтральные молекулы, например:
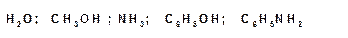
Примеры реакций с участием бромистого этила, в качестве субстрата, приведены ниже:
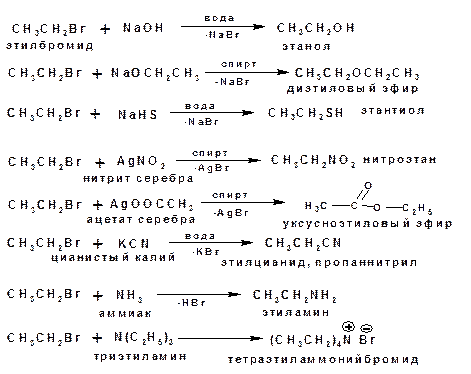
Особенностью реакций нуклеофильного замещения является то, что они одни из самых распространенных в органической химии, а соответственно одни из самых изученных. В частности изучение кинетики реакции нуклеофильного замещения. Химическая кинетика - это изучение изменения концентрации реагентов или продуктов во времени. Изменение характеризуется производной концентрации по времени dc/dt. Устанавливают взаимосвязь производной с концентрациями реагентов или, при необходимости, с концентрациями продуктов.
Изучение изменения концентрации реагентов во времени в условиях реакции нуклеофильного замещения показало, что возможны два случая:
В первом случае изменение концентрации пропорционально только концентрации субстрата dc/dt = К[галоидный алкил]
Во втором случае изменение концентрации пропорционально концентрации субстрата и концентрации нуклеофильной частицы –
dc/dt = К[галоидный алкил]×[нуклеофил]
Механизм, соответствующий первому случаю назван мономолекулярным нуклеофильным замещением и обозначается SN1.
Механизм, соответствующий второму случаю назван бимолекулярным нуклеофильным замещением и обозначается SN2
1.4.2. Механизм SN1. Мономолекулярное замещение
По механизму SN1, например протекает гидролиз трет-бутилбромида:
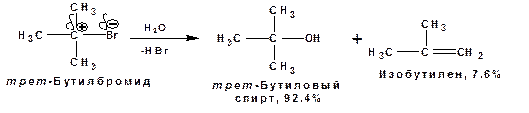
В механизме SN1 различают следующие стадии:
На первой стадии происходит ионизация галогенопроизводного с образованием карбкатиона и бромид-иона. Эта стадия является скоростьлимитирующей и характеризуется наиболее высокой энергией активации:
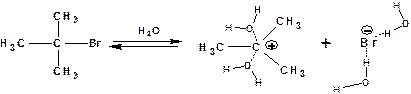
Бромид-ион образует с молекулами воды водородные связи и тем самым стабилизируется. Образующийся карбкатион также стабилизируется сольватацией растворителем. Но большее значение имеет стабильность самого карбкатиона. Он должен быть стабилизирован внутримолекулярными электронными эффектами, т.н. быть третичным или находиться в сопряжении с π-электронной системой (быть резонансно-стабилизированным).
На второй стадии происходит быстрое взаимодействие карбкатиона с нуклеофилом, в частности с водой:
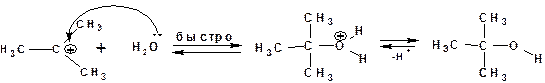
Быстрое присоединение молекулы воды к карбкатиону приводит к катиону трет-бутилгидроксония, кторый затем отщепляет протон с образованием трет-бутилового спирта. Этой схеме механизма соответствует следующая энергетическая диаграмма:

Дата добавления: 2017-08-01; просмотров: 814;
