АРЕНЫ (АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ)
К ароматическим относятся циклические соединения, молекулы которых, содержат плоскую замкнутую сопряженную систему кратных связей из (4n+2) p-электронов (правило Хюккеля). Простейшим является бензол С6Н6. Гомологи бензола – соединения, образованные заменой одного или нескольких атомов водорода в молекуле бензола на углеводородные радикалы (R): С6H5–R (алкил- бензолы), R–C6H4–R (диалкилбензолы) и имеют общую формулу СnН2n-6
Строение бензола. Каждый атом углерода в молекуле бензола находится в состоянии sp2-гибридизации и связан с двумя соседними атомами углерода и атомом водорода тремя s-связями. Валентные углы между каждой парой s-связей равны 120°. Скелет s-связей представляет собой правильный шестиугольник, в котором все атомы углерода и все s-связи С-С и С-Н лежат в одной плоскости. р-Электроны всех атомов углерода взаимодействуют между собой путем бокового перекрывания соседних 2р-АО, расположенных перпендикулярно плоскости s-скелета бензольного кольца. Они образуют единое циклическое p-электронное облако, расположенное над и под плоскостью кольца. Все связи С-С в бензоле равноценны, их длина равна 0,140 нм, что соответствует промежуточному значению между длиной простой связи (0,154 нм) и двойной (0,134 нм). Это означает, что в молекуле бензола между углеродными атомами нет простых и двойных связей, как, предложено в формуле Ф.Кекуле в 1865 г., а все они выровнены Поэтому структурную формулу бензола изображают в виде правильного шестиугольника (s-скелет) и кружка внутри него, обозначающего делокализованные p-связи.
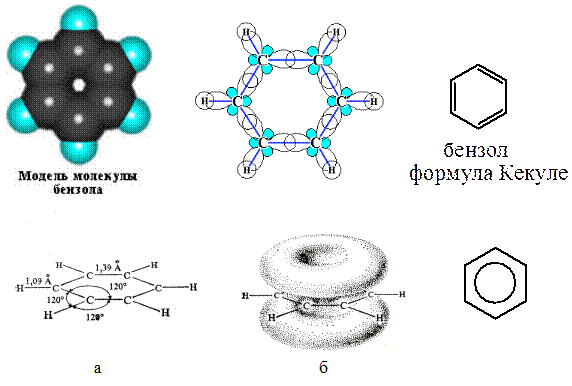
Рис. 8. Строение молекулы бензола и его структурные формулы.
Номенклатура.Широко используются тривиальные названия – толуол (метилбензол), ксилолы (диметилбензолы), кумол (изопропилбензол), стирол (винилбензол) и др.; систематические названия состоят из названия углеводородного радикала (приставка) и слова бензол (корень). Если радикалов два или более, их положение указывается номерами атомов углерода в кольце, с которыми они связаны. Нумерацию кольца проводят так, чтобы номера радикалов были наименьшими. Для дизамещенных бензолов положение заместителей указывают также перед названием соединения приставками: орто- (о-) заместители у соседних атомов углерода кольца (1,2-); мета- (м-) заместители через один атом углерода (1,3-); пара- (п-) заместители на противоположных сторонах кольца (1,4-).
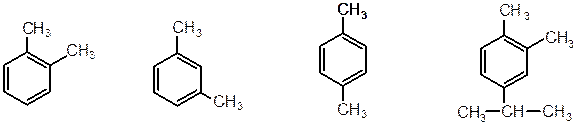
о-ксилол м-ксилол n-ксилол 1,2-диметил-4-изопропил-
1,2-диметилбензол 1,3-диметилбензол 1,4-диметилбензол бензол
Изомерия (структурная):
1) положения заместителей для ди-, три- и тетра-замещенных бензолов (например, о-, м- и п-ксилолы);
2) углеродного скелета в боковой цепи, содержащей не менее 3-х атомов углерода (н-пропилбензол и изопропилбензол);
3) изомерия заместителей R, начиная с R=С2Н5. Например, молекулярной формуле С8Н10 соответствует 4 изомера: три ксилола CH3-C6H4-CH3 (о-, м-, п-) и этилбензол C6H5-C2H5.
Пространственная изомерия относительно бензольного кольца в алкилбензолах отсутствует.
Природные источники и методы получения ароматических углеводородов. Основными промышленными источниками бензола и его гомологов являются каменный уголь и нефть. При коксовании каменного угля образуется каменноугольная смола, из которой выделяют бензол, толуол, нафталин и другие соединения.
1. Ароматизация нефти:
а) дегидроциклизация (дегидрирование и циклизация) алканов (С 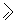 6) в присутствии катализатора:
6) в присутствии катализатора:
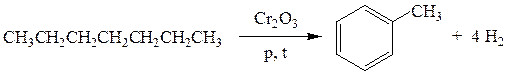
б) дегидрирование циклоалканов:
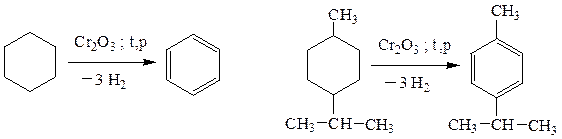
2. Циклотримеризация алкинов над активированным углем:
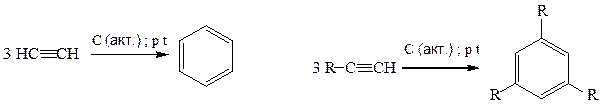
Таблица 6. Физические свойства ароматических углеводородов
| Название | Формула | Т пл. 0С | Т.кип. 0 С | ρ, г· см-3 |
| Бензол Толуол о-Ксилол м-Ксилол п-Ксилол 1,2,3-триметилбензол 1,2,4-триметилбензол 1,3,5-триметилбензол (мезитилен) 1,2,3,4-тетраметилбензол 1,2,3,5-тетраметилбензол 1,2,4,5-тетраметилбензол Пентаметилбензол Гексаметилбензол Этилбензол Гексаэтилбензол Пропилбензол Изопропилбензол (кумол) Бутилбензол изо-Бутилбензол втор-Бутилбензол трет-Бутилбензол 1-метил-4-изопропил- бензол (цимол) транс-1,2-дифенилэтилен (транс-стильбен) цис-1,2-дифенилэтилен (цис-стильбен) Дифенилметан Трифенилметан Бифенил Нафталин Антрацен Флуорен Инден Фенантрен Азулен | С6H6
С6H5CH3
1,2-С6H4(CH3)2
1,3-С6H4(CH3)2
1,4-С6H4(CH3)2
1,2,3-С6H3(CH3)3
1,2,4-С6H3(CH3)3
1,3,5-С6H3(CH3)3
1,2,3,4-С6H2(CH3)4
1,2,3,5-С6H2(CH3)4
1,2,4,5-С6H2(CH3)4
С6H(CH3)5
С6(CH3)6
С6H5CH2CH3
С6(CH2CH3)6
С6H5(CH2)2CH3
С6H5СН(CH3)2
С6H5(CH2)3CH3
С6H5CH2СН(CH3)2
С6H5CH(CH3)СН2СН3
С6H5C(CH3)3
1,4-СН3С6Н4СН(CH3)2
транс-
С6Н5–СН=СН–С6Н5
цис-
С6Н5–СН=СН–С6Н5
С6Н5–СН2–С6Н5
(С6Н5)3СН
С6Н5–С6Н5
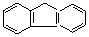
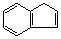
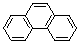
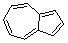
| + 5,5 - 93 - 28 - 54 - 25 - 44 - 45 - 6,5 - 24 - 95 - 100 - 96 - 81 - 83 - 58 - 70 + 1 70,5 - 2 ─ | 159.5 173,5 145 (13 мм рт.ст) | 0,878 0,867 0,880 0,864 0,861 0,895 0,876 0,864 0,902 0,867 0,830 0,862 0,862 0,860 0,867 0,864 0,867 0,857 0,970 1,000 |
Физические свойстваБензол и его ближайшие гомологи – бесцветные жидкие вещества (таблица 6), нерастворимы в воде, но хорошо растворяющиеся во многих органических жидкостях. Легче воды огнеопасны и токсичны.
Дата добавления: 2017-09-19; просмотров: 1961;
