III. Реакции окисления и восстановления
1) Окисление альдегидов
Альдегиды чрезвычайно легко окисляются до соответствующих кислот.
а) реакция серебряного зеркала:
O O
СH3-C +2[Ag(NH3)2]OH  3NH3 + H2O + 2Ag + CH3-C
3NH3 + H2O + 2Ag + CH3-C
H ONH4
Реакцию эту дают только альдегиды, поэтому она применяется как качественная реакция на альдегиды.
б) реакция Фелинга
Реактив Фелинга – это Cu(OH)2, растворенный в сегнетовой соли, с которой она образует комплексный алкоголят.
O O
CH3-C +2Cu(OH)2  Cu2O + 2H2O + CH3-C
Cu2O + 2H2O + CH3-C
H OH
закись меди
(осадок красного цвета)
Качественная реакция на альдегиды.
в) окисление перекисью водорода
O O
2H-С + H2O2  2 H-C + H2
2 H-C + H2
H OH
В этой реакции альдегид тоже ведет себя как восстановитель настолько активный, что восстанавливает перекись не до воды, а до водорода.
г) окисление на воздухе при освещении идет по цепному свободно-радикальному механизму.
O O
u: CH3-C 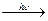 H. + CH3-C.
H. + CH3-C.
H
O O
p: CH3-C. + O2  CH3-C
CH3-C
O-O.
O O O O
CH3-C + CH3-C  CH3-C + CH3-C.
CH3-C + CH3-C.
O-O. H O-O-H
надуксусная кислота
2) Окисление кетонов протекает значительно труднее. Кетоны не окисляются слабыми окислителями (аммиакат гидроокиси серебра – реактив Фелинга). Сильными окислителями они окисляются с разрывом цепи. Окисление кетонов происходит в соответствии с правилами Попова:
1. Действие окислителя направлено в основном на соседний с карбонилом атом углерода, что приводит к разрыву цепи и образованию двух молекул кислот.
2. У несимметричных кетонов главным направлением реакции является окисление менее гидрированного соседнего звена.
CH3-C-CH2-CH3+O  CH3-C-CH-CH3
CH3-C-CH-CH3 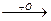 CH3-C-C-CH3
CH3-C-C-CH3 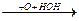
O O OH -H2O O O
O оксикетон дикетон
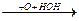 2CH3-C-OH
2CH3-C-OH
Дата добавления: 2017-06-02; просмотров: 833;
