Кислоты (гидроксиды кислотного характера)
Кислоты – сложные вещества, состоящие из атомов водорода, способных замещаться на атомы металла, и кислотных остатков. Записываются общей формулой 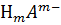 , где А – кислотный остаток. С позиций теории электролитической диссоциации, кислоты– это электролиты, которые при диссоциации в растворах образуют катионы водорода и анионы кислотных остатков.
, где А – кислотный остаток. С позиций теории электролитической диссоциации, кислоты– это электролиты, которые при диссоциации в растворах образуют катионы водорода и анионы кислотных остатков.
Кислоты образуются при взаимодействии кислотных оксидов с водой. Водные растворы кислот имеют кислый вкус и окрашивают лакмус в красный цвет. Кислоты представляют собой жидкости (HNO3, H2SO4) или твердые вещества (H3BO3, H2SiO3, HJO3). Многие кислоты хорошо растворимы в воде, растворы их имеют кислый вкус, разъедают растительные и животные ткани, особенно концентрированные кислоты. По составу кислоты классифицируются по следующим признакам:
1) по наличию кислорода:
- бескислородные, в своем составе не содержат атомов кислорода, например: HCl, HBr, HI, H2S, HCN и др.;
- кислородсодержащие, содержат в своем составе атомы кислорода, например, H2SO4, H2CO3, HNO3, H3PO4 и др.
2) по количеству атомов водорода, способных замещаться атомами металлов:
- одноосновные, содержат один атом водорода, способный замещаться на катион металла: HCl, HBr, HI, HNO3 и др;
- двухосновные, содержат два атома водорода, способных замещаться на катионы металлов: H2S, H2SO4, H2SO3, H2СO3 и др;
- многоосновные, содержат три и более атомов водорода, способных замещаться на катионы металлов: H3PO4, H3AsO4, H4Р2O7 и др.
3) по способности к диссоциации:
- сильные кислоты почти полностью необратимо распадаются на ионы (в одну ступень), образуя растворы сильных электролитов. Растворы сильных кислот хорошо проводят электрический ток:
НNO3 = H+ + NO3- H2SO4 = 2H+ + SO4 2-
- слабые кислоты в растворах диссоциируют частично (в малой степени), обратимо и по ступеням. Растворы этих кислот являются слабыми электролитами и плохо проводят электрический ток. В растворах слабых кислот существует равновесие между недиссоциированными молекулами и ионами, например:
1 ступень Н2СО3 ⇄ Н+ + НСО3- ;
2 ступень НСО3- ⇄ Н+ + СО32- .
Слабых кислот значительно больше, чем сильных, основные представители которых сильных перечислены ниже: иодоводородная HI, бромоводородная HBr , хлороводородная (соляная) HCl, хлорная HClO4 , хлорноватая HClO3 , серная H2SO4 , селеновая H2SeO4 , дихромовая Н2Сr2О7 , азотная HNO3, марганцовая НМnО4.
Графические формулы кислот.По сравнению с основаниями несколько сложнее. И чтобы составлять их правильно существует алгоритм, который подходит для всех классов неорганических соединений.
1) Элементы соединяются в соответствии с их валентностью.
2) Валентность кислорода всегда равна двум, а водорода – единице.
3) Водород в кислородсодержащих кислотах соединяется через атом кислорода с центральным, кислотообразующим атомом. При этом образуется –ОН группа которая присутствует во всех кислородсодержащих кислотах. Исключение составляют только пероксокислоты (вещества, содержащие пероксо-группу H-O-O-). Если в молекуле кислоты кислорода больше, чем водорода, то оставшиеся атомы кислорода соединяются только с кислотообразующим атомом при помощи двойной связи.
Например:
4) Валентность центрального атома определяется через валентность кислорода и водорода. Для этого количество атомов кислорода в составе молекулы умножается на два, т.к. его валентность равна двум (смотри пункт 2). Из полученного произведения вычитается количество атомов водорода. Дополнительного действия умножения не требуется, т.к. валентность водорода равна одному.
Например, рассчитаем валентность (В) фосфора в молекуле ортофосфорной кислоты H3PO4. В(Р) = (4 ∙ 2) – 3 = 5.
5) Если в составе молекулы кислоты присутствуют два и более кислотообразующих атома, то они в первую очередь, соединяются между собой одним атомом кислорода. Оставшиеся атомы кислорода и гидроксо-группы поровну распределяются между кислотообразующими атомами. Следует помнить, что все молекулы в химии имеют ось симметрии.
Например:
Из приведенных выше правил можно сделать вывод, что графические формулы кислот в большинстве своем универсальны. Из них могут быть выделены несколько разновидностей в зависимости от валентности и степени окисления центрального, кислотообразующего атома (табл. 5).
Таблица 7
Дата добавления: 2019-04-03; просмотров: 567;
