Кислотно-основные свойства высших оксидов и их гидроксидов у элементов третьего периода
| степень окисления | +1 | +2 | +3 | +4 | +5 | +6 | +7 |
| формула оксида | Na2O | MgO | Al2O3 | SiO2 | P2O5 | SO3 | Cl2O7 |
| характер оксида | основный | основный | амфотер- ный | кислот- ный | кислот- ный | кислот- ный | кислот- ный |
| формула гидроксида | NaOН | Mg(OH)2 | Al(OH)3 | H2SiO3 | H3PO4 | H2SO4 | HClO4 |
Таким образом, свойства оксидов закономерно изменяются от основных через амфотерные к кислотным. Такой переход справедлив для оксидов всех периодов, кроме первого и седьмого.
Пример 4. Определите характер оксидов N2O3, SrO, SnO, FeO, CO, Mn2O7, TiO2 и подтвердите его соответствующими уравнениями химических реакций. Назовите оксиды и напишите их графические формулы.
Решение:Оксид N2O3 образован атомом неметалла, следовательно, проявляет кислотные свойства, которые можно подтвердить уравнениями химических реакций оксида с раствором щелочи или основным оксидом. В результате образуются соли, в которых атом азота находится в степени окисления (+3), т.е. соли азотистой кислоты:
N2O3 + 2NaOH = 2NaNO2 + H2O;
N2O3 + CaO = Ca(NO2)2.
Графическая формула оксида азота (III) O = N – O – N = O
Оксид SrO образован щелочно-земельным металлом, стронцием, т.е. металлом второй группы главной подгруппы, поэтому проявляет основные свойства, которые можно доказать уравнениями реакций оксида с кислотой или кислотным оксидом:
SrO + H2SO4 = SrSO4 + H2O;
SrO + SO3 = SrSO4 .
Графическая формула оксида стронция Sr = O.
Оксид SnO, несмотря на степень окисления +2, проявляет амфотерные свойства, потому что все оксиды олова облают амфотерными свойствами из-за положения металла в Периодической системе. Олово находится в главной подгруппе четвертой группы. SnO образует соли при взаимодействии и с кислотами, и со щелочами:
SnO + 2HCl = SnCl2 + H2O
SnO + 2NaOH = Na2SnO2 + H2O (при сплавлении).
Графическая формула оксида олова (II) Sn = O.
В оксиде железа FeO степень окисления Fe равна +2. Железо находится в побочной подгруппе восьмой группы, является d-элементом. Но в низшей степени окисления d-элементы, как правило, проявляют основные свойства. Поэтому, оксид железа (II) будет взаимодействовать с кислотами и кислотными оксидами, но не взаимодействует с основаниями. Например:
FeO + H2SO4 = FeSO4 + H2O;
FeO + SiO2 = FeSiO3 (при сплавлении).
Графическая формула оксида железа (II) Fe = O.
Оксид углерода (II) СО образован неметаллом, но он не обладает кислотно-основными свойствами. Оксид углерода (II) принадлежит к малочисленной группе несолеобразующих оксидов.
Графическая формула оксида углерода (II) С = O.
В оксиде марганца Mn2O7 степень окисления Mn равна +7. Марганец находится в побочной подгруппе седьмой группы, является d-элементом. В высшей степени окисления (выше +5) d-элементы, как правило, проявляют кислотные свойства. Поэтому, оксид марганца(VII) Mn2O7 будет взаимодействовать с основаниями и основными оксидами, но не будет взаимодействовать с кислотами и кислотными оксидами.
Mn2O7 + Ba(OH)2 = Ba(MnO4)2 + H2O;
Mn2O7 + K2O = 2KMnO4 .
Графическая формула оксида марганца (VII).
В оксиде титана TiO2 степень окисления Тi равна +4. Титан находится в побочной подгруппе четвертой группы, является d-элементом с амфотерными свойствами. Поэтому TiO2 является амфотерным оксидом. Следовательно, TIO2 может реагировать как с кислотными оксидами, так и с основными, а также взаимодействует с кислотами и со щелочами. Например:
TiO2 + 4HCl = TiCl4 + 2H2O
TiO2 + 2NaOH = Na2TiO3 + H2O (при сплавлении).
Графическая формула оксида титана (IV) О = Ti = O.
Пример 5.Составьте эмпирические формулы оксидов, соответствующие гидроксидам H2SO4, Fe(OH)2, HClO4, Cr(OH)3 и H3PO4.
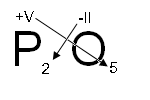
Решение: Чтобы составить эмпирическую формулу оксида, соответствующего кислоте, необходимо помнить, что степень окисления элемента в кислоте и оксиде должна быть одинаковой, например, H2S+6O4, S+6O3 (шесть разделить на два получится коэффициент при кислороде равный трем). Если коэффициенты нечетные, то они проставляются, как показано на схеме:
| +7 +7 -2 HClO4, Cl2O7 | +5 +5 -2 H3PO4, P2O5 |
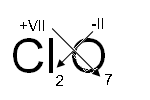
| 
|
H2S+6O4 → S+6O3 Fe+2(OH)2 → Fe+2O Cr(OH)3 → Cr2+3O3
Пример 6.Какие из приведённых оксидов будут реагировать с а) соляной кислотой; б) гидроксидом калия: Na2O, FeO, SiO2, N2O, ZnO? Ответ поясните. Составьте уравнения реакций.
Решение:
Оксид азота (I) N2O относиться к группе несолеообразующих оксидов, поэтому он не взаимодействует ни с соляной кислотой, ни с гидроксидом калия.
Оксид натрия Na2O и оксид железа (II) FeO являются основными оксидами, поэтому они могут реагировать с соляной кислотой и не могут реагировать с гидроксидом калия:
Na2O + 2HCl = 2NaCl + H2O,
FeO + 2HCl = FeCl2 + H2O.
Оксид кремния (IV) SiO2 является кислотным оксидом, т.к. кремний является неметаллом, поэтому он будет взаимодействовать с гидроксидом калия и не будет взаимодействовать с соляной кислотой:
SiO2 + 2KOH = K2SiO3 + H2O (при сплавлении).
Оксид цинка ZnO является амфотерным, поэтому он будет реагировать и с гидроксидом калия, и с соляной кислотой:
ZnO + 2KOH = K2ZnO2 + H2O (при сплавлении);
ZnO + 2HCl = 2ZnCl2 + H2O.
Приведенные примеры завершают рассмотрение классификации, номенклатуры и свойств оксидов, как класса неорганических соединений.
Гидроксиды
Гидроксиды – сложные неорганические вещества, имеющие в составе гидроксильную группу – ОН, соединенную с атомами различных химических элементов. По свойствам они подразделяются на основания, кислоты и амфотерные гидроксиды (рис. 4). Подразделение зависит от того, к какой группе принадлежит оксид, соответствующий гидроксиду. Важно отметить, что из основного оксида, никогда не получится кислотный или амфотерный гидроксид.

Рис. 4. Классификация гидроксидов.
Дата добавления: 2019-04-03; просмотров: 3499;
