МЕТАЛЛОТЕРМИЯ. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ
Металлотермия - это процесс восстановления металлов из их соединений другими металлами, химически более активными, при повышенной температуре. Иногда сюда включают также процессы восстановления неметаллами.
Многие редкие элементы впервые получены и производятся в настоящее время в больших масштабах металлотермическим методом, который отличается относительной простотой процессов и технологического оборудования. Основоположником металлотермии был русский ученый Николай Николаевич Бекетов (1827—1911).
При разработке высокотемпературных химико-технологических процессов обычно производят предварительную оценку вероятности протекания тех или иных реакций, а также соотношения продуктов реакции и исходных веществ в состоянии равновесия - константы равновесия.
Реакцию металлотермического восстановления в общем виде можно представить уравнением
MeX’ + Me'' « Me''X + Me’ + DH, (67)
где Х - анион; DH - тепловой эффект.
Протекание реакции в сторону образования продуктов (восстановление Me’) возможно при условии
DGo = (DGoT, Me''X - DGoT, Me'X) <0,
где DGoT, Me'X - энергия Гиббса реакций образования соединений МеХ из элементов при температуре реакции. Обычно считается, что в случае, когда G°T>0, реакция не идет. Однако, принимая во внимание уравнение (3), легко видеть, что Кр всегда больше нуля и при контакте исходных веществ (Me'X + Me") в любом случае получается какое-то количество продуктов реакции (минимальное для DGoT >0). Если при этом возможно осуществление процесса с отводом восстанавливаемого металла (восстановление летучего металла в вакууме), реакция протекает достаточно полно даже в случае положительного значения DGoT, и возможность технологического ее осуществления определяется в основном экономическими соображениями.
Сдвиг величины DG в нужную сторону можно осуществить, если обеспечивается связывание образующегося продукта (Me''X), например его отшлакование. Иногда для этой цели в исходную смесь специально вводят вещество, образующее устойчивые легкоплавкие соединения nMe'''X.mMe''X.
Изменение энергии Гиббса вычисляют обычными методами по уравнению (6). Для приближенной оценки возможности протекания реакции восстановления удобно пользоваться диаграммами (рис. 65-67), на которых приведены значения энергии Гиббса реакций Ме + Х ® МеХ.
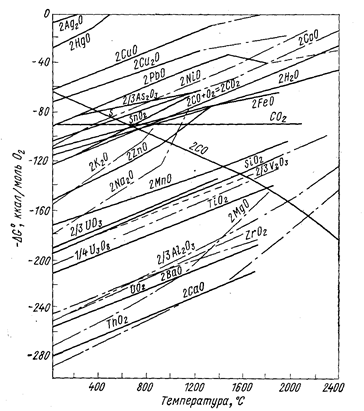
Рис. 65. Зависимость энергии Гиббса образования окислов металлов из элементов от температуры (Вольский А. А., Сергиевская Е. М., 1968, с. 251, рис. 122).
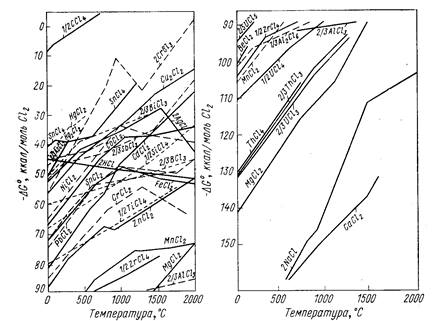
Рис. 66. Зависимость энергии Гиббса образования хлоридов из элементов от температуры (Вольский А. Н., Сергиевская Е. М., 1968, с. 256- 257, рис. 126).
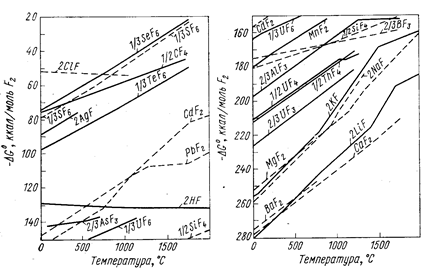
Рис. 67. Зависимость энергии Гиббса образования фторидов из элементов от температуры (Вольский А. Н.. Сергиевская Е. М., 1968, с. 267, рис. 130).
Чем больше по абсолютному значению DG° образования данного соединения, тем более оно устойчиво и тем сильнее восстановительная способность металла, входящего в это соединение. Все значения энергии Гиббса образования (см. рис. 65-67) рассчитаны не на моль образующегося соединения, а на моль газа, принимающего участие в реакции, например, по уравнениям:
½ Ti + Fa ® ½ TiF4;
Mg + F2 ® MgF2
и т. п., что делает их сопоставимыми.
Практически во всех случаях абсолютное значение DG° с повышением температуры уменьшается, что говорит об уменьшении прочности соединений, стремлении их к диссоциации.
Зависимость DG° от температуры имеет вид степенного ряда, однако кривые приведенных диаграмм приближаются к прямым в тех пределах, где отсутствуют фазовые превращения металла или соли. В точках плавления, кипения и аллотропического перехода эти прямые претерпевают излом и приобретают другой наклон. Принимая в первом приближении величину DG° не зависящей от температуры, легко показать, что угловой коэффициент каждого участка, прямой приблизительно равен отрицательному значению изменения энтропии: ∂(DG°)/∂T = -DS°. В соответствии с закономерностями изменения энтропии системы прямая претерпевает излом вверх при фазовом превращении металла и вниз при превращении соединения. Изломы резче всего в точках кипения (из-за резкого изменения энтропии системы при образовании газовой фазы). В точках полиморфного превращения изломы незначительны.
Определенность понятий металл-восстановитель и восстанавливаемый металл относительна, так как после пересечения кривых зависимости DG° от Т элементы меняются местами и реакция идет в сторону вытеснения металла, который до пересечения являлся восстановителем. В пределах твердого и жидкого состояний металлов и их соединений угловые коэффициенты прямых чаще всего близки и они почти не пересекаются. Следовательно, вплоть до точек кипения металлов и их солей повышение температуры редко изменяет последовательность вытеснения одних металлов другими. Но последовательность, часто изменяется при температуре выше точки кипения.
Кривая изменения энергии Гиббса при образовании СО (см. рис. 65) имеет обратный наклон по отношению к другим кривым, поэтому углеродом при достаточно высокой температуре можно восстановить практически все металлы из окислов (табл. 24), однако, к сожалению, при этом чаще получаются стойкие карбиды, а не чистые металлы.
Положение кривых рис. 65-67 определяет также возможность рафинировки металлов избирательным образованием соединений металлов-примесей с последующим их отшлакованием. Действительно, металлы-примеси, обладающие большими абсолютными значениями DG° образования, например, окислов, могут быть переведены в шлак избирательным окислением. Возможно удаление, например, Са и Mg из Al-сплавов продуванием кислорода, однако удаление Zr, Ti и др. таким путем осуществить не удается, так как сначала должен образоваться окисел очищаемого металла. Расположение кривой для АlСl3 показывает термодинамическую невозможность удаления из алюминиевых сплавов примесей титана избирательным хлорированием. Данные диаграмм DG° = f(T) определяют также возможность применять добавки одних металлов для «раскисления» (удаления вредных примесей) других.
Таблица 24
Дата добавления: 2019-04-03; просмотров: 619;
