Термичность восстановления окислов магнием
| Окисел | -DНо298, ккал/моль | Реакция | Термичность, кал/г |
| ВеО | 147,3 | BeO + Mg = MgO + Be | -67 |
| СеО2 | 233,0 | СеО2 + 2Mg = 2MgO + Ce | |
| Cs2О | 82,0 | Cs2O + Mg = MgO + 2Cs | |
| НfO2 | 271,5 | НfO2 + 2Mg = MgO + Hf | |
| La2O3 | 457,0 | La2O3 + 3Mg = 3MgO + 2La | -63 |
| Li2O | 142,3 | Li2O + Mg = MgO + 2Li | |
| Sc2O3 | 407,0 | Sc2O3 + 3Mg = 3MgO + 2Sc | |
| NbO | 116,0 | NbO + Mg = MgO + Nb | |
| NbO2 | 193,5 | NbO2 + 2Mg = 2MgO + Nb | |
| Nb2O3 | 463,0 | Nb2O3 + 3Mg = 3MgO + 2Nb | -101 |
| Рг2О3 | 437,0 | Рг2О3 + 3Mg = 3MgO + 2Pr | -12 |
| Rb2O | Rb2O + Mg = MgO + 2Rb | ||
| Sm2О3 | Sm2О3 + 3Mg = 3Mg0 + 2Sm | ||
| Ta2O5 | 499,0 | Ta2O5 + 5Mg = 5MgO + 2Ta | |
| ThO2 | 293,0 | ThO2 + 2Mg = 2MgO + Th | -16 |
| TiO | 135,0 | TiO + Mg = MgO + Ti | |
| Тi2О3 | 375,5 | Тi2О3 + 3Mg = 3MgO + 2Ti | |
| ТiO2 | 219,0 | ТiO2 + 2Mg = 2MgO + Ti | |
| UO2 | 255,0 | UO2 + 2Mg = 2MgO + U | 104 . |
| U3O8 | 845,0 | U3O8 + 8Mg = 8MgO + 3U | |
| UО3 | 291,0 | UО3 + 3Mg = 3MgO + U | |
| VO | 106,0 | VO + Mg = MgO + V | |
| V2O3 | 300,0 | V2O3 + 3Mg = 3MgO + 2V | |
| VO2 | 176,0 | VO2 + 2Mg = 2MgO + V | |
| V2O5 | 382,6 | V2O5 + 5Mg = 5MgO + 2V | |
| V2O3 | 441,0 | V2O3 + 3Mg = 3MgO + 2Y | -30 |
| ZrO2 | 258,5 | ZrO2 + 2Mg = 2MgO + Zr |
Использование низкокипящих восстановителей (например, магния: tкип. = 1107°С) не позволяет проводить процессы восстановления в вакууме (вследствие увеличения потерь металла). В этом случае необходимо создавать повышенное давление инертного газа, поскольку сохранение в системе воздуха приводит к образованию окислов и нитридов, загрязняющих восстанавливаемый металл.
Металлотермические способы восстановления можно классифицировать по схеме, изображенной на рис. 68. Во внепечном процессе тепла, выделяющегося в результате реакции восстановления, достаточно для полного (и достаточно быстрого) протекания процесса, расплавления шлака и (или) восстанавливаемого металла. В печных процессах недостающее тепло подводится извне, чаще всего с помощью электронагрева. Между печными и внепечными процессами нельзя провести четкую границу, так как тепловой баланс определяется их масштабами. Другими факторами, влияющими на характер процесса, являются: состав восстановителя, применяемые добавки, характер получаемого продукта (чистый металл или сплав).
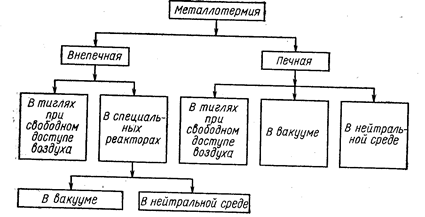
Рис. 68. Классификация металлургических процессов (Самсонов Г. В., Перминов В. П., 1971, с. 31, рис. 6).
В тех случаях, когда восстановление проходит при достаточно низкой температуре (давление насыщенного пара компонентов реакции незначительно), реакцию можно осуществлять на воздухе и в открытых аппаратах. Восстановление химически прочных соединений наиболее полно протекает чаще всего при повышенной температуре (1000°С и выше). При этой температуре, чтобы исключить испарение компонентов смеси, восстановление проводят в герметически закрытых стальных ретортах, заполненных инертным газом.
В настоящее время в технологии редких металлов используют следующие металлотермические процессы:
1) кальциетермию: La, Се, Рг, Nd из хлоридов, Th, V, Y, Sc, Gd, Tb, Dy, Но, Er, Tm, Lu из фторидов;
2) магниетермию: U,V из окислов, Ti, Zr, Th, Та из хлоридов и U из фторида;
3) натриетермию: Та, Nb, Zr из комплексных фторидов, Ti, Zr из хлоридов.
При восстановлении тугоплавких металлов в шихту иногда вводят специальные добавки, образующие с восстанавливаемым металлом сплавы с пониженной температурой плавления. Например, при восстановлении иттрия из YF3 кальцием в шихту вводят магний для образования Y-Mg-сплава, затем магний отгоняется в вакууме. Образование сплавов сопровождается уменьшением термодинамического потенциала системы. Так получают, например, ферротитан и феррованадий, сплавы Ni-Ti; Сu-Ti; Zr-Сr и др.
Большое значение для качества получаемого продукта имеет выбор исходного соединения для восстановления. При этом следует принимать во внимание, что некоторые окислы металлов можно восстановить определенными восстановителями только до промежуточной валентности (так, TiO2 алюминием восстанавливается до устойчивого низшего окисла TiO). При восстановлении хлоридов образуются сравнительно легкоплавкие шлаки, основная масса которых легко отделяется от корольков или губки восстановленного металла в самом реакторе. В некоторых случаях остатки исходных солей и восстановителя (относительно летучих) удаляются из восстановленной губки отгонкой в вакууме. Фториды как исходные материалы для восстановления более дороги, чем хлориды, но менее гигроскопичны.
Некоторые металлотермические процессы проводят в вакууме, что уменьшает возможность протекания в газовой среде вторичной реакции (окисления, образования нитридов и т. п.), снижающей выход и ухудшающей качество восстанавливаемого металла. Однако подобного эффекта можно достичь и без вакуума - при проведении реакции в среде инертного газа.
Основной особенностью вакуумных металлургических процессов являются высокая скорость и меньшая температура реакции. Как уже указывалось, проведение процесса в вакууме дает возможность осуществить на практике реакции восстановления, характеризующиеся малым, а подчас и положительным значением DG° при условии выведения из сферы реакции (отгонки) образующегося продукта (восстановленного металла или соединения металла-восстановителя). При этом очевидно, что применяемый вакуумный насос должен обеспечивать в аппарате восстановления остаточное давление, меньшее (или по крайней мере равное) равновесного давления отгоняемого продукта. В противном случае скорость процесса удаления паров из сферы реакции определяется диффузией в остаточном газе, что может привести к скоплению и повышению парциального давления отгоняемых продуктов и остановке реакции восстановления.
Итак, при атмосферном давлении достаточно высокая скорость отгонки восстанавливаемого металла достигается при рМе’ ³ 1 ат, а в вакууме - при рМе’ ³ ро.г. (где ро.г.- остаточное давление газа). Поскольку в вакууме ро.г. << 1 ат, а . рМе’ экспоненциально возрастает с температурой (уравнение Клаузиуса-Клапейрона), ясно, что достаточная скорость отгонки обеспечивается при более низкой температуре. Обычно ро.г.= 10-3-10-5 ат, поэтому восстановление проводится при температуре, обеспечивающей рМе' по крайней мере на порядок выше ро.г.
Переход Me'(ж) ® Me'(пар) по причинам кинетического характера (ускорение процесса вследствие ускорения отгонки в вакууме) не может не сказаться на термодинамике процесса. Рассмотрим влияние вакуумирования системы на термодинамику процесса восстановления металла Me' из твердного окисла Ме'О(тв.) с помощью другого твердого металла-восстановителя Ме"(тв.) при постоянной температуре. При атмосфером давлении
Ме'О(тв) + Me"(тв.) « Me'(ж) + Ме"О(тв.)
Реакция характеризуется величиной DGoатм. Восстановление в вакууме:
Ме'О(тв) + Me"(тв.) « Me'(ж) + Ме"О(тв.) (DGвак)
Вычитая одно уравнение из другого, найдем, что изменение энергии Гиббса состояния системы DG, соответствующее переходу металла из жидкого состояния в пар [.Me'(ж) ®Me'(nap)], равно
DGвак - DGoатм = DG (70)
Известно, что энергия Гиббса перехода 1 г-атома металла из жидкого состояния в пар при рпар = 1 ат равна нулю, а работа перехода 1 г-атома пара от давления 1 ат к рМе равна
-RT ln pMe = DG (71)
Отсюда -RT ln pMe = DGвак - DGoатм или DGвак = DGoатм + 2,ЗRT lgpMe. Примем ро.г = pMe, тогда
DGвак = DGoатм + 2,З RT lg pо.г (72)
Из полученного выражения видно, что энергия Гиббса DGo процесса восстановления уменьшается на величину 2,З RT lg pо.г, поскольку pо.г << 1. Величина этого сдвига возрастает с повышением температуры и степени разрежения в системе. Приведем зависимость разности DGвак - DGoатм от разрежения при Т =1000° К:
| pо.г | 10-1 | 10-3 | 10-5 |
| DGвак - DGoатм, ккал | 4,6 | 13,8 | 23,0 |
Абсолютные значения DGoвосст окислов лежат обычно в пределах 30-150 ккал/моль. Отсюда ясна важная роль вакуума как термодинамического фактора. Правда, для практических расчетов целесообразнее принимать рМе » 10 ро.г, что несколько снижает термодинамический эффект вакуумирования.
Продуктом реакции может быть сложное соединение (шлак) состава nМеО2.mМе''O2 (например, при восстановлении СаО алюминием образуется 3CaO.Al2O3. Очевидно, вхождение образующегося окисла в соединение (шлак) снижает его активность, что благоприятно сказывается на протекании реакции восстановления. Однако иногда шлаки могут закрывать поверхность реагирующих веществ, что сильно замедляет реакцию.
Расчет DGoвосст практически возможен лишь в том случае, если компоненты реакции взаимно нерастворимы. При этом условии можно принять значения активности всех конденсированных фаз равными единице (или принять давление их насыщенного пара равным давлению насыщенного пара над чистыми веществами). В случае взаимной растворимости или образования соединений активности конденсированных фаз не равны 1, а данные, учитывающие эти отклонения, для большинства систем отсутствуют. Поэтому термодинамический анализ без учета явлений, возникающих в реальных системах, дает лишь приблизительное представление о протекающих процессах. Однако даже приблизительная, полуколичественная оценка часто позволяет сделать определенные выводы о наилучших условиях восстановления или о наиболее перспективном направлении поиска.
Дата добавления: 2019-04-03; просмотров: 450;
