Восстановление TiCl4 магнием
В промышленной практике широко используют восстановление хлоридов титана. Восстановление TiCl4 металлами осуществляется в крупномасштабном производстве, поэтому выбор подходящего восстановителя определяется не только термодинамическими данными, но также соображениями экономики и технической осуществимости. Наиболее интересны с этой точки зрения реакции, перечисленные в табл. 27.
Таблица 27
Уравнения для расчета изменения энергии Гиббса реакции восстановления металлами
| Реакция | Уравнение энергии Гиббса, кал |
| ½ TiCl4 + 2Na = 2NaCl + ½ Ti | - 110 200 + 28 Т |
| ½ TiCl4 + Ca = CaCl2 + ½ Ti | - 94 200 + 15,9Т |
| ½ TiCl4 + Mg = MgCl2 + ½ Ti | - 66 800 + 22Т |
| ½ TiCl4 + ⅔Al = ⅔ AlCl3 + ½ Ti | - 9600 + 12, ЗТ |
В промышленности широкое распространение получили процессы восстановления магнием и натрием. Для восстановления TiCl4 алюминием требуется более высокая температура. Этот процесс осложнен также образованием сплава Ti-Al.
Способ магниетермического восстановления TiCl4 - основной в технологии титана. Достаточно сказать, что при проектировании всех заводов в СССР принят этот способ производства металлического титана. Приемлемый для промышленного производства способ получения титана магниетермическим восстановлением впервые был предложен Кроллем в 1940 г., причем первый аппарат Кролля был рассчитан на получение менее 300 г металла за цикл. Советский Союз по производству титана вышел на одно из первых мест в мире. В нашей стране созданы аппараты, позволяющие за один цикл получать 1,5-2 т титановой губки («Редмет-500», «Редмет-501»)
Для реакции
½ TiCl4 + Mg = MgCl2 + ½ Ti
выражение для константы имеет вид
Kp = 1/ [pTiCl4.p2Mg]
При избытке магния pMg = const и определяется температурой проведения реакции. Зная pMg и рассчитывая Кр реакции по уравнению (13), легко определить равновесное давление пара TiCl4, или, иными словами, полноту протекания процесса. Так, принимая для 800° С DGo » 80 ккал, имеем lg Kp = 80000/[4,57.1053] » 16. При избытке магния (800° С) pMg = 0,04ат: pTiCl4 =1/ p2MgKp = 1/ 0,042.1016 = 6,25.10-14 ат.
В реакционной системе кроме основной реакции восстановления могут протекать и другие реакции:
А. 2TiCl4 + Mg = 2ТiО3 + MgCl2 (I);
TiCl4 + Mg = ТiCl2 + MgCl2 (II);
TiCl4 + 2Mg = Ti + 2MgCl3 (III);
2TiCl3 + Mg = 2 TiCl4 + MgCl2 (IV);
2/зTiCl3 + Mg = 2/з Ti+MgCl2 (V);
TiCl2 + Mg = Ti + MgCl2 (VI);
Б. TiCl4 + Ti = 2TiCl2 (VII);
2TiCl4 + 2 TiCl2 = 4TiCl3 (VIII);
2TiCl4 + ⅔Ti = 8/3TiCl3 (IX);
2TiCl3 + Ti = 3TiCl2 (X);
B. 2TiCl4 + 2Mg = 2TiCl3 + 2MgCl (XI);
2TiCl4 + 2MgCl = 2TiCl3 + 2MgCl2 (XII);
2ТiСl3 + 2Mg = 2TiCl2 + 2MgCl (XIII);
2ТiСl3 + 2MgCl = 2TiCl2 + 2MgCl2 (XIV);
TiCl2 + 2MgCl = Ti + 2MgCl2 (XV);
Все возможные реакции разбиты на три группы: А - основные реакции - восстановление TiCl4 магнием до TiCl3, TiCl2, Ti, а также реакции довосстановления низших хлоридов; Б - вторичные реакции - взаимодействие TiCl4 с продуктами основных реакций, реакции диспропорционирования низших хлоридов; В - реакции с образованием субхлорида магния и его участием в качестве восстановителя.
При взаимодействии в конденсированных фазах термодинамически вероятны реакции (I-VI), а также (XI-XIII). Из вторичных процессов наиболее вероятна реакция (VII). Реакции (VIII) и (IX) характеризуются малой убылью энергии Гиббса, однако протекание их возможно, поскольку TiCl3 обладает высоким давлением насыщенного пара и может удаляться из сферы реакции.
В газовой фазе наиболее вероятны реакции первичного образования низших хлоридов TiCl2 и TiCl3; возможны также и вторичные реакции их образования.
Все реакции с участием субхлорида магния в качестве восстановителя характеризуются большой убылью энергии Гиббса, что может способствовать протеканию реакций его образования.
В настоящее время реакторы восстановления в промышленных условиях имеют диаметры от 850-1000 до 1300-1500 м.и при высоте от 1800-2000 до 3000 мм. Наиболее употребляемые материалы для их изготовления - малоуглеродистые, хромоникелевые стали, а также биметаллы.
Обычно используют два типа реакторов: с вставным реакционным стаканом и без стакана. Реакционный стакан предохраняет корпус реактора от проплавления и облегчает удаление реакционной массы, однако зазор между стенками стакана и аппарата резко ухудшает теплоотвод, уменьшает полезный объем аппарата. Вакуумируют реактор и подают в него TiCl4 и аргон через центральную трубу на крышке, MgCl2 сливают с помощью сифона или патрубков, расположенных сбоку или в центре днища. На рис. 69 приведена схема промышленного аппарата без стакана. Тепло от реактора отводят, как правило, охлаждая зону преимущественного протекания реакции воздухом. Охлаждающий воздух подают в нескольких точках по окружности печи. Вентиляторы включают и подают охлаждающий воздух с помощью автоматической системы.
Разнообразие возможных реакций определяет сложность установления истинного механизма протекания процесса восстановления. В настоящее время наибольшее распространение получило следующее описание процесса. Реакция происходит между жидким магнием и TiCl4 на поверхности губки, растущей у стенок аппарата, выше первоначального уровня восстановителя.
Магний к поверхности губки поднимается капиллярными силами по порам и покрывает ее поверхность пленкой. Процесс носит автокаталитический характер. Катализатором служит активная (не перекрытая хлористым магнием) поверхность губки. Предполагается, что молекулы TiCl4 проходят через стадию активированной адсорбции.
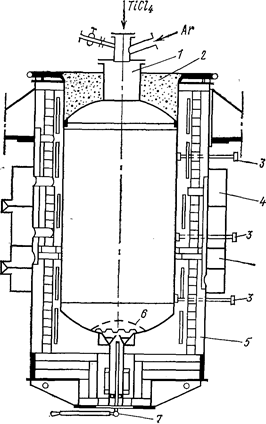
Рис. 69. Схема электропечи и реактора для восстановления магнием (Самсонов Г. В., Перминов В. П., 1971, с. 92, рис. 17):
1- реактор; 2 - крышка; 3 - термопары; 4 - воздушные коллекторы для подачи в печь охлаждающего воздуха; 5 - электропечь; 6 - перфорированное дно; 7 - запорное устройство.
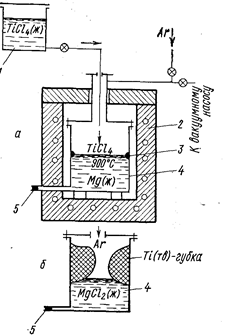
Рис. 70. Восстановление TiCl4 магнием (Вольский А. Н Сергиевская Е. М., 1968, с. 260, рис. 128):
а - начало процесса; б - конец процесса;
1- бачок с TiCl4; 2 - электропечь; 3 – место появления титановой губки; 4 - аппарат вос-становления; 5 - летка для выпуска расплава MgCl2.
Образующийся по реакции хлористый магний опускается под слой расплавленного магния (плотность MgCl2 1,68 г/см3, Mg 1,57 г/см3). Схематично рост губки в аппарате восстановления TiCl4, представлен на рис. 70. Плотность титана больше плотности MgCl2, и часть титана опускается на дно.
При высокой температуре TiCl4 реагирует с материалом реактора - железом. При этом получаются низшие хлориды и титаниды железа:
Fe + 2TiCl4 = FeCl2 + 2TiCl3;
Fe + TiCl4 = FeCl2 + TiCl2;
Fe + 2TiCl2 = FeTi + TiCl4;
Fe + 4TiCl3 = FeTi + 3TiCl4;
3Ti + 2FeCl2 = 2FeTi + TiCl4.
Побочные реакции загрязняют губку железом и низшими хлоридами. Часть низших хлоридов растворяется в хлористом магнии и довосстанавливается до титана магнием, также растворенным в MgCl2. Однако значительная часть образовавшихся низших хлоридов остается на поверхности губки, крышке и боковых стенках реактора. При демонтаже реактора низшие хлориды взаимодействуют с влагой воздуха и разлагаются с образованием окиси титана и НСl. Происходит также реакция диспропорционирования с образованием тонкодисперсного порошка металлического титана и паров TiCl4. Мелкодисперсный титан пирофорен и при выборке губки часто загорается. Пары TiCl4 портят вакуумное масло и насосы.
Большинство исследователей считают, что реакции в газовой фазе не имеют места или протекают в особых условиях (пониженные концентрации, начало процесса и т. п.).
В настоящее время из двух вариантов процесса: с догрузкой восстановителя и с единовременной загрузкой - предпочтение отдается последнему.
Представляет интерес разработка процесса восстановления TiCl4 магнием в условиях одновременной подачи исходных реагентов: магния и TiCl4. При этом могут создаться более благоприятные условия для реагирования.
Рассмотрим более подробно современную технологию. Реакционный стакан и реактор перед проведением процесса тщательно очищают (механическим способом, травлением соляной кислотой, металлическими щетками и обдувкой). Магний загружают в виде чушек, слитков или в расплавленном состоянии. Твердый магний перед загрузкой очищают от поверхностных пленок и шлаковых включений травлением в 0,5-1%-ном растворе НС1 с последующей промывкой водой. Загрузка в реактор проводится в «сухих комнатах». Для загрузки расплава применяют специальный вакуумный тигель-дозатор. Реактор перед установкой в печь восстановления вакуумируют и проверяют на герметичность, затем заполняют сухим инертным газом. В печи реактор разогревается до 400-600° С с одновременным вакуумированием. Затем его снова заполняют аргоном и разогревают до 650-760° С. При этой температуре давление инертного газа в реакторе снижают до 0,05-0,1 ат и подают TiCl4.
Вначале процесс восстановления протекает медленно - до появления на стенках реактора первых частиц титана. После этого процесс вступает в основную стадию. В процессе восстановления периодически производится слив MgCl2. В конце процесса восстановления после прекращения подачи TiCl4 для довосстановления низших хлоридов и более полного отделения MgCl2 делают 30-60-минутную выдержку при 900° С, после чего проводят последний слив MgCl2. Затем в аппарат подают аргон и охлаждают в печи до 800° С (если реактор изготовлен из нержавеющей стали) или до 600° С (из малоуглеродистой стали), чтобы избежать окисления поверхности реактора на воздухе. Дальнейшее охлаждение аппарата до 20-40° С проводят на специальном стенде с орошением его поверхности водой или обдувкой.
Реакционная масса состоит из 45-60% губчатого титана, 15-35% MgCl2 и 25-35% Mg. Содержимое аппарата восстановления высверливается на станке или удаляется с помощью отбойного молотка.
Предложено несколько режимов подачи TiCl4 в аппарат, однако лучшие показатели получены для режима стабильной максимально возможной скорости подачи в течение всего процесса. На рис. 71 показана схема автоматического регулирования процесса восстановления.
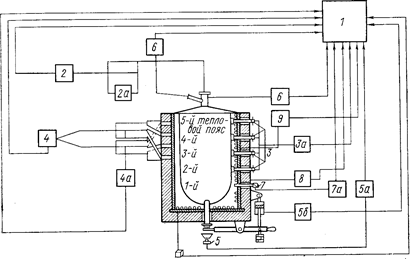
Рис. 71. Схема автоматического регулирования процесса восстановления (Самсонов Г. В., Перминов В. П., 1971, с. 70, рис. 14):
1- пульт программирования и сигнализация; 2 - расходомер TiCl4 с регулирующим клапаном 2а; 3 - термощупы для измерения температуры в зоне реакции с многопозиционным потенциометром За; 4 - вентилятор охлаждения печи с исполнительным механизмом переключения шиберов воздушного коллектора 4а: 5 - тензовесы с весомером 5а и клапаном 5б пневмоцилиндра привода устройства для слива хлористого магния; 6 - приборы регулирования давления аргона и TiCl4 в реакторе; 7 - термопара с потенциометром 7а для измерения температуры в нижней зоне реактора; 8, 9 -вольт-амперметры.
Титановую губку можно отделить от MgCl2 и магния дистилляцией в вакууме, гидрометаллургическим способом и по комбинированной схеме. В настоящее время предпочтение отдают дистилляционному методу сепарации губки. Дистилляция исключает возможность окисления порошка титана и поглощения водорода, неизбежных при гидрометаллургической обработке. Отгонка магния и MgCl в вакууме основана на высоком давлении насыщенного пара этих веществ при повышенной температуре (табл. 28).
Таблица 28
Дата добавления: 2019-04-03; просмотров: 2080;
